(苏教版选修3)化学:41《分子构型与物质的性质》课件
文档属性
| 名称 | (苏教版选修3)化学:41《分子构型与物质的性质》课件 |  | |
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-15 08:50:00 | ||
图片预览

文档简介
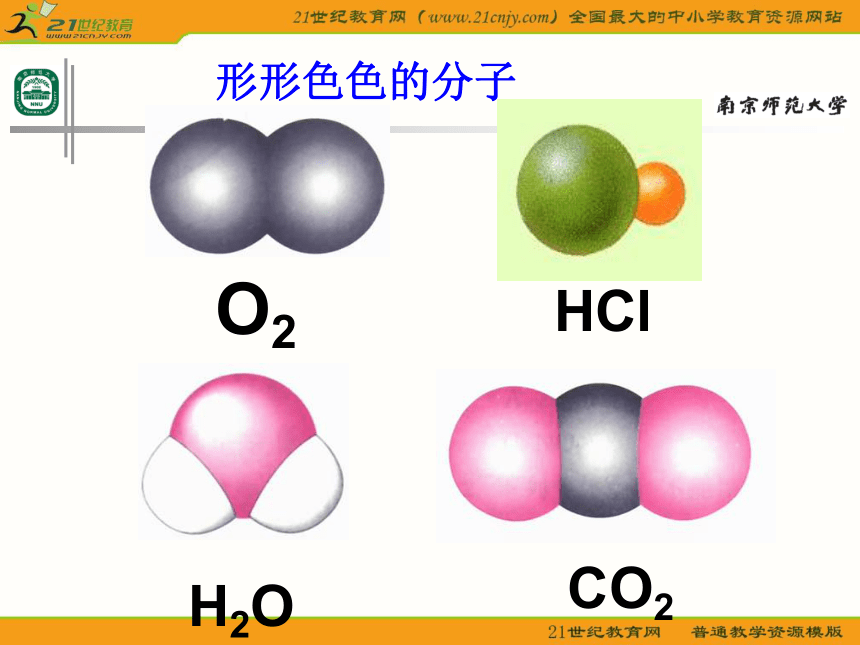
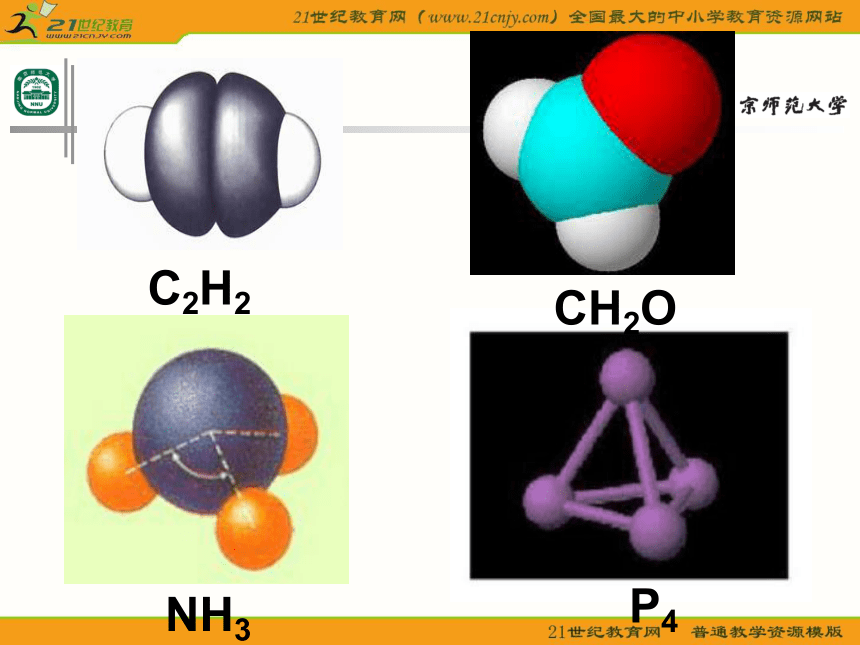
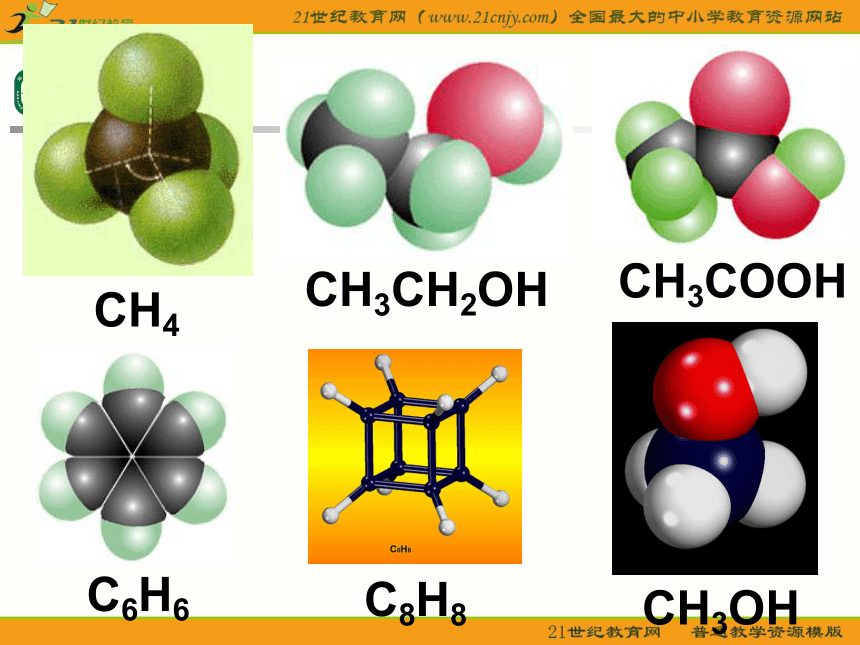
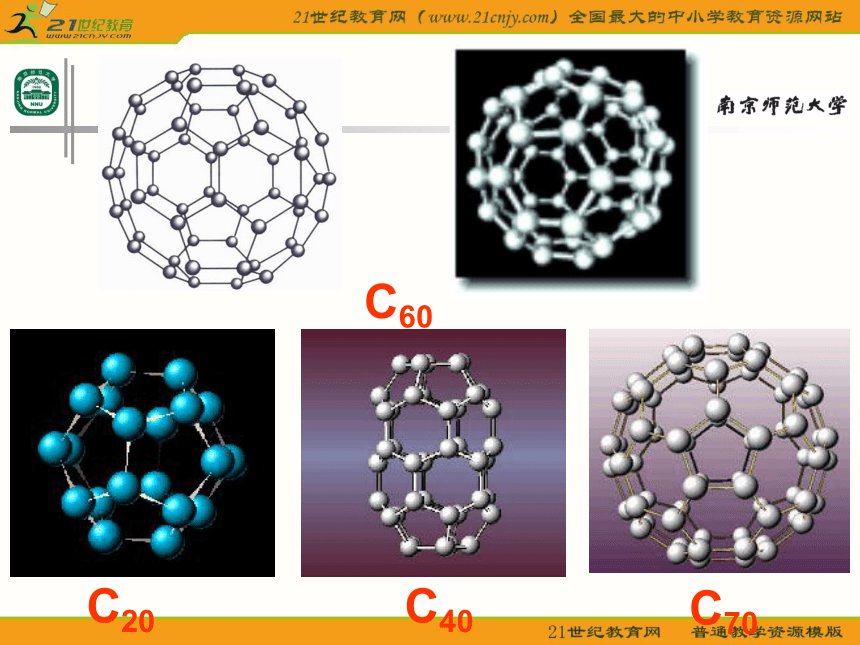
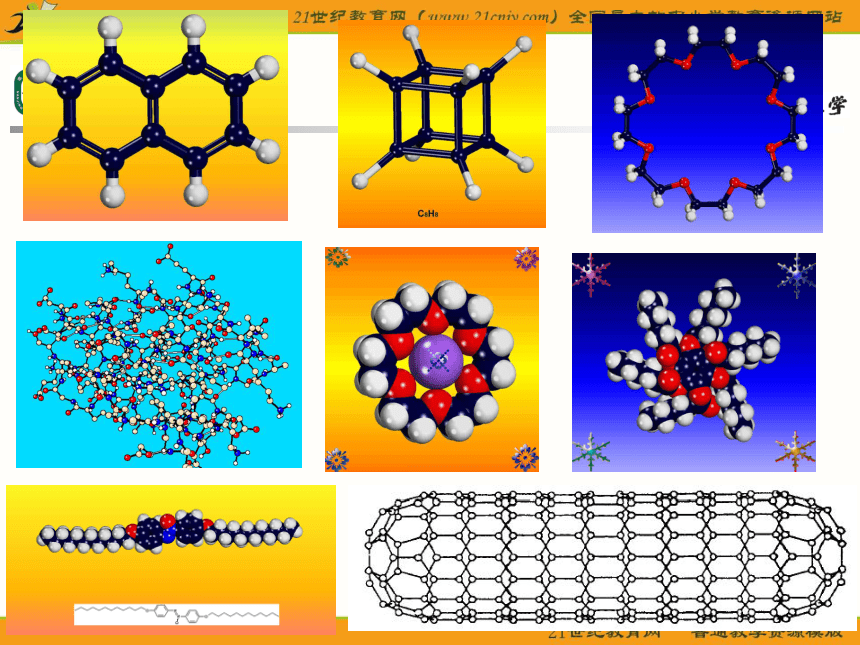
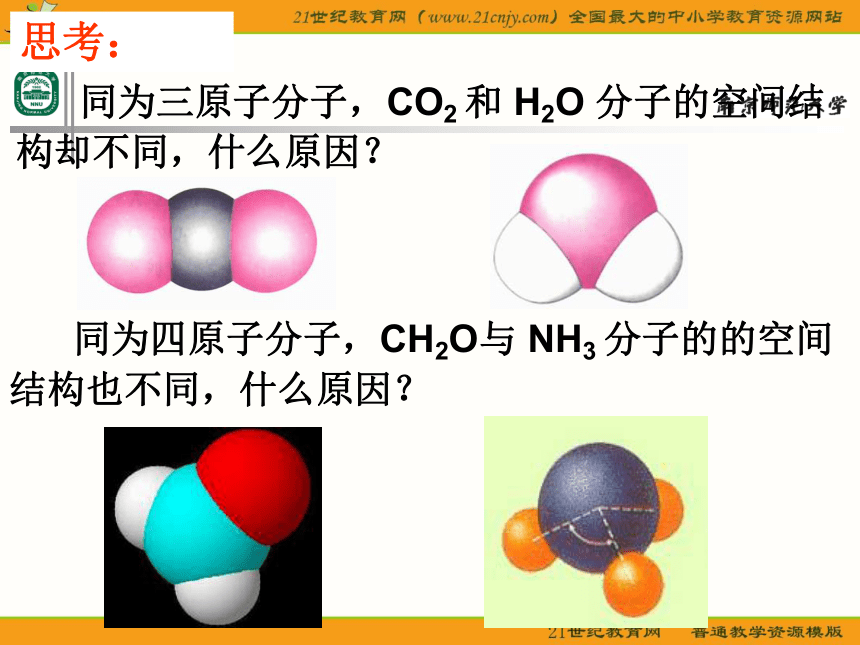
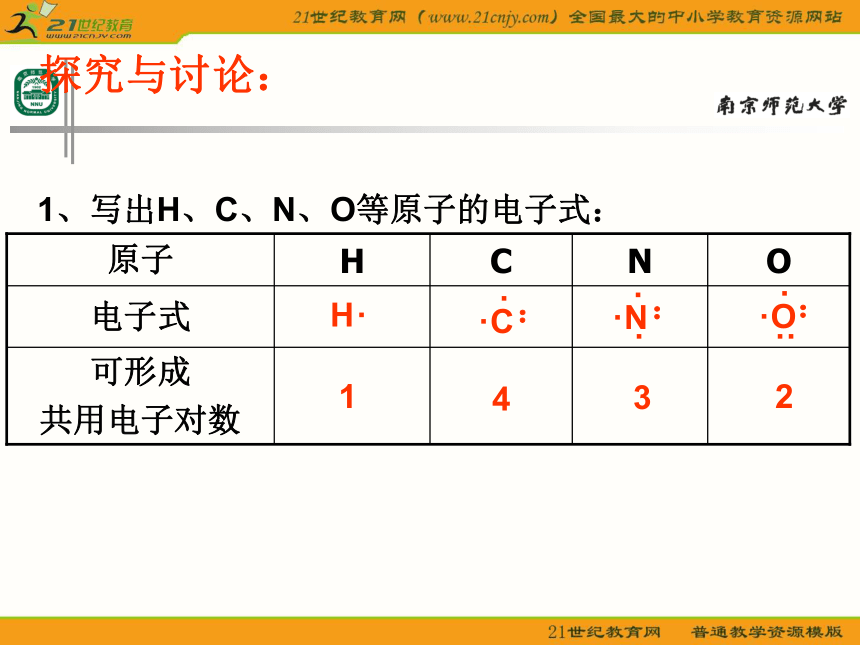
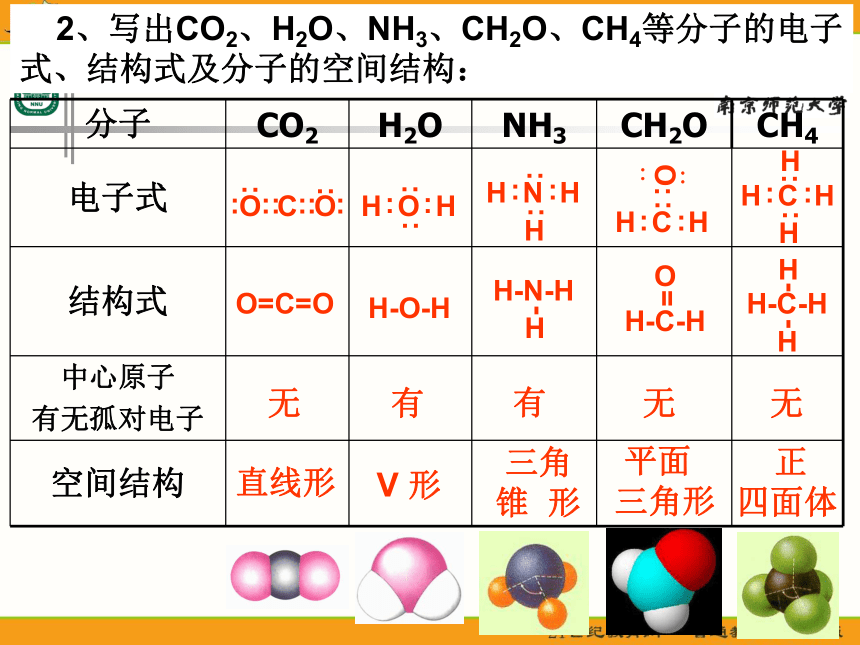
课件23张PPT。分子的空间构型形形色色的分子O2HClH2OCO2C2H2CH2ONH3P4CH4CH3CH2OHCH3COOHC6H6C8H8CH3OHC60C20C40C70思考: 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因? 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?探究与讨论: 2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:O=C=OH-O-H无有有无无直线形V 形三角
锥 形 平面
三角形 正
四面体分子的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向尽可能采取对称的空间构型。价层电子对互斥理论:基本要点:分子或离子的空间构型与中心原子的
价层电子对数目有关。价层电子对尽可能远离,以使斥力最小。价层电子对互斥理论确定电子对的空间构型:VP=2 直线形VP=3 平面三角形VP=4 正四面体VP=5 三角双锥VP=6 正八面体确定中心原子的孤对电子对数,推断分子的空间构型。① LP=0:分子的空间构型=电子对的空间构型VP= (2+2)=2 直线形VP= (3+3)=3 平面三角形VP= (4+4)=4 四面体VP= (5+5)=5 三角双锥VP= (6+6)=6 八面体例如:②LP≠0 :分子的空间构型不同于电子对的空间构型。34611 21 2SnCl2平面三角形 V形NH3四面体 三角锥H2O四面体 V形IF5八面体 四方锥XeF4八面体 平面正方形VP = 5,电子对空间构型为三角双锥,LP占据轴向还是水平方向三角形的某个顶点?原则:斥力最小。例如:SF4 VP=5 LP=1 S FF FFLP-BP(90o) 3 2 结论:LP占据水平方向三角形, 稳定分子构型为变形四面体(跷跷板形)。三角双锥 变形四面体 SF4三角双锥 T形 ClF3三角双锥 直线形 XeF2(3)判断共价分子结构的实例 例 1 利用价层电子对互斥理论判断下列分子和离子的几何
构型。要求写出价层电子总数、对数、电子对构型和分子构型 。
AlCl3 H2S SO32 - NH4 + NO2 IF3直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体 具有相同的通式——ABm,而且价电子总数相等的分子或离子具有相同的结构特征,这个原理称为“等电子体原理”。这里的“结构特征”的概念既包括分子的立体结构,又包括化学键的类型,但键角并不一定相等,除非键角为180?或90?等特定的角度。
(1)CO2、CNS–、NO2+、N3–具有相同的通式—AX2,价电子总数16,具有相同的结构—直线型分子,中心原子上没有孤对电子而取sp杂化轨道,形成直线形s-骨架,键角为180?,分子里有两套?34p-p大?键。等电子体原理 (2)CO32–、NO3–、SO3等离子或分子具有相同的通式—AX3,总价电子数24,有相同的结构—平面三角形分子,中心原子上没有孤对电子而取sp2杂化轨道形成分子的s-骨架,有一套?46p-p大?键。
(3)SO2、O3、NO2–等离子或分子,AX2,18e,中心原子取sp2杂化形式,VSEPR理想模型为平面三角形,中心原子上有1对孤对电子(处于分子平面上),分子立体结构为V型(或角型、折线型),有一套符号为?34的p-p大?键。 (4)SO42–、PO43–等离子具有AX4的通式,总价电子数32,中心原子有4个s-键,故取sp3杂化形式,呈正四面体立体结构; (5)PO33–、SO32–、ClO3–等离子具有AX3的通式,总价电子数26,中心原子有4个s-轨道(3个s-键和1对占据s-轨道的孤对电子),VSEPR理想模型为四面体,(不计孤对电子的)分子立体结构为三角锥体,中心原子取sp3杂化形式,没有p-pp键或p-p大?键,它们的路易斯结构式里的重键是d-p大?键。
锥 形 平面
三角形 正
四面体分子的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向尽可能采取对称的空间构型。价层电子对互斥理论:基本要点:分子或离子的空间构型与中心原子的
价层电子对数目有关。价层电子对尽可能远离,以使斥力最小。价层电子对互斥理论确定电子对的空间构型:VP=2 直线形VP=3 平面三角形VP=4 正四面体VP=5 三角双锥VP=6 正八面体确定中心原子的孤对电子对数,推断分子的空间构型。① LP=0:分子的空间构型=电子对的空间构型VP= (2+2)=2 直线形VP= (3+3)=3 平面三角形VP= (4+4)=4 四面体VP= (5+5)=5 三角双锥VP= (6+6)=6 八面体例如:②LP≠0 :分子的空间构型不同于电子对的空间构型。34611 21 2SnCl2平面三角形 V形NH3四面体 三角锥H2O四面体 V形IF5八面体 四方锥XeF4八面体 平面正方形VP = 5,电子对空间构型为三角双锥,LP占据轴向还是水平方向三角形的某个顶点?原则:斥力最小。例如:SF4 VP=5 LP=1 S FF FFLP-BP(90o) 3 2 结论:LP占据水平方向三角形, 稳定分子构型为变形四面体(跷跷板形)。三角双锥 变形四面体 SF4三角双锥 T形 ClF3三角双锥 直线形 XeF2(3)判断共价分子结构的实例 例 1 利用价层电子对互斥理论判断下列分子和离子的几何
构型。要求写出价层电子总数、对数、电子对构型和分子构型 。
AlCl3 H2S SO32 - NH4 + NO2 IF3直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V 型平面三角形三角锥形四面体正四面体正四面体SO42-04正四面体 具有相同的通式——ABm,而且价电子总数相等的分子或离子具有相同的结构特征,这个原理称为“等电子体原理”。这里的“结构特征”的概念既包括分子的立体结构,又包括化学键的类型,但键角并不一定相等,除非键角为180?或90?等特定的角度。
(1)CO2、CNS–、NO2+、N3–具有相同的通式—AX2,价电子总数16,具有相同的结构—直线型分子,中心原子上没有孤对电子而取sp杂化轨道,形成直线形s-骨架,键角为180?,分子里有两套?34p-p大?键。等电子体原理 (2)CO32–、NO3–、SO3等离子或分子具有相同的通式—AX3,总价电子数24,有相同的结构—平面三角形分子,中心原子上没有孤对电子而取sp2杂化轨道形成分子的s-骨架,有一套?46p-p大?键。
(3)SO2、O3、NO2–等离子或分子,AX2,18e,中心原子取sp2杂化形式,VSEPR理想模型为平面三角形,中心原子上有1对孤对电子(处于分子平面上),分子立体结构为V型(或角型、折线型),有一套符号为?34的p-p大?键。 (4)SO42–、PO43–等离子具有AX4的通式,总价电子数32,中心原子有4个s-键,故取sp3杂化形式,呈正四面体立体结构; (5)PO33–、SO32–、ClO3–等离子具有AX3的通式,总价电子数26,中心原子有4个s-轨道(3个s-键和1对占据s-轨道的孤对电子),VSEPR理想模型为四面体,(不计孤对电子的)分子立体结构为三角锥体,中心原子取sp3杂化形式,没有p-pp键或p-p大?键,它们的路易斯结构式里的重键是d-p大?键。
