(苏教版选修3)化学:4.1《分子构型与物质的性质》教案
文档属性
| 名称 | (苏教版选修3)化学:4.1《分子构型与物质的性质》教案 |

|
|
| 格式 | rar | ||
| 文件大小 | 577.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-15 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一单元 分子构型与物质的性质
第一课时 分子的空间构型
高考资源网【学习目标】
1.理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2.学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3.掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
4.了解等电子原理及其应用。
【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法、等电子原理
【学习难点】杂化轨道理论、价层电子对互斥理论
【学习方法】讲解法、归纳法
【教学过程】
〖你知道吗〗
1.O原子与H原子结合形成的分子为什么是H2O,而不是H3O或H4O?
2.C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
3.为什么H2O分子是“V”型.键角是104.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
1. CH4 —— sp3杂化
轨道排布式:
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
(3)杂化轨道能量相同,成分相同,如:每个sp3杂化轨道占有 个s轨道、 个p轨道;
(4)杂化轨道总数等参与杂化的原子轨道数目之和,如 个s轨道和 个p轨道杂化成 个sp3杂化轨道
(5)正四面体结构的分子或离子的中心原子,一般采取sp3杂化轨道形式形成化学键,如CCl4、NH4+等,原子晶体金刚石、晶体硅、SiO2等中C和Si也采取sp3杂化形式,轨道间夹角为 。
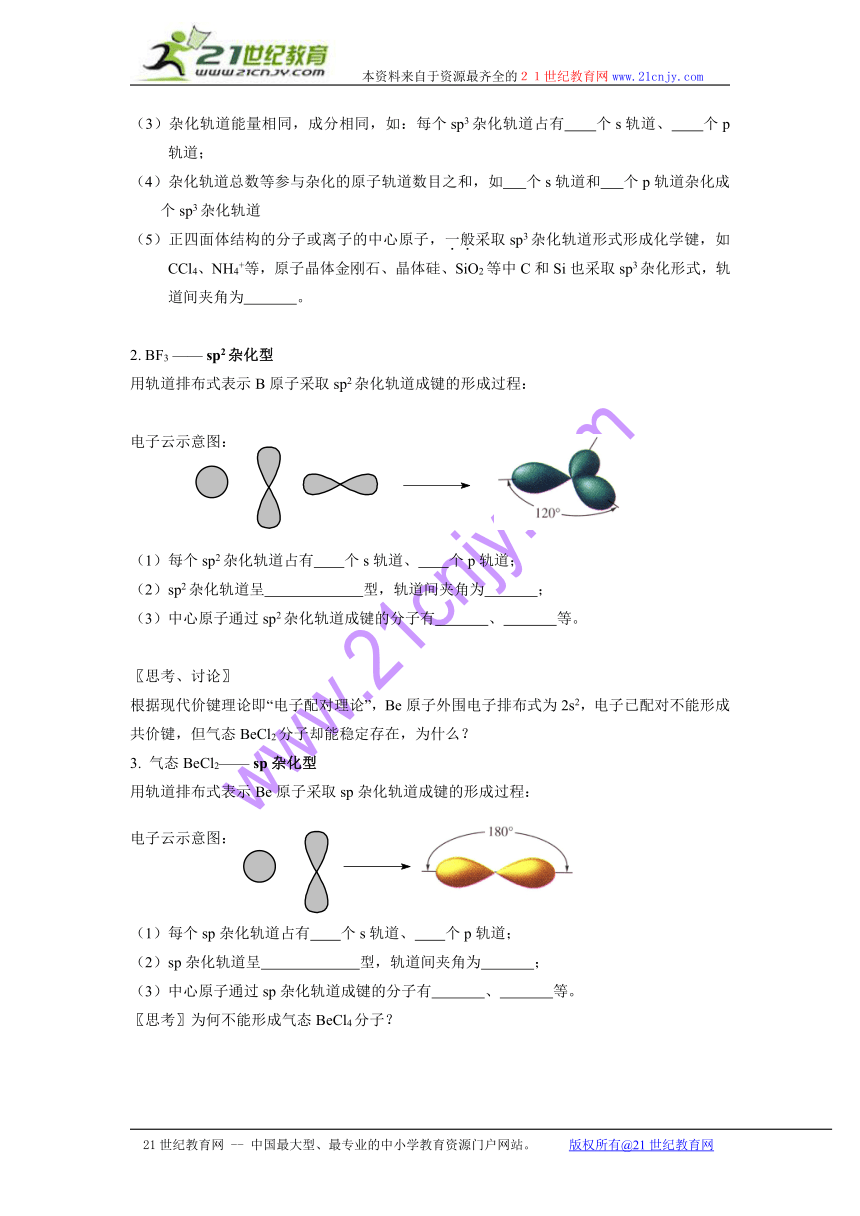
2. BF3 —— sp2杂化型
用轨道排布式表示B原子采取sp2杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp2杂化轨道占有 个s轨道、 个p轨道;
(2)sp2杂化轨道呈 型,轨道间夹角为 ;
(3)中心原子通过sp2杂化轨道成键的分子有 、 等。
〖思考、讨论〗
根据现代价键理论即“电子配对理论”,Be原子外围电子排布式为2s2,电子已配对不能形成共价键,但气态BeCl2分子却能稳定存在,为什么?
3. 气态BeCl2—— sp杂化型
用轨道排布式表示Be原子采取sp杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp杂化轨道占有 个s轨道、 个p轨道;
(2)sp杂化轨道呈 型,轨道间夹角为 ;
(3)中心原子通过sp杂化轨道成键的分子有 、 等。
〖思考〗为何不能形成气态BeCl4分子?
【例题选讲】
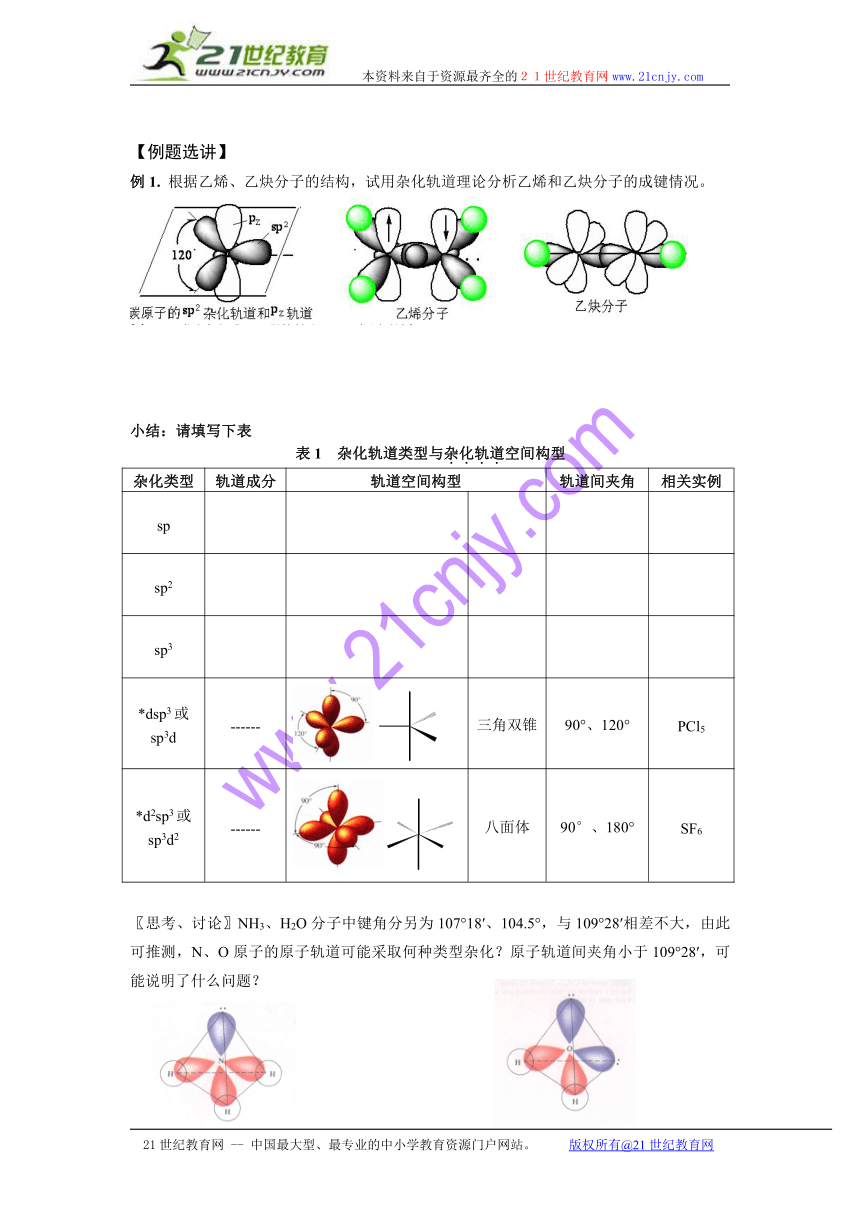
例1. 根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
小结:请填写下表
表1 杂化轨道类型与杂化轨道空间构型
杂化类型 轨道成分 轨道空间构型 轨道间夹角 相关实例
sp
sp2
sp3
*dsp3或sp3d ------ 三角双锥 90°、120° PCl5
*d2sp3或sp3d2 ------ 八面体 90°、180° SF6
〖思考、讨论〗NH3、H2O分子中键角分另为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
二、价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
1. 价电子对:包括孤对电子对和成键电子对,一般孤对电子对离核较近。
2. 价电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间构型受到影响,一般,分子尽可能采取对称的空间结构以减小斥力。
相邻电子对间斥力大小顺序:
孤对电子对孤对电子对>孤对电子对成键电子对>成键电子对成键电子对
*叁键叁键>叁键双键>双键双键>双键单键>单键单键
三、不等性杂化
NH3、H2O的分子构型也可通过不等性杂化解释,即中心原子的孤对电子也参与杂化,得到性质不完全等同的杂化轨道,轨道的s成分和p成分不全相同,孤对电子对较密集于氮原子或氧原子周围。由于孤对电子对的杂化轨道排斥成键电子的杂化轨道,以致轨道夹角不等,氨分子和水分子成键电子对之间的夹角都小于109°28′。水分子中的氧原子有两个孤对电子对,它的O-H键之间的夹角比氨分子中N-H键之间夹角受到的排斥力作用更大。
例3. BF3是平面三角型的几何构型,但NF3却是三角锥型的几何构型,试用所学理论加以说明。
四、确定分子空间构型的简易方法
1. 对于ABm型分子
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl5 中
(2)O、S作为配位原子时按不提供价电子计算,作中心原子时价电子数为6;
(3)离子的价电子对数计算
如:NH4+ : ; SO42- :
例4. 计算下列分子或离子中的价电子对数,并根据已学填写下表
物质 价电子对数 中心原子杂化轨道类型 杂化轨道/电子对空间构型 轨道夹角 分子空间构型 键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
2. 对于ABm型分子的空间构型(分子空间构型指不包括孤对电子对的空间的排布)
(1)价层电子对数=配位原子数时,分子空间构型与杂化轨道空间构型相同
价电子对数 中心原子杂化轨道类型 杂化轨道/电子对空间构型 轨道夹角 实例 分子空间构型 键角
n=2 直线型 气态BeCl2、CO2
n=3 平面三角形 BF3、BCl3
n=4 四面体 CH4 、NH4+
n=5 dsp3或sp3d 三角双锥 90°、120° PCl5 三角双锥 90°、120°
n=6 d2sp3或sp3d2 八面体 90°、180° SF6 正八面体 90°、180°
(2)价层电子对数≠配位原子数时(一般存在孤对电子对),分子空间构型与杂化轨道空间构型不同,一般由于价层电子对之间的斥力不同导致。确定分子的稳定构型时应考虑三种电子对之间的排斥作用:一般孤对电子对间排斥作用数最少为最稳定构型,其次考虑孤对电子对-成键电子对排斥作用数,最后考虑成键电子对-成键电子对排斥作用数。
如:XeF4分子空间构型的确定:价层电子对为6,电子对构型为八面体,Xe的配位原子数为4,存在两对孤对电子对,分子空间构型可能存在以下两种:
(a) (b)
构型: (a) (b)
孤对电子对-孤对电子对排斥作用数: 0 1
孤对电子对-成键电子对排斥作用数: 8 6
成键电子对-成键电子对排斥作用数: 4 5
构型(a)比构型(b)的孤对电子对-孤对电子对排斥作用数少,因此,构型(a)是XeF4较稳定的空间构型。
说明:电子对空间构型与分子构型既有区别又有联系,分子构型可根据价层电子对互斥理论从电子对空间构型推导而得,此规律一般不适用于推测过渡金属化合物的几何构型,对极少数化合物判断也不准,如:CaF2、SrF2、BaF2,是弯曲型而不是预期的直线型。
表2 部分分子的空间构型与价层电子对空间构型
价电子对数 杂化轨道/电子对空间构型 轨道夹角 实例 成键电子对数 孤对电子对数 分子空间构型 键角
n=3 平面三角形 120° SO2、PbCl2 22 11 V型V型 119.5°----
n=4 正四面体 109°28′ H2O、NH3 23 21 V型、三角锥型 104.5°、107°18′
*n=5 三角双锥 90°、120° XeF2 2 3 直线型 180°
*n=6 正八面体 90°、180° XeF4XeOF4 45 21 正方形四方锥形 90°-----
例5: 用价层电子对互斥理论推测下列分子的空间构型
①CS2 ② NCl3 ③SO42-
④NO3- ⑤SO3 ⑥H3O+
五、等电子原理
1. 规律内容:具有相同 和相同 的分子或离子具有相同的结构特征,某些物理性质也相似。如:CO与N2,SiCl4、SiO44-与SO42-
2. 等电子原理的应用
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
如 、 、 、 是良好半导体材料。
(3)利用等电子原理针对某物质找电子体;
例5:1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请从下列选项中选择合适的答案:中心原子与臭氧的中心氧原子的杂化轨道类型相同的有: 。与O3分子构型最相似的是 。
A.H2O B.CO2 C.SO2 D.BF3 E. NO2-
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一单元 分子构型与物质的性质
第一课时 分子的空间构型
高考资源网【学习目标】
1.理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2.学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3.掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
4.了解等电子原理及其应用。
【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法、等电子原理
【学习难点】杂化轨道理论、价层电子对互斥理论
【学习方法】讲解法、归纳法
【教学过程】
〖你知道吗〗
1.O原子与H原子结合形成的分子为什么是H2O,而不是H3O或H4O?
2.C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
3.为什么H2O分子是“V”型.键角是104.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
1. CH4 —— sp3杂化
轨道排布式:
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
(3)杂化轨道能量相同,成分相同,如:每个sp3杂化轨道占有 个s轨道、 个p轨道;
(4)杂化轨道总数等参与杂化的原子轨道数目之和,如 个s轨道和 个p轨道杂化成 个sp3杂化轨道
(5)正四面体结构的分子或离子的中心原子,一般采取sp3杂化轨道形式形成化学键,如CCl4、NH4+等,原子晶体金刚石、晶体硅、SiO2等中C和Si也采取sp3杂化形式,轨道间夹角为 。
2. BF3 —— sp2杂化型
用轨道排布式表示B原子采取sp2杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp2杂化轨道占有 个s轨道、 个p轨道;
(2)sp2杂化轨道呈 型,轨道间夹角为 ;
(3)中心原子通过sp2杂化轨道成键的分子有 、 等。
〖思考、讨论〗
根据现代价键理论即“电子配对理论”,Be原子外围电子排布式为2s2,电子已配对不能形成共价键,但气态BeCl2分子却能稳定存在,为什么?
3. 气态BeCl2—— sp杂化型
用轨道排布式表示Be原子采取sp杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp杂化轨道占有 个s轨道、 个p轨道;
(2)sp杂化轨道呈 型,轨道间夹角为 ;
(3)中心原子通过sp杂化轨道成键的分子有 、 等。
〖思考〗为何不能形成气态BeCl4分子?
【例题选讲】
例1. 根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
小结:请填写下表
表1 杂化轨道类型与杂化轨道空间构型
杂化类型 轨道成分 轨道空间构型 轨道间夹角 相关实例
sp
sp2
sp3
*dsp3或sp3d ------ 三角双锥 90°、120° PCl5
*d2sp3或sp3d2 ------ 八面体 90°、180° SF6
〖思考、讨论〗NH3、H2O分子中键角分另为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
二、价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
1. 价电子对:包括孤对电子对和成键电子对,一般孤对电子对离核较近。
2. 价电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间构型受到影响,一般,分子尽可能采取对称的空间结构以减小斥力。
相邻电子对间斥力大小顺序:
孤对电子对孤对电子对>孤对电子对成键电子对>成键电子对成键电子对
*叁键叁键>叁键双键>双键双键>双键单键>单键单键
三、不等性杂化
NH3、H2O的分子构型也可通过不等性杂化解释,即中心原子的孤对电子也参与杂化,得到性质不完全等同的杂化轨道,轨道的s成分和p成分不全相同,孤对电子对较密集于氮原子或氧原子周围。由于孤对电子对的杂化轨道排斥成键电子的杂化轨道,以致轨道夹角不等,氨分子和水分子成键电子对之间的夹角都小于109°28′。水分子中的氧原子有两个孤对电子对,它的O-H键之间的夹角比氨分子中N-H键之间夹角受到的排斥力作用更大。
例3. BF3是平面三角型的几何构型,但NF3却是三角锥型的几何构型,试用所学理论加以说明。
四、确定分子空间构型的简易方法
1. 对于ABm型分子
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl5 中
(2)O、S作为配位原子时按不提供价电子计算,作中心原子时价电子数为6;
(3)离子的价电子对数计算
如:NH4+ : ; SO42- :
例4. 计算下列分子或离子中的价电子对数,并根据已学填写下表
物质 价电子对数 中心原子杂化轨道类型 杂化轨道/电子对空间构型 轨道夹角 分子空间构型 键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
2. 对于ABm型分子的空间构型(分子空间构型指不包括孤对电子对的空间的排布)
(1)价层电子对数=配位原子数时,分子空间构型与杂化轨道空间构型相同
价电子对数 中心原子杂化轨道类型 杂化轨道/电子对空间构型 轨道夹角 实例 分子空间构型 键角
n=2 直线型 气态BeCl2、CO2
n=3 平面三角形 BF3、BCl3
n=4 四面体 CH4 、NH4+
n=5 dsp3或sp3d 三角双锥 90°、120° PCl5 三角双锥 90°、120°
n=6 d2sp3或sp3d2 八面体 90°、180° SF6 正八面体 90°、180°
(2)价层电子对数≠配位原子数时(一般存在孤对电子对),分子空间构型与杂化轨道空间构型不同,一般由于价层电子对之间的斥力不同导致。确定分子的稳定构型时应考虑三种电子对之间的排斥作用:一般孤对电子对间排斥作用数最少为最稳定构型,其次考虑孤对电子对-成键电子对排斥作用数,最后考虑成键电子对-成键电子对排斥作用数。
如:XeF4分子空间构型的确定:价层电子对为6,电子对构型为八面体,Xe的配位原子数为4,存在两对孤对电子对,分子空间构型可能存在以下两种:
(a) (b)
构型: (a) (b)
孤对电子对-孤对电子对排斥作用数: 0 1
孤对电子对-成键电子对排斥作用数: 8 6
成键电子对-成键电子对排斥作用数: 4 5
构型(a)比构型(b)的孤对电子对-孤对电子对排斥作用数少,因此,构型(a)是XeF4较稳定的空间构型。
说明:电子对空间构型与分子构型既有区别又有联系,分子构型可根据价层电子对互斥理论从电子对空间构型推导而得,此规律一般不适用于推测过渡金属化合物的几何构型,对极少数化合物判断也不准,如:CaF2、SrF2、BaF2,是弯曲型而不是预期的直线型。
表2 部分分子的空间构型与价层电子对空间构型
价电子对数 杂化轨道/电子对空间构型 轨道夹角 实例 成键电子对数 孤对电子对数 分子空间构型 键角
n=3 平面三角形 120° SO2、PbCl2 22 11 V型V型 119.5°----
n=4 正四面体 109°28′ H2O、NH3 23 21 V型、三角锥型 104.5°、107°18′
*n=5 三角双锥 90°、120° XeF2 2 3 直线型 180°
*n=6 正八面体 90°、180° XeF4XeOF4 45 21 正方形四方锥形 90°-----
例5: 用价层电子对互斥理论推测下列分子的空间构型
①CS2 ② NCl3 ③SO42-
④NO3- ⑤SO3 ⑥H3O+
五、等电子原理
1. 规律内容:具有相同 和相同 的分子或离子具有相同的结构特征,某些物理性质也相似。如:CO与N2,SiCl4、SiO44-与SO42-
2. 等电子原理的应用
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
如 、 、 、 是良好半导体材料。
(3)利用等电子原理针对某物质找电子体;
例5:1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请从下列选项中选择合适的答案:中心原子与臭氧的中心氧原子的杂化轨道类型相同的有: 。与O3分子构型最相似的是 。
A.H2O B.CO2 C.SO2 D.BF3 E. NO2-
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
