电 解 原 理
图片预览







文档简介
课件23张PPT。电 解 原 理原电复习:
什么是原电池?
电极的确定?
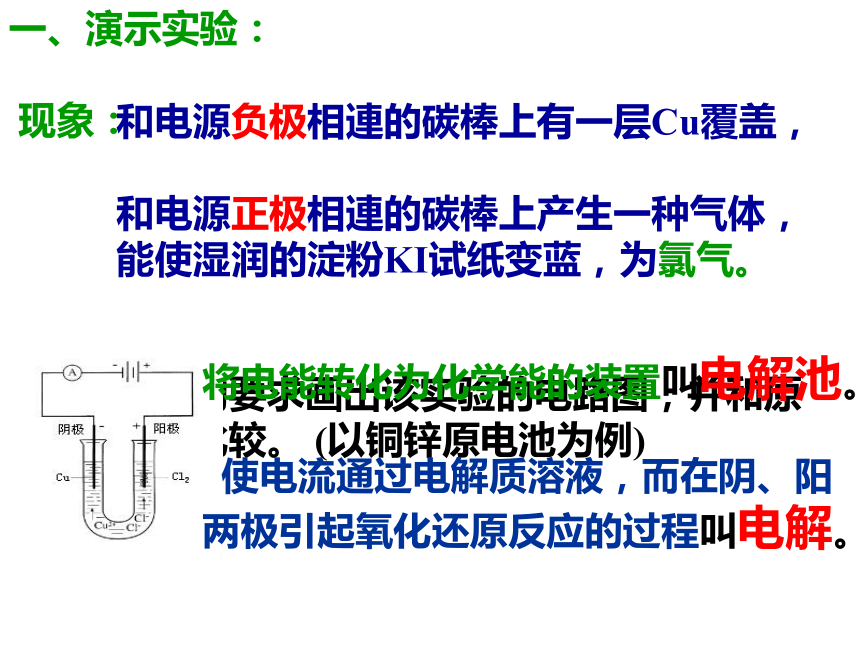
组成原电池的条件?按物理学的要求画出该实验的电路图,并和原电池进行比较。 (以铜锌原电池为例)一、演示实验:
现象:和电源负极相連的碳棒上有一层Cu覆盖,
和电源正极相連的碳棒上产生一种气体,能使湿润的淀粉KI试纸变蓝,为氯气。
将电能转化为化学能的装置叫电解池。
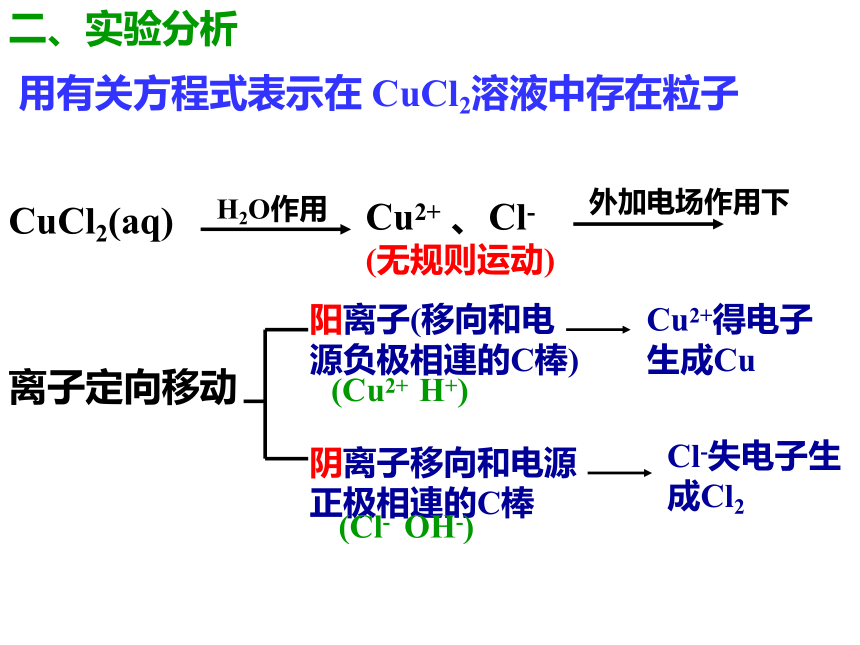
使电流通过电解质溶液,而在阴、阳两极引起氧化还原反应的过程叫电解。二、实验分析 用有关方程式表示在 CuCl2溶液中存在粒子CuCl2(aq)Cu2+ 、Cl-
(无规则运动)离子定向移动阳离子(移向和电源负极相連的C棒)阴离子移向和电源正极相連的C棒(Cu2+ H+)(Cl- OH-)Cu2+得电子生成CuCl-失电子生成Cl2【问1】电解池的两极是怎样确定的? 【问2】在电解过程中,电子是如何形成闭合回路的? 【问7】电解池与原电池有哪些异同呢? 【问4】电解氯化铜溶液时,溶液中Cu2+和Cl-放
电基本完毕后同,电解过程是否也就停止了呢? 【问5】在电解氯化铜溶液的装置中,若把电解质换
成氯化钠,其结果又如何呢?写出电极反应。二、实验分析【问3】写出两极发生的反应方程式和总方程式?为什么Cu2+、Cl-放电,而不是H+和OH-? 【问6】电解与电离有哪些异同呢? 阳极
发生氧化反应
与电源正极相连
阴极
发生还原反应
与电源负极相连
电解时所使用的电极分为两类:
一类为惰性电极,只起导体作用(如铂、石墨等),并不参加反应。
另一类为活性电极(除铂、金以及在电解时很容易钝化的铅、铬外的金属),若活性电极为阴极也只起导体的作用;若为阳极,则发生氧化反应的往往是电极本身。电子的流向:电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极动画电流的流向与电子的流向相反。总反应:阴极: Cu2+ + 2e— = Cu
阳极: 2Cl— - 2e— = Cl2
离子的放电顺序: 阴离子失去电子或阳离子得到电子的过程叫放电。放电的顺序取决于离子的本性,也与离子浓度和电极材料有关。
离子的放电顺序:(1)在惰性电极的阴极上,阳离子放电顺序:Au3+、Ag+、Hg2+、Cu2+、H+、Fe2+、Zn2+、Al3+、Mg2+放电由易到难(2)在惰性电极的阳极上,阴离子放电顺序:S2—、I—、Br—、Cl—、OH—、NO3—、SO42—、F—放电由易到难 溶液中Cu2+和Cl—放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH—,所以:
阳极:4OH— - 4e— =2H2O + O2
阴极:4H+ + 4e— = 2H2
总反应:2H2O = 2H2 + O2(1)溶液中所含阳离子:H+、Na+,
放电顺序:H+ > Na+
阴 极:2H+ + 2e— = H2(2)溶液中所含阴离子:OH—、Cl—,
放电顺序:Cl— > OH—
阳 极:2Cl— - 2e— = Cl2总反应: 2NaCl + 2H2O = 2NaOH + H2 + Cl2↑通电电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子例:CuCl2=Cu2++2Cl-阴阳离子定向移动,在两极上失得电子成为原子或分子。如:
CuCl2==Cu+Cl2只产生自由移动的离子
发生氧化还原反应生成了新物质 电解必须建立在电离的基础上 复习复习第二课时复习:【2】电解池与原电池有哪些异同呢? 【1】电解与电离有哪些异同呢? 【3】写出电解CuCl2溶液的电极反应和总反应。三、用惰性电极电解时产物的判断
及相关问题的分析例1、 用石墨棒电解NaOH溶液OH-H+得电子生成H2NaOH= Na+ + OH-H2O? H+ + OH-Na+ H+ 阴极阳极OH-失电子生成O2阳极: 4OH— - 4e— =2H2O + O2
阴极: 4H+ + 4e— = 2H24H2O + 4e- = 2H2 + 4OH-问:电解一段时间后,溶液的PH如何变化?如何使 溶液复原?练习:
分析电解Na2SO4 溶液的本质,书写电解反应方程式, 阳极区和阴极区的PH是如何变化?
怎个溶液的PH如何变化?如何复原?阳极: 4OH— - 4e— =2H2O + O2
阴极: 4H+ + 4e— = 2H2
总反应: 2H2O = 2H2 + O2(4H2O + 4e- = 2H2 + 4OH- )(4H2O - 4e- = O2 + 4H+ + 2H2O)PH↓PH↑加水可复原判断 下列物质中哪些物质的电解,实质是电解水?
NaCl HCl H2SO4 CuSO4 KOH NaNO3总结:
活泼的金属含氧酸盐 、含氧酸、 强碱溶液的电解实质是电解水。练习: 书写电解下列溶液的电极反应和总反应。HCl CuSO4 NaCl2.关于 两电解池串联CuCl2H2SO4标出各电极
判断各电极的产物
当产生64g铜时,有多少克? 第三课时四、活性电极电解时电极反应的书写活性电极:除铂、金、石墨以外的电极。
若活性电极为阴极也只起导体的作用
若为阳极,则发生氧化反应的往往是电极本 身。例: 阳极:
阴极:
Cu -2e- = Cu2+ 练:AgNO34H2O+4e-= H2O + O2↑+ H+阳极:
阴极:
Ag - e- = Ag+Ag+ + e- = Ag五、电解的应用1. 精炼铜 一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。粗铜 含杂质(Zn Fe Ni Ag Au 等)请设计一装置图, 标明电极材料,电解质溶液纯铜粗铜阳极: Zn-2e- = Zn2+
Fe –2e- = Fe2+
Ni-2e- = Ni2+
Cu-2e- = Cu2+
Zn Fe Ni
CuAg Au
阴极: Cu2+ + 2e- = Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?略?CuSO4溶液五、电解的应用2. 电镀电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程,它是电解原理的又一重要应用。电镀可以使金属更加美观耐用,增强防锈抗腐能力。例如,钢铁是人们最常用的金属,但钢铁有个致命的缺点,就是它们易被腐蚀。防止钢铁发生腐蚀的一种最常用方法就是在其表面镀上其他金属,如锌、铜、铬、镍等。
电镀:电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程,以Fe 制品镀Zn为例:Fe ---被镀件
Zn---镀层金属阴 极阳 极电镀液: ZnSO4 溶液Zn – 2e- = Zn2+ Zn2+ + 2e- = Zn(镀层金属阳离子的溶液)实验电镀前后ZnSO4 溶液的浓度是否变化?设计一铜件上镀银的电镀池>
什么是原电池?
电极的确定?
组成原电池的条件?按物理学的要求画出该实验的电路图,并和原电池进行比较。 (以铜锌原电池为例)一、演示实验:
现象:和电源负极相連的碳棒上有一层Cu覆盖,
和电源正极相連的碳棒上产生一种气体,能使湿润的淀粉KI试纸变蓝,为氯气。
将电能转化为化学能的装置叫电解池。
使电流通过电解质溶液,而在阴、阳两极引起氧化还原反应的过程叫电解。二、实验分析 用有关方程式表示在 CuCl2溶液中存在粒子CuCl2(aq)Cu2+ 、Cl-
(无规则运动)离子定向移动阳离子(移向和电源负极相連的C棒)阴离子移向和电源正极相連的C棒(Cu2+ H+)(Cl- OH-)Cu2+得电子生成CuCl-失电子生成Cl2【问1】电解池的两极是怎样确定的? 【问2】在电解过程中,电子是如何形成闭合回路的? 【问7】电解池与原电池有哪些异同呢? 【问4】电解氯化铜溶液时,溶液中Cu2+和Cl-放
电基本完毕后同,电解过程是否也就停止了呢? 【问5】在电解氯化铜溶液的装置中,若把电解质换
成氯化钠,其结果又如何呢?写出电极反应。二、实验分析【问3】写出两极发生的反应方程式和总方程式?为什么Cu2+、Cl-放电,而不是H+和OH-? 【问6】电解与电离有哪些异同呢? 阳极
发生氧化反应
与电源正极相连
阴极
发生还原反应
与电源负极相连
电解时所使用的电极分为两类:
一类为惰性电极,只起导体作用(如铂、石墨等),并不参加反应。
另一类为活性电极(除铂、金以及在电解时很容易钝化的铅、铬外的金属),若活性电极为阴极也只起导体的作用;若为阳极,则发生氧化反应的往往是电极本身。电子的流向:电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极动画电流的流向与电子的流向相反。总反应:阴极: Cu2+ + 2e— = Cu
阳极: 2Cl— - 2e— = Cl2
离子的放电顺序: 阴离子失去电子或阳离子得到电子的过程叫放电。放电的顺序取决于离子的本性,也与离子浓度和电极材料有关。
离子的放电顺序:(1)在惰性电极的阴极上,阳离子放电顺序:Au3+、Ag+、Hg2+、Cu2+、H+、Fe2+、Zn2+、Al3+、Mg2+放电由易到难(2)在惰性电极的阳极上,阴离子放电顺序:S2—、I—、Br—、Cl—、OH—、NO3—、SO42—、F—放电由易到难 溶液中Cu2+和Cl—放电完毕后,原溶液变为纯水,此时,在纯水中存在H+和OH—,所以:
阳极:4OH— - 4e— =2H2O + O2
阴极:4H+ + 4e— = 2H2
总反应:2H2O = 2H2 + O2(1)溶液中所含阳离子:H+、Na+,
放电顺序:H+ > Na+
阴 极:2H+ + 2e— = H2(2)溶液中所含阴离子:OH—、Cl—,
放电顺序:Cl— > OH—
阳 极:2Cl— - 2e— = Cl2总反应: 2NaCl + 2H2O = 2NaOH + H2 + Cl2↑通电电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子例:CuCl2=Cu2++2Cl-阴阳离子定向移动,在两极上失得电子成为原子或分子。如:
CuCl2==Cu+Cl2只产生自由移动的离子
发生氧化还原反应生成了新物质 电解必须建立在电离的基础上 复习复习第二课时复习:【2】电解池与原电池有哪些异同呢? 【1】电解与电离有哪些异同呢? 【3】写出电解CuCl2溶液的电极反应和总反应。三、用惰性电极电解时产物的判断
及相关问题的分析例1、 用石墨棒电解NaOH溶液OH-H+得电子生成H2NaOH= Na+ + OH-H2O? H+ + OH-Na+ H+ 阴极阳极OH-失电子生成O2阳极: 4OH— - 4e— =2H2O + O2
阴极: 4H+ + 4e— = 2H24H2O + 4e- = 2H2 + 4OH-问:电解一段时间后,溶液的PH如何变化?如何使 溶液复原?练习:
分析电解Na2SO4 溶液的本质,书写电解反应方程式, 阳极区和阴极区的PH是如何变化?
怎个溶液的PH如何变化?如何复原?阳极: 4OH— - 4e— =2H2O + O2
阴极: 4H+ + 4e— = 2H2
总反应: 2H2O = 2H2 + O2(4H2O + 4e- = 2H2 + 4OH- )(4H2O - 4e- = O2 + 4H+ + 2H2O)PH↓PH↑加水可复原判断 下列物质中哪些物质的电解,实质是电解水?
NaCl HCl H2SO4 CuSO4 KOH NaNO3总结:
活泼的金属含氧酸盐 、含氧酸、 强碱溶液的电解实质是电解水。练习: 书写电解下列溶液的电极反应和总反应。HCl CuSO4 NaCl2.关于 两电解池串联CuCl2H2SO4标出各电极
判断各电极的产物
当产生64g铜时,有多少克? 第三课时四、活性电极电解时电极反应的书写活性电极:除铂、金、石墨以外的电极。
若活性电极为阴极也只起导体的作用
若为阳极,则发生氧化反应的往往是电极本 身。例: 阳极:
阴极:
Cu -2e- = Cu2+ 练:AgNO34H2O+4e-= H2O + O2↑+ H+阳极:
阴极:
Ag - e- = Ag+Ag+ + e- = Ag五、电解的应用1. 精炼铜 一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。粗铜 含杂质(Zn Fe Ni Ag Au 等)请设计一装置图, 标明电极材料,电解质溶液纯铜粗铜阳极: Zn-2e- = Zn2+
Fe –2e- = Fe2+
Ni-2e- = Ni2+
Cu-2e- = Cu2+
Zn Fe Ni
CuAg Au
阴极: Cu2+ + 2e- = Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?略?CuSO4溶液五、电解的应用2. 电镀电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程,它是电解原理的又一重要应用。电镀可以使金属更加美观耐用,增强防锈抗腐能力。例如,钢铁是人们最常用的金属,但钢铁有个致命的缺点,就是它们易被腐蚀。防止钢铁发生腐蚀的一种最常用方法就是在其表面镀上其他金属,如锌、铜、铬、镍等。
电镀:电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程,以Fe 制品镀Zn为例:Fe ---被镀件
Zn---镀层金属阴 极阳 极电镀液: ZnSO4 溶液Zn – 2e- = Zn2+ Zn2+ + 2e- = Zn(镀层金属阳离子的溶液)实验电镀前后ZnSO4 溶液的浓度是否变化?设计一铜件上镀银的电镀池>
