化学实验基本方法
图片预览







文档简介
课件33张PPT。高一年级 化学1第一章 从实验到化学
第一节 化学实验基本方法 我们使用的高中化学教材一、教科书的体系和内容结构 各模块都根据构成内容的基本线索,选择、安排具体内容,构建教材体系。1.重视化学学科的基本知识和技能
2.反映化学与科学和技术及社会、生活实际的密切联系、作用和影响的教育内容和素材
3.体现化学学科的思想、观念及研究方法的内容和素材 基本线索必修化学1、化学2高中化学学习的原则、方法和要求化学学习原则:
化学学习方法
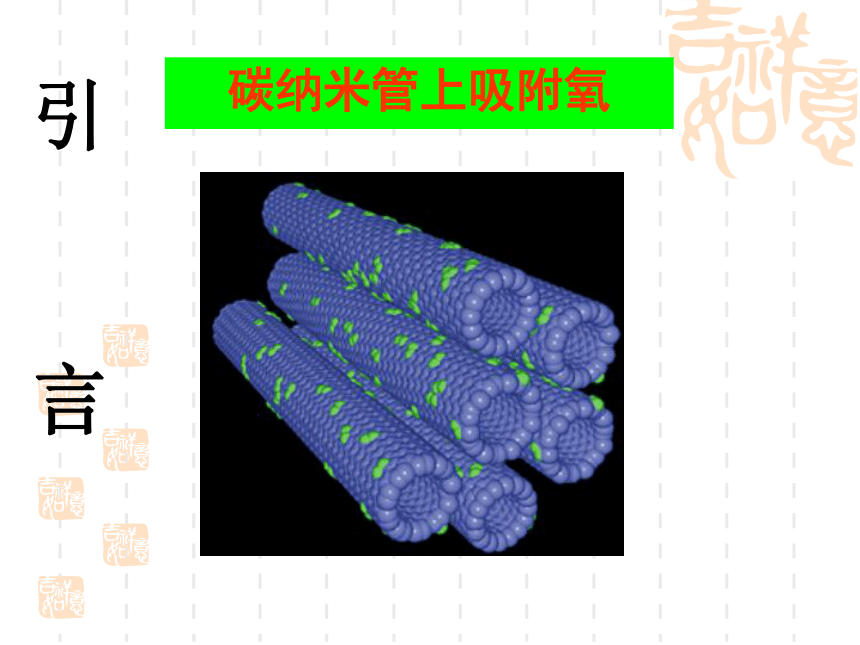
化学学习要求碳纳米管上吸附氧引
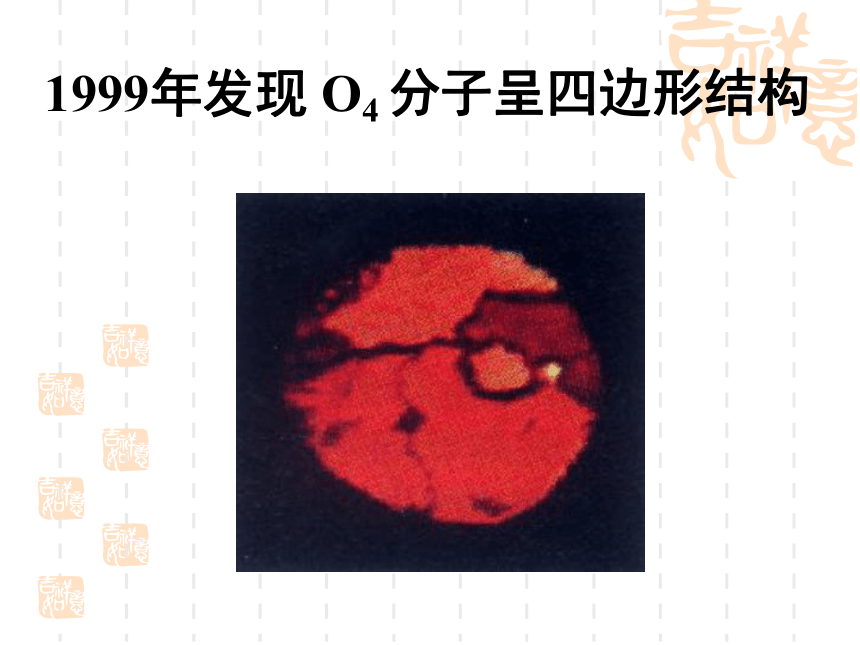
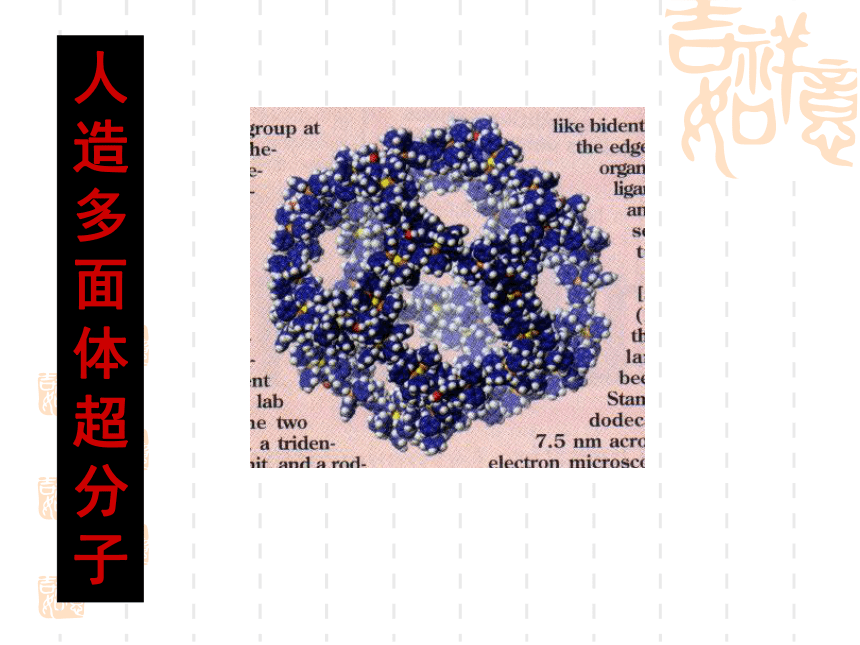
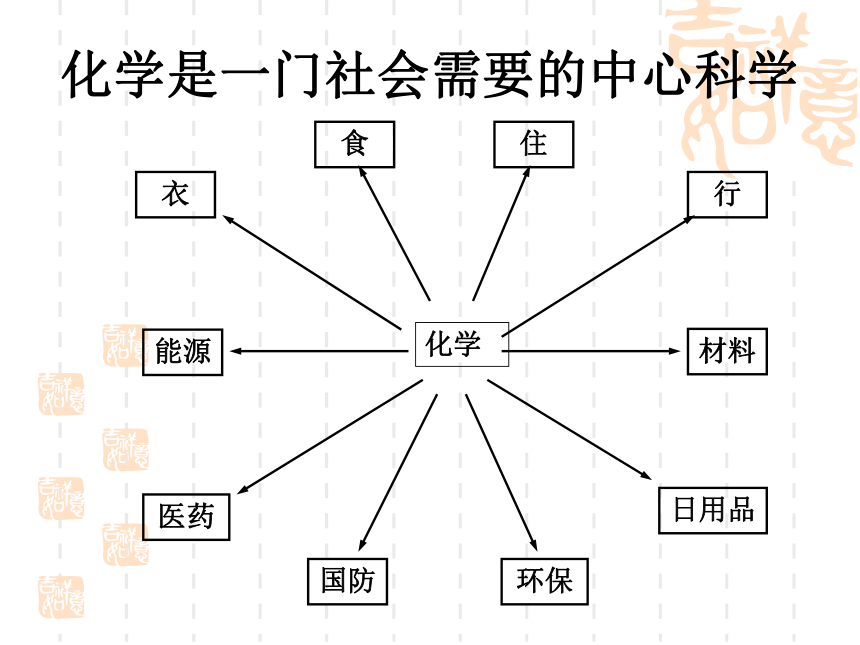
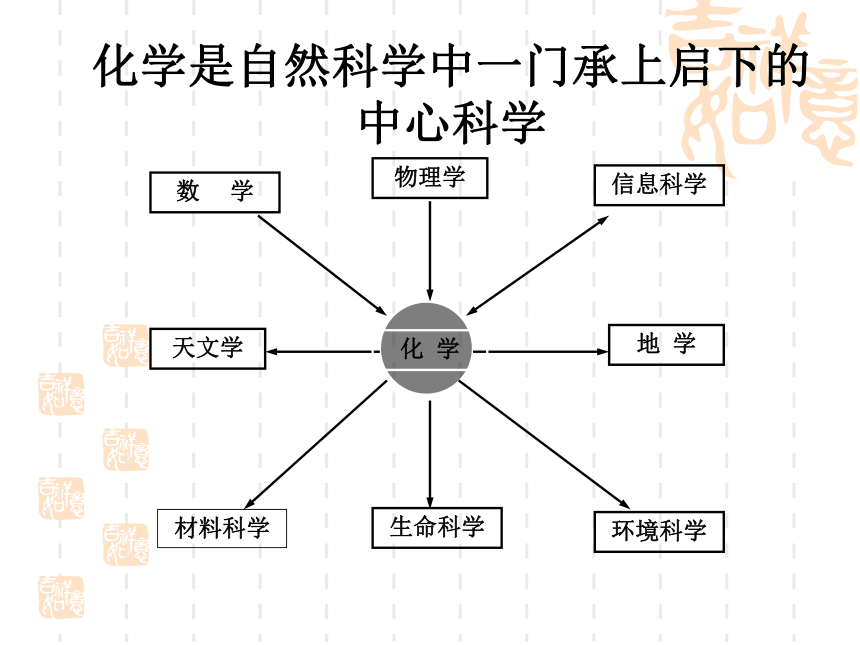
言1999年发现 O4 分子呈四边形结构人造多面体超分子化学是一门社会需要的中心科学化学衣食住行能源材料医药国防环保日用品化学发展的标志时间分辨 飞秒级 10-15s空间分辨 原子级 10-10m检测限 分子级 10-23mol合成的化合物[10-22s-- 1018s (100亿年)][10-18m-- 1026m(100亿光年)]4683万种化学是自然科学中一门承上启下的 中心科学物理学信息科学数 学天文学地 学生命科学材料科学环境科学化 学化合物总数知多少?1991年高考试题——第1000万种化合物
1996~1999每年登录新化合物超过100万
1999年底登录的化合物总数为 2340万种
2001.3 3013万种
2003.3 4683万种
2007.9 ?种
一、化学实验安全 1、实验室规则 2、安全措施 3、掌握正确的操作方法中学化学实验室规则一、实验课前要认真预习,理解实验的目的、步骤、操作及注意事项。?
二、准时进实验室,进实验室后要安静、守纪,不大声喧哗。三、爱护公物,严禁乱动水电开关,不经老师允许不得擅自做自己想做的实验。
四、实验前检查仪器,如有破损,及时报告和调换。实验后破损,及时报告和登记,酌情赔偿。?
五、注意安全,严格按照操作要求进行实验,实验后的废液应倒在指定的容器内,妥善处理易燃、易爆、易腐蚀及有毒物质。?
六、实验完毕,洗净仪器,清洁水槽,擦好桌子,并将仪器药品按要求放整齐,然后切断水、电,关好门窗。经老师检查,才可离开实验室。?
七、要严格执行以上各条规则,严重违反本实验室规定者,视情节轻重,报请学校领导给予纪律处分。 回顾与思考:二、混合物的分离和提纯在我们的日常生活和所接触的实验中,物质混合的常见形式有哪些?一般可采取哪些措施进行分离和提纯? 利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,除去杂质达到提纯的目的分离和提纯:1、过滤和蒸发 ①过滤:利用物质的可溶性不同分离
难溶物与可溶物 ②蒸发:利用溶液沸点不同加热使溶
剂挥发,分离溶质与溶剂 2、蒸馏与萃取 ①蒸馏:利用液体沸点不同,提纯液态纯净物 ②萃取:利用溶质在不同溶剂中的溶解度不同分离溶液如:粗盐的提纯:溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解有少量不
溶物 1、固体溶解: 先将固体研细,溶解 时要搅拌,搅拌时玻 璃 棒不能碰击容器壁, 以防容器破损 2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网 问题:
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐除杂: 例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:有白色难溶物生成化学方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去除杂原则:不增不减易分不加入新的物质不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO42、蒸馏和萃取(1)蒸馏利用液体混合物沸点不同分析蒸馏过程:原理根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物 △冷凝问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶
内物质?控温显示加热范围
如:自来水蒸馏时
温度≈100℃冷凝收集在100℃难于挥发,
不挥发的杂质蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸④冷凝管中通冷却水时,下口( ),
上口( )进水出水萃取 液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.概念分析混合物溶质溶剂(一种)(两种)溶解性不同两者互不相溶萃取液萃取分液漏斗分液使用分液漏斗注意事项:1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,再静置
3、分液时,上层液体由上口倒出,下层液体由下端流出且分液漏斗下端紧贴烧杯内壁。实验1-4 用CCl4萃取碘水(饱和)现象液体分层
上层液体显( )色
下层液体显( )色黄紫红 分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?H2OCCl4四氯化碳(CCl4)都能溶解碘单质( I2);都不与
碘单质( I2)反应。异:CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。同:萃取剂选择条件1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应 思考与讨论
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?请说明原因①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)不可以,酒精与水互溶
第一节 化学实验基本方法 我们使用的高中化学教材一、教科书的体系和内容结构 各模块都根据构成内容的基本线索,选择、安排具体内容,构建教材体系。1.重视化学学科的基本知识和技能
2.反映化学与科学和技术及社会、生活实际的密切联系、作用和影响的教育内容和素材
3.体现化学学科的思想、观念及研究方法的内容和素材 基本线索必修化学1、化学2高中化学学习的原则、方法和要求化学学习原则:
化学学习方法
化学学习要求碳纳米管上吸附氧引
言1999年发现 O4 分子呈四边形结构人造多面体超分子化学是一门社会需要的中心科学化学衣食住行能源材料医药国防环保日用品化学发展的标志时间分辨 飞秒级 10-15s空间分辨 原子级 10-10m检测限 分子级 10-23mol合成的化合物[10-22s-- 1018s (100亿年)][10-18m-- 1026m(100亿光年)]4683万种化学是自然科学中一门承上启下的 中心科学物理学信息科学数 学天文学地 学生命科学材料科学环境科学化 学化合物总数知多少?1991年高考试题——第1000万种化合物
1996~1999每年登录新化合物超过100万
1999年底登录的化合物总数为 2340万种
2001.3 3013万种
2003.3 4683万种
2007.9 ?种
一、化学实验安全 1、实验室规则 2、安全措施 3、掌握正确的操作方法中学化学实验室规则一、实验课前要认真预习,理解实验的目的、步骤、操作及注意事项。?
二、准时进实验室,进实验室后要安静、守纪,不大声喧哗。三、爱护公物,严禁乱动水电开关,不经老师允许不得擅自做自己想做的实验。
四、实验前检查仪器,如有破损,及时报告和调换。实验后破损,及时报告和登记,酌情赔偿。?
五、注意安全,严格按照操作要求进行实验,实验后的废液应倒在指定的容器内,妥善处理易燃、易爆、易腐蚀及有毒物质。?
六、实验完毕,洗净仪器,清洁水槽,擦好桌子,并将仪器药品按要求放整齐,然后切断水、电,关好门窗。经老师检查,才可离开实验室。?
七、要严格执行以上各条规则,严重违反本实验室规定者,视情节轻重,报请学校领导给予纪律处分。 回顾与思考:二、混合物的分离和提纯在我们的日常生活和所接触的实验中,物质混合的常见形式有哪些?一般可采取哪些措施进行分离和提纯? 利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,除去杂质达到提纯的目的分离和提纯:1、过滤和蒸发 ①过滤:利用物质的可溶性不同分离
难溶物与可溶物 ②蒸发:利用溶液沸点不同加热使溶
剂挥发,分离溶质与溶剂 2、蒸馏与萃取 ①蒸馏:利用液体沸点不同,提纯液态纯净物 ②萃取:利用溶质在不同溶剂中的溶解度不同分离溶液如:粗盐的提纯:溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解有少量不
溶物 1、固体溶解: 先将固体研细,溶解 时要搅拌,搅拌时玻 璃 棒不能碰击容器壁, 以防容器破损 2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网 问题:
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐除杂: 例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:有白色难溶物生成化学方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去除杂原则:不增不减易分不加入新的物质不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO42、蒸馏和萃取(1)蒸馏利用液体混合物沸点不同分析蒸馏过程:原理根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物 △冷凝问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶
内物质?控温显示加热范围
如:自来水蒸馏时
温度≈100℃冷凝收集在100℃难于挥发,
不挥发的杂质蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸④冷凝管中通冷却水时,下口( ),
上口( )进水出水萃取 液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.概念分析混合物溶质溶剂(一种)(两种)溶解性不同两者互不相溶萃取液萃取分液漏斗分液使用分液漏斗注意事项:1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,再静置
3、分液时,上层液体由上口倒出,下层液体由下端流出且分液漏斗下端紧贴烧杯内壁。实验1-4 用CCl4萃取碘水(饱和)现象液体分层
上层液体显( )色
下层液体显( )色黄紫红 分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?H2OCCl4四氯化碳(CCl4)都能溶解碘单质( I2);都不与
碘单质( I2)反应。异:CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。同:萃取剂选择条件1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应 思考与讨论
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?请说明原因①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)不可以,酒精与水互溶
