化学实验基本方法
图片预览






文档简介
课件28张PPT。§1.1化学实验基本方法第一章 从实验学化学一、化学实验安全
1、实验室规则
2、安全措施
3、掌握正确的操作方法二、混合物的分离和提纯思考与交流
1、利用什么方法和性质将金子与沙子分离
2、如何分离铁屑和沙子
二、混合物的分离与提纯
1、过滤和提纯
①过滤:利用物质的可溶性不同
分离难溶物与可溶物
②蒸发:利用溶液沸点不同
加热使溶剂挥发,分离溶质与溶剂
2、蒸馏与萃取
①蒸馏:利用液体沸点不同,提纯液态纯净物
②萃取:利用溶质在不同溶剂中的溶解度不同
分离溶液 第一节 化学实验基本方法
一、化学实验安全
二、混合物的分离与提纯
三、物质的检验
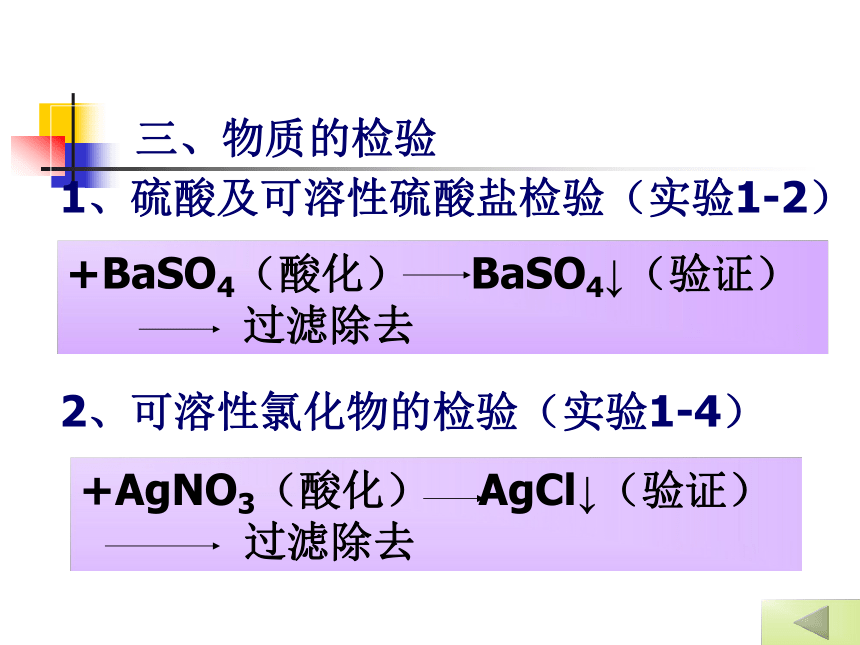
三、物质的检验
1、硫酸及可溶性硫酸盐检验(实验1-2)
2、可溶性氯化物的检验(实验1-4)+BaSO4(酸化) BaSO4↓(验证)
过滤除去+AgNO3(酸化) AgCl↓(验证)
过滤除去学与问分离和提纯:利用混合物中组分的性质(物理性质,如:溶解性
不同等;化学性质,与物质反应的现象不同等)不同,
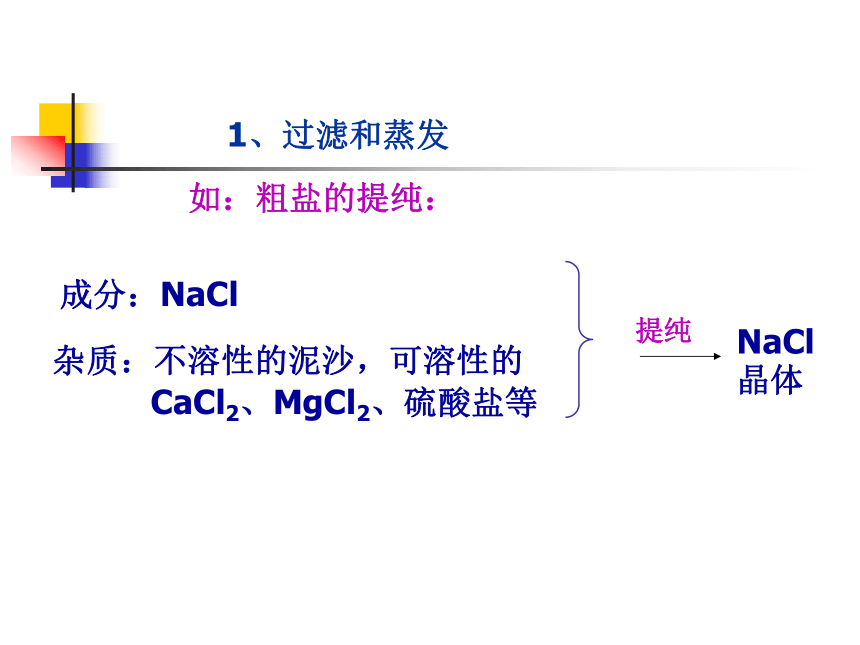
除去杂质达到提纯的目的1、过滤和蒸发如:粗盐的提纯:杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等成分:NaCl提纯NaCl
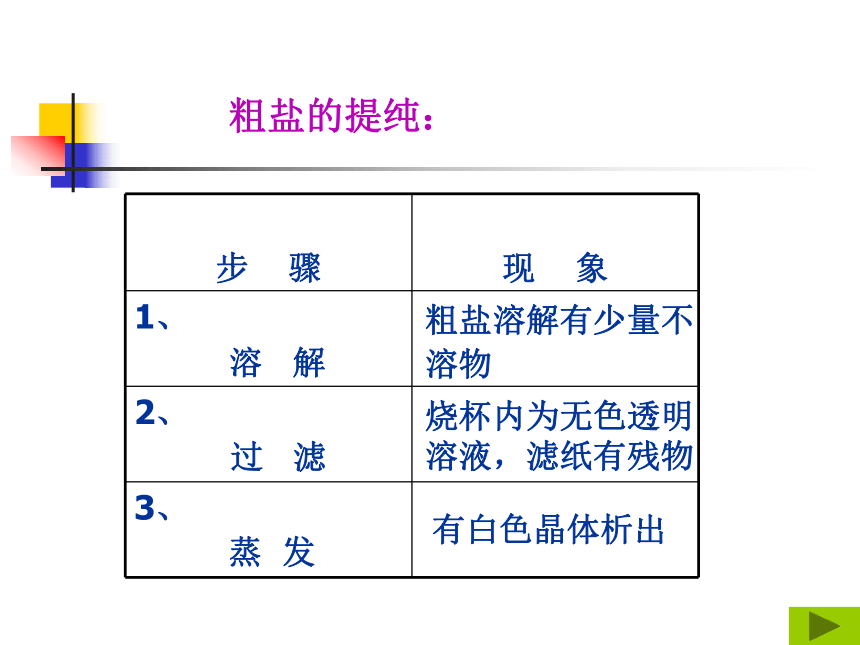
晶体溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解有少量不
溶物粗盐的提纯: 1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网 问题
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐除杂 例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:有白色难溶物生成化学方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去除杂原则不增不减易分不加入新的物质不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4除杂思路:根据杂质特征选择除杂剂,通常选择易与
杂质反应生成气体、沉淀的物质为除杂剂,
符合( )反应类型复分解 2、蒸馏和萃取(1)蒸馏利用液体混合物沸点不同实验1-3有白色难溶物无现象分析蒸馏过程原理根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物 △冷凝问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶内物质?控温显示加热范围
如:自来水蒸馏时温度≈100℃冷凝收集在100℃难于挥发,不挥发的杂质蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸④冷凝管中通冷却水时,下口( ),
上口( )进水出水 练习
两种液体混合物A和B,已知A、B互溶。且相互
不发生化学反应。在常温下,A的沸点为35℃,
不的沸点为200℃。请回答下列问题
(1)用蒸馏方法分离物质和提纯混合物必不可
少的仪器和用品
(2)当随着温度的升高,哪一种物质先分馏出来蒸馏瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、接受器(牛角器)等A物质萃取 液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.概念分析混合物溶质溶剂(一种)(两种)溶解性不同两者互不相溶萃取液萃取分液漏斗分液使用分液漏斗注意事项1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。实验1-4 用CCl4萃取碘水(饱和)现象液体分层
上层液体显( )色
下层液体显( )色黄紫红 分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?H2OCCl4四氯化碳(CCl4)都能溶解碘单质( I2);都不与
碘单质( I2)反应。异:CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。同:萃取剂选择条件1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应 思考与讨论
1、根据实验1-4分析,请分总结CCl4
性质?
2、将实验1-4中的萃取剂换为酒精是否
可以?请说明原因①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)不可以,酒精与水互溶
1、实验室规则
2、安全措施
3、掌握正确的操作方法二、混合物的分离和提纯思考与交流
1、利用什么方法和性质将金子与沙子分离
2、如何分离铁屑和沙子
二、混合物的分离与提纯
1、过滤和提纯
①过滤:利用物质的可溶性不同
分离难溶物与可溶物
②蒸发:利用溶液沸点不同
加热使溶剂挥发,分离溶质与溶剂
2、蒸馏与萃取
①蒸馏:利用液体沸点不同,提纯液态纯净物
②萃取:利用溶质在不同溶剂中的溶解度不同
分离溶液 第一节 化学实验基本方法
一、化学实验安全
二、混合物的分离与提纯
三、物质的检验
三、物质的检验
1、硫酸及可溶性硫酸盐检验(实验1-2)
2、可溶性氯化物的检验(实验1-4)+BaSO4(酸化) BaSO4↓(验证)
过滤除去+AgNO3(酸化) AgCl↓(验证)
过滤除去学与问分离和提纯:利用混合物中组分的性质(物理性质,如:溶解性
不同等;化学性质,与物质反应的现象不同等)不同,
除去杂质达到提纯的目的1、过滤和蒸发如:粗盐的提纯:杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等成分:NaCl提纯NaCl
晶体溶 解 过 滤蒸 发烧杯内为无色透明
溶液,滤纸有残物有白色晶体析出粗盐溶解有少量不
溶物粗盐的提纯: 1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次 3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网 问题
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?过滤NaCl、CaCl2、MgCl2、可溶性硫酸盐沸点不同NaCl、CaCl2、MgCl2、硫酸盐除杂 例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:有白色难溶物生成化学方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去除杂原则不增不减易分不加入新的物质不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4除杂思路:根据杂质特征选择除杂剂,通常选择易与
杂质反应生成气体、沉淀的物质为除杂剂,
符合( )反应类型复分解 2、蒸馏和萃取(1)蒸馏利用液体混合物沸点不同实验1-3有白色难溶物无现象分析蒸馏过程原理根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物 △冷凝问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶内物质?控温显示加热范围
如:自来水蒸馏时温度≈100℃冷凝收集在100℃难于挥发,不挥发的杂质蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸④冷凝管中通冷却水时,下口( ),
上口( )进水出水 练习
两种液体混合物A和B,已知A、B互溶。且相互
不发生化学反应。在常温下,A的沸点为35℃,
不的沸点为200℃。请回答下列问题
(1)用蒸馏方法分离物质和提纯混合物必不可
少的仪器和用品
(2)当随着温度的升高,哪一种物质先分馏出来蒸馏瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、接受器(牛角器)等A物质萃取 液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.概念分析混合物溶质溶剂(一种)(两种)溶解性不同两者互不相溶萃取液萃取分液漏斗分液使用分液漏斗注意事项1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。实验1-4 用CCl4萃取碘水(饱和)现象液体分层
上层液体显( )色
下层液体显( )色黄紫红 分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?H2OCCl4四氯化碳(CCl4)都能溶解碘单质( I2);都不与
碘单质( I2)反应。异:CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。同:萃取剂选择条件1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应 思考与讨论
1、根据实验1-4分析,请分总结CCl4
性质?
2、将实验1-4中的萃取剂换为酒精是否
可以?请说明原因①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)不可以,酒精与水互溶
