化学实验基本方法
图片预览










文档简介
课件32张PPT。第一章
从实验学化学第一节 化学实验基本方法固体、液体的取用、物质的加热、以及基本仪器的使用。 固体、液体的取用:1、不能用手、鼻、口;
2、一般用量:液体1~2ml,固体盖满试管底部;
3、剩余药品处理:既不放回原瓶,也不随意丢弃,更不能拿出实验室,要放入指定的容器内。2、给试管里的药品加热,不需要垫石棉网,必须先进行预热,以免试管炸裂;物质的加热:1、绝对禁止用酒精灯引燃另一盏酒精灯;绝对禁止向燃着的酒精灯里添加酒精;用完酒精灯,必须用灯帽盖灭,不可用嘴吹灭;3、烧得很热的玻璃试管,不要立即用冷水冲洗,否则可能炸裂。
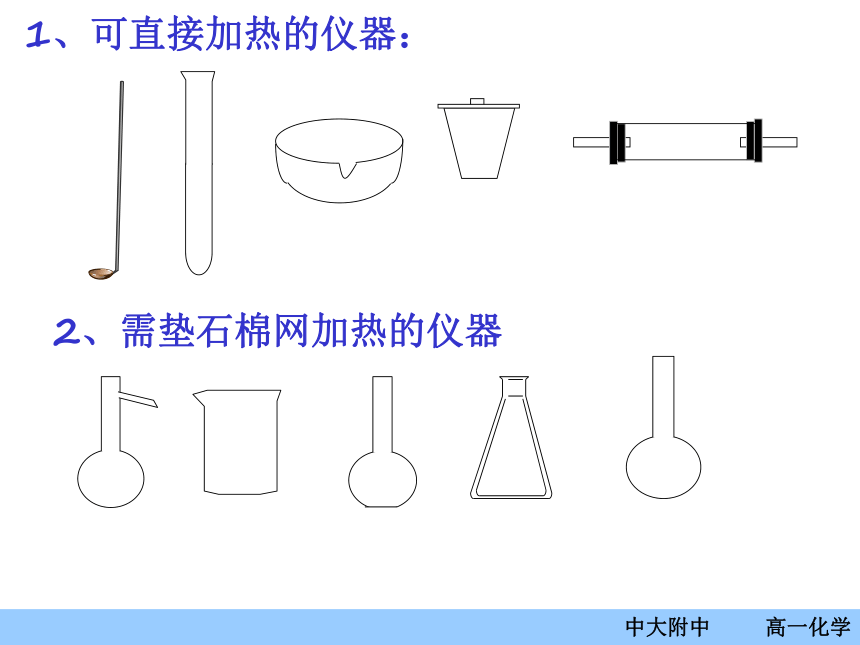
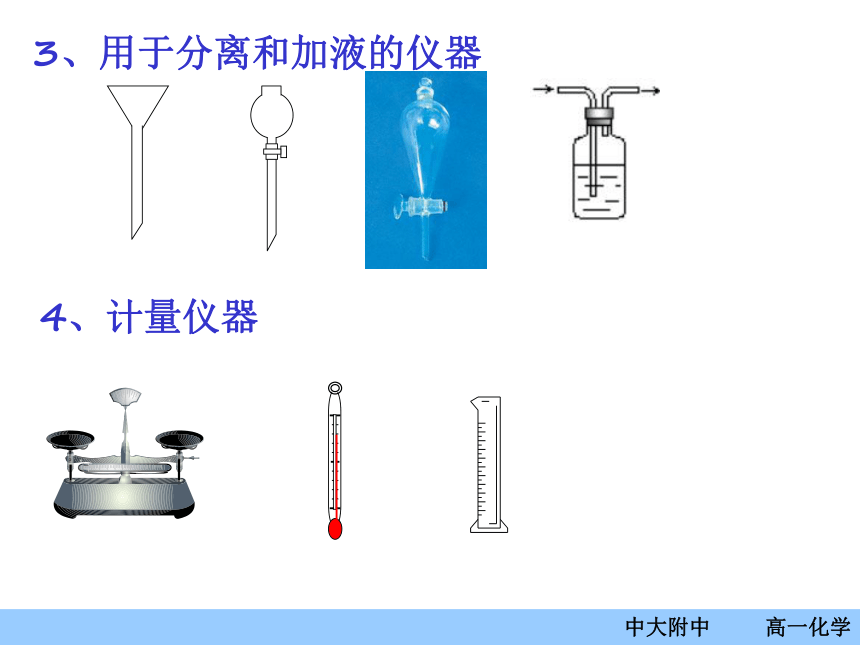
1、可直接加热的仪器:2、需垫石棉网加热的仪器3、用于分离和加液的仪器4、计量仪器仪器的使用——托盘天平(1)调零防腐先调节天平,潮湿或腐蚀的药品必须放在玻璃
器皿中称量,其他药品用大小一样质地相同的纸(2)左物右码左盘放称量物,右盘放砝码(3)先大后小取用砝码先取质量大的,再取小的(4)归零放盒称量完毕,应把游码移回零处,砝码放回砝码盒一、化学实验安全1、一些常用危险化学品的标志 2、实验安全注意的问题: (1)遵守实验室规则
(2)了解安全措施
(3)掌握正确的操作方法①不用口接触实验室的仪器和药品。
②加热液体的试管不准对着人,加热过程中的实验仪器不能直接放在实验台上,应放在石棉网上。怎样稀释浓硫酸?③稀释浓硫酸时一定要将浓硫酸缓慢注入水中并不断搅拌以散发热量。④若用加热的方法制取气体、用排水法收集气时,应先撤导管,再熄灯。(以免倒吸)氧气是如何制取的?收集的方法?实验结束时,是先撤导管还是先熄酒精灯?⑤做有毒气体实验时,应在通风橱中进行,并对尾气处理(吸收 或点燃)。进行易燃易爆气体的实验应注意验纯,尾气应点燃或适当处理.3.化学实验过程中意外事故的处理①浓酸洒在实验台上,先用Na2CO3(或NaHCO3)中和,后用水冲洗;浓酸溅到皮肤上,先用干抹布拭去,再用水冲洗。严重的须就医。浓硫酸洒在实验台,或溅到皮肤上,如何处理?②浓碱洒在实验台上,先用稀醋酸中和,然后用水冲洗干净。浓碱沾在皮肤上,宜先用水冲洗,再涂硼酸溶液。严重时要就医。③酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医。
④金属钠、非金属磷等失火要用沙土扑盖。
广口瓶——一般存放固体试剂;
细口瓶——一般存放液态试剂;
棕色试剂瓶——一般存放一些见光易分解的物质;
橡皮塞做瓶塞的试剂瓶——一般存放碱性物质。试剂瓶对所存放药品的要求:AgNO3 HNO3 HClO等 二、混合物的分离和提纯自然界中的物质的存在形式
纯净物(很少数)
混合物(绝大多数)
化学研究的物质的性质是研究纯净物的性质.
分离:是通过适当的方法,把混合物中的几种物质分开,每一组分都要保留下来,并恢复到原状态,得到比较纯的物质。提纯:指保留混合物中的某一主要组分,把其余杂质通过一定方法都除去。水洗:用水冲洗
利用物质的密度不同
碎石、沙子 :密度=2.5~3.5g/cm3
金:密度=19.3g/cm3思考与交流:P5(铁的密度:7.7g/cm3)
1、用手拣
2、用水淘
3、用磁铁
4、用盐酸学与问P5在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗? 我们在初中科学里也学过一些简单的实验方法,可用于混合物的分离和提纯,请同学们回忆一下,你了解哪些分离、提纯的方法?过滤、蒸发等【问题】粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]粗盐提纯:操作过程:
溶解——过滤——蒸发▲溶解操作:▲过滤操作:所用仪器: 通常用来分离液体和不溶的固体。▲蒸发操作:所用仪器:操作时注意:原理:利用加热的方法,使溶剂不断挥发而析出溶质的过程溶解开始时,液体混浊,静置一段时间后,上层较清,下层较混浊,有沉淀物滤纸折好,放好
安装仪器,慢慢过滤过滤后,滤液较澄清,滤纸上有沉淀物
把所得滤液倒入蒸发皿,用酒精灯加热,同时用玻棒不断搅拌,待蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
得到较白净的固体
(但质量比粗盐时少了些)
思考:P6
你认为通过上述操作得到的是比较纯的氯化钠吗?
可能还有什么杂质没有除去?
如何证明得到的盐中还含有硫酸根?还有 CaCl2、MgCl2、 硫酸盐SO42-离子的检验可溶性物质在水溶液中以离子形式存在
——————————————————
溶液中有 Na+、Cl-、SO42- 、Mg2+ 、Ca2+
对离子进行检验是利用离子间的特征反应,如利用生成气体,沉淀,溶液的颜色变化等明显的实验实验现象进行离子的确定.▲SO42-的检验方法 先加入稀酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的
选择应该视具体情况而定,不能一成不变表述时应说明:
选用什么试剂+出现什么现象+得出什么结论▲Cl-的检验方法 先加入稀HNO3酸化,再加入AgNO3溶液,如果出现不溶于稀硝酸的白色沉淀,则存在氯离子。有 CaCl2、MgCl2、 硫酸盐,怎样除去这些可溶性杂质?化学方法除杂的原则:不增(不引入新的杂质) 、不减(不损耗样品) 、易分(容易分离) 、变化后再回到目标物.除杂的思路:选择那些易与杂质反应生成气体或沉淀的物质为试剂,然后再根据不增的原则确定加入试剂的顺序.为将杂质除尽,所加除杂试剂一般过量,过量的除杂试剂也要必须除尽.P7思考与交流NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
BaCl2过量的处理:
1、加入Na2CO3 BaCl2+Na2CO3=BaCO3↓+2NaCl
2、加入盐酸 Na2CO3+2HCl=2NaCl+H2O+CO2↑BaCl2
Na2SO4+BaCl2=BaSO4↓+2NaCl
NaOHMgCl2+2NaOH=Mg(OH)2↓+2NaClNa2CO3CaCl2+Na2CO3=CaCO3↓+2NaCl思考 除了上述加试剂顺序外,还能不能有其他的顺序?作业:
P
2、一般用量:液体1~2ml,固体盖满试管底部;
3、剩余药品处理:既不放回原瓶,也不随意丢弃,更不能拿出实验室,要放入指定的容器内。2、给试管里的药品加热,不需要垫石棉网,必须先进行预热,以免试管炸裂;物质的加热:1、绝对禁止用酒精灯引燃另一盏酒精灯;绝对禁止向燃着的酒精灯里添加酒精;用完酒精灯,必须用灯帽盖灭,不可用嘴吹灭;3、烧得很热的玻璃试管,不要立即用冷水冲洗,否则可能炸裂。
1、可直接加热的仪器:2、需垫石棉网加热的仪器3、用于分离和加液的仪器4、计量仪器仪器的使用——托盘天平(1)调零防腐先调节天平,潮湿或腐蚀的药品必须放在玻璃
器皿中称量,其他药品用大小一样质地相同的纸(2)左物右码左盘放称量物,右盘放砝码(3)先大后小取用砝码先取质量大的,再取小的(4)归零放盒称量完毕,应把游码移回零处,砝码放回砝码盒一、化学实验安全1、一些常用危险化学品的标志 2、实验安全注意的问题: (1)遵守实验室规则
(2)了解安全措施
(3)掌握正确的操作方法①不用口接触实验室的仪器和药品。
②加热液体的试管不准对着人,加热过程中的实验仪器不能直接放在实验台上,应放在石棉网上。怎样稀释浓硫酸?③稀释浓硫酸时一定要将浓硫酸缓慢注入水中并不断搅拌以散发热量。④若用加热的方法制取气体、用排水法收集气时,应先撤导管,再熄灯。(以免倒吸)氧气是如何制取的?收集的方法?实验结束时,是先撤导管还是先熄酒精灯?⑤做有毒气体实验时,应在通风橱中进行,并对尾气处理(吸收 或点燃)。进行易燃易爆气体的实验应注意验纯,尾气应点燃或适当处理.3.化学实验过程中意外事故的处理①浓酸洒在实验台上,先用Na2CO3(或NaHCO3)中和,后用水冲洗;浓酸溅到皮肤上,先用干抹布拭去,再用水冲洗。严重的须就医。浓硫酸洒在实验台,或溅到皮肤上,如何处理?②浓碱洒在实验台上,先用稀醋酸中和,然后用水冲洗干净。浓碱沾在皮肤上,宜先用水冲洗,再涂硼酸溶液。严重时要就医。③酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医。
④金属钠、非金属磷等失火要用沙土扑盖。
广口瓶——一般存放固体试剂;
细口瓶——一般存放液态试剂;
棕色试剂瓶——一般存放一些见光易分解的物质;
橡皮塞做瓶塞的试剂瓶——一般存放碱性物质。试剂瓶对所存放药品的要求:AgNO3 HNO3 HClO等 二、混合物的分离和提纯自然界中的物质的存在形式
纯净物(很少数)
混合物(绝大多数)
化学研究的物质的性质是研究纯净物的性质.
分离:是通过适当的方法,把混合物中的几种物质分开,每一组分都要保留下来,并恢复到原状态,得到比较纯的物质。提纯:指保留混合物中的某一主要组分,把其余杂质通过一定方法都除去。水洗:用水冲洗
利用物质的密度不同
碎石、沙子 :密度=2.5~3.5g/cm3
金:密度=19.3g/cm3思考与交流:P5(铁的密度:7.7g/cm3)
1、用手拣
2、用水淘
3、用磁铁
4、用盐酸学与问P5在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗? 我们在初中科学里也学过一些简单的实验方法,可用于混合物的分离和提纯,请同学们回忆一下,你了解哪些分离、提纯的方法?过滤、蒸发等【问题】粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]粗盐提纯:操作过程:
溶解——过滤——蒸发▲溶解操作:▲过滤操作:所用仪器: 通常用来分离液体和不溶的固体。▲蒸发操作:所用仪器:操作时注意:原理:利用加热的方法,使溶剂不断挥发而析出溶质的过程溶解开始时,液体混浊,静置一段时间后,上层较清,下层较混浊,有沉淀物滤纸折好,放好
安装仪器,慢慢过滤过滤后,滤液较澄清,滤纸上有沉淀物
把所得滤液倒入蒸发皿,用酒精灯加热,同时用玻棒不断搅拌,待蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
得到较白净的固体
(但质量比粗盐时少了些)
思考:P6
你认为通过上述操作得到的是比较纯的氯化钠吗?
可能还有什么杂质没有除去?
如何证明得到的盐中还含有硫酸根?还有 CaCl2、MgCl2、 硫酸盐SO42-离子的检验可溶性物质在水溶液中以离子形式存在
——————————————————
溶液中有 Na+、Cl-、SO42- 、Mg2+ 、Ca2+
对离子进行检验是利用离子间的特征反应,如利用生成气体,沉淀,溶液的颜色变化等明显的实验实验现象进行离子的确定.▲SO42-的检验方法 先加入稀酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的
选择应该视具体情况而定,不能一成不变表述时应说明:
选用什么试剂+出现什么现象+得出什么结论▲Cl-的检验方法 先加入稀HNO3酸化,再加入AgNO3溶液,如果出现不溶于稀硝酸的白色沉淀,则存在氯离子。有 CaCl2、MgCl2、 硫酸盐,怎样除去这些可溶性杂质?化学方法除杂的原则:不增(不引入新的杂质) 、不减(不损耗样品) 、易分(容易分离) 、变化后再回到目标物.除杂的思路:选择那些易与杂质反应生成气体或沉淀的物质为试剂,然后再根据不增的原则确定加入试剂的顺序.为将杂质除尽,所加除杂试剂一般过量,过量的除杂试剂也要必须除尽.P7思考与交流NaOH + HCl = NaCl + H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
BaCl2过量的处理:
1、加入Na2CO3 BaCl2+Na2CO3=BaCO3↓+2NaCl
2、加入盐酸 Na2CO3+2HCl=2NaCl+H2O+CO2↑BaCl2
Na2SO4+BaCl2=BaSO4↓+2NaCl
NaOHMgCl2+2NaOH=Mg(OH)2↓+2NaClNa2CO3CaCl2+Na2CO3=CaCO3↓+2NaCl思考 除了上述加试剂顺序外,还能不能有其他的顺序?作业:
P
