鲁科版选修4第一章第三节 化学能转化为电能--原电池(练习)
文档属性
| 名称 | 鲁科版选修4第一章第三节 化学能转化为电能--原电池(练习) |

|
|
| 格式 | zip | ||
| 文件大小 | 60.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-15 19:44:00 | ||
图片预览

文档简介
第三节化学能转化为电能---电池
【同步试题】
1、原电池工作时( )
A、正极发生氧化反应 B、负极发生氧化反应
C、电子从正极流出 D、负极质量一定减轻
2、如下图的装置能构成原电池并产生较强的电流的是( )
3、将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是( )
A、正极附近SO42—的浓度逐渐增大 B、负极附近SO42—的浓度逐渐减小
C、负极附近SO42—的浓度逐渐增大 D、正极附近SO42—的浓度基本不变
4、表明金属甲比乙的活动性强的叙述不正确的是( )
A、甲能与 稀盐酸反应生成H2而乙不能
B、将甲、乙组成原电池,甲为负极
C、在氧化还原反应中甲比乙失去电子多
D、在氧化还原反应中甲比乙容易失去电子
5、氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是( )
A、通H2的一极是正极,通O2的一极是负极
B、通O2的一极是正极,通H2的一极是负极
C、工作一段时间后电解质溶液pH增大
D、工作时负极区附近pH减小
6、将锌片和银片接触放入相同物质的量浓度的下列溶液中,反应一段时间后,溶液质量减轻的是( )
A、氯化铝 B、硫酸铜 C、硝酸银 D、稀硫酸
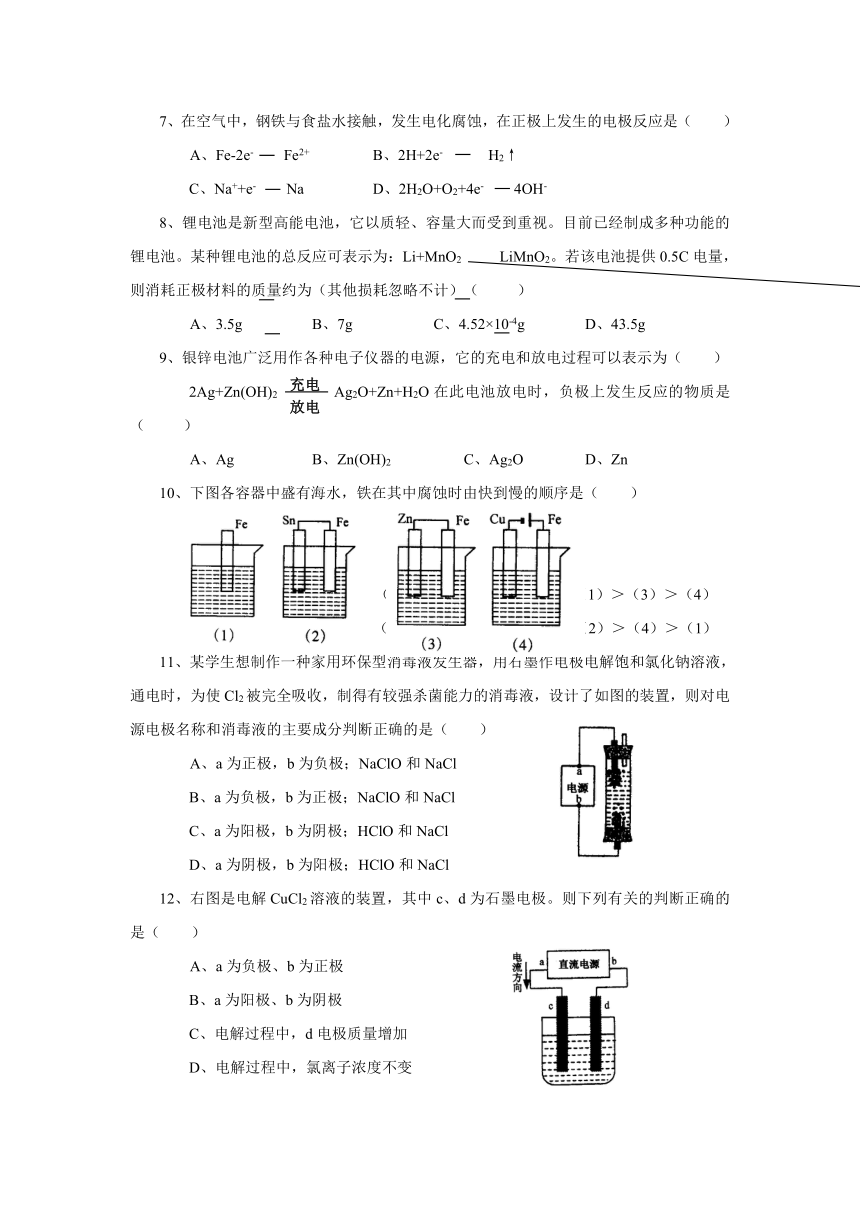
7、在空气中,钢铁与食盐水接触,发生电化腐蚀,在正极上发生的电极反应是( )
A、Fe-2e- Fe2+ B、2H+2e- H 2↑
C、Na++e- Na D、2H2O+O2+4e- 4OH-
8、锂电池是新型高能电池,它以质轻、容量大而受到重视。目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2 LiMnO2。若该电池提供0.5C电量,则消耗正极材料的质量约为(其他损耗忽略不计)( )
A、3.5g B、7g C、4.52×10-4g D、43.5g
9、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为( )
2Ag+Zn(OH)2 Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2 C、Ag2O D、Zn
10、下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是( )
A、(4)>(2)>(1)>(3) B、(2)>(1)>(3)>(4)
C、(4)>(2)>(3)>(1) D、(3)>(2)>(4)>(1)
11、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A、a为正极,b为负极;NaClO和NaCl
B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl
D、a为阴极,b为阳极;HClO和NaCl
12、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
13、常用的钮扣式银锌电池,放电时的电极反应式分别为:
Zn极:Zn+2OH-+2e- Zn(OH)2
Ag2O极:Ag2O+H2O+2e- 2Ag+2OH-则下列说法中不正确的是( )
A、放电过程中[OH-]不变 B、Zn为负极而Ag2O为正极
C、电解质溶液呈碱性 D、电子从Ag2O流出经用电器流入Zn极
14、下图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A、②①③④ B、④③①② C、④②①③ D、③②④①
15、铁钉和碳棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能发生( )
A、碳棒上放出Cl2 B、碳棒附近产生OH-
C、碳棒上放出O2 D、铁钉被氧化
16、以下现象与电化腐蚀无关的是( )
A、黄铜(铜锌)制作的铜锣不易产生铜绿 B、生铁比纯铁易生锈
C、铁质器件附有铜质配件,在接触处易生铁锈 D、银质奖牌久置后表面变暗
17、关于金属腐蚀的如下各叙述中,正确的是( )
A、金属被腐蚀的本质是:M+nH2O=M(OH)n+H2↑
B、马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C、金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D、常温下,置于空气中的金属主要发生化学腐蚀
18、微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e- ZnO+H2O,Ag2O+H2O+2e- 2Ag+2OH-,总反应式为:Ag2O+ Zn 2Ag+ZnO。根据上述反应式,下列说法正确的是( )
A、在使用过程中,电池负极区溶液的pH减小
B、使用过程中,电子由Ag2O极经外电路流向Zn极
C、Zn是负极,Ag2O是正极
D、Zn电极发生还原反应,Ag2O电极发生氧化反应
19、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A、甲 B、乙 C、丙 D、丁
20、美国阿波罗宇宙飞船上使用的氢氧燃料电池
是一种新型的化学电池,其构造如图所示;两个电极
均由多孔性碳制成,通入的气体由孔隙中逸出,并在
电极表面放电。
(1)a极是 极,b极是 极,电极
反应式分别为 , 。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式: 。此时电池内总的反应方程式为 。
第三节参考答案
1、B 2、C 3、C 4、C 5、BD 6、AC 7、D 8、C 9、D 10、A 11、B 12、C 13、D 14、C 15、BD 16、D 17、C 18、AC 19、C
20、(1)负 正 2H2+4OH—-4e=4H2O O2+2H2O+4e—=4OH—
(2)64.7%
(3)0.325L
(4)CH4+10OH—-8e—=CO32—+7H2O CH4+2O2+2OH—=CO32—+3H2O
充电
放电
【同步试题】
1、原电池工作时( )
A、正极发生氧化反应 B、负极发生氧化反应
C、电子从正极流出 D、负极质量一定减轻
2、如下图的装置能构成原电池并产生较强的电流的是( )
3、将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是( )
A、正极附近SO42—的浓度逐渐增大 B、负极附近SO42—的浓度逐渐减小
C、负极附近SO42—的浓度逐渐增大 D、正极附近SO42—的浓度基本不变
4、表明金属甲比乙的活动性强的叙述不正确的是( )
A、甲能与 稀盐酸反应生成H2而乙不能
B、将甲、乙组成原电池,甲为负极
C、在氧化还原反应中甲比乙失去电子多
D、在氧化还原反应中甲比乙容易失去电子
5、氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是( )
A、通H2的一极是正极,通O2的一极是负极
B、通O2的一极是正极,通H2的一极是负极
C、工作一段时间后电解质溶液pH增大
D、工作时负极区附近pH减小
6、将锌片和银片接触放入相同物质的量浓度的下列溶液中,反应一段时间后,溶液质量减轻的是( )
A、氯化铝 B、硫酸铜 C、硝酸银 D、稀硫酸
7、在空气中,钢铁与食盐水接触,发生电化腐蚀,在正极上发生的电极反应是( )
A、Fe-2e- Fe2+ B、2H+2e- H 2↑
C、Na++e- Na D、2H2O+O2+4e- 4OH-
8、锂电池是新型高能电池,它以质轻、容量大而受到重视。目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2 LiMnO2。若该电池提供0.5C电量,则消耗正极材料的质量约为(其他损耗忽略不计)( )
A、3.5g B、7g C、4.52×10-4g D、43.5g
9、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为( )
2Ag+Zn(OH)2 Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2 C、Ag2O D、Zn
10、下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是( )
A、(4)>(2)>(1)>(3) B、(2)>(1)>(3)>(4)
C、(4)>(2)>(3)>(1) D、(3)>(2)>(4)>(1)
11、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A、a为正极,b为负极;NaClO和NaCl
B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl
D、a为阴极,b为阳极;HClO和NaCl
12、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
13、常用的钮扣式银锌电池,放电时的电极反应式分别为:
Zn极:Zn+2OH-+2e- Zn(OH)2
Ag2O极:Ag2O+H2O+2e- 2Ag+2OH-则下列说法中不正确的是( )
A、放电过程中[OH-]不变 B、Zn为负极而Ag2O为正极
C、电解质溶液呈碱性 D、电子从Ag2O流出经用电器流入Zn极
14、下图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A、②①③④ B、④③①② C、④②①③ D、③②④①
15、铁钉和碳棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能发生( )
A、碳棒上放出Cl2 B、碳棒附近产生OH-
C、碳棒上放出O2 D、铁钉被氧化
16、以下现象与电化腐蚀无关的是( )
A、黄铜(铜锌)制作的铜锣不易产生铜绿 B、生铁比纯铁易生锈
C、铁质器件附有铜质配件,在接触处易生铁锈 D、银质奖牌久置后表面变暗
17、关于金属腐蚀的如下各叙述中,正确的是( )
A、金属被腐蚀的本质是:M+nH2O=M(OH)n+H2↑
B、马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C、金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D、常温下,置于空气中的金属主要发生化学腐蚀
18、微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e- ZnO+H2O,Ag2O+H2O+2e- 2Ag+2OH-,总反应式为:Ag2O+ Zn 2Ag+ZnO。根据上述反应式,下列说法正确的是( )
A、在使用过程中,电池负极区溶液的pH减小
B、使用过程中,电子由Ag2O极经外电路流向Zn极
C、Zn是负极,Ag2O是正极
D、Zn电极发生还原反应,Ag2O电极发生氧化反应
19、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A、甲 B、乙 C、丙 D、丁
20、美国阿波罗宇宙飞船上使用的氢氧燃料电池
是一种新型的化学电池,其构造如图所示;两个电极
均由多孔性碳制成,通入的气体由孔隙中逸出,并在
电极表面放电。
(1)a极是 极,b极是 极,电极
反应式分别为 , 。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式: 。此时电池内总的反应方程式为 。
第三节参考答案
1、B 2、C 3、C 4、C 5、BD 6、AC 7、D 8、C 9、D 10、A 11、B 12、C 13、D 14、C 15、BD 16、D 17、C 18、AC 19、C
20、(1)负 正 2H2+4OH—-4e=4H2O O2+2H2O+4e—=4OH—
(2)64.7%
(3)0.325L
(4)CH4+10OH—-8e—=CO32—+7H2O CH4+2O2+2OH—=CO32—+3H2O
充电
放电
