鲁科版选修五第一章第二节 有机化合物的结构与性质(课件)
文档属性
| 名称 | 鲁科版选修五第一章第二节 有机化合物的结构与性质(课件) |

|
|
| 格式 | rar | ||
| 文件大小 | 537.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-17 09:45:00 | ||
图片预览






文档简介
课件16张PPT。有机化合物的结构与性质
联想质疑甲烷乙烯苯燃烧、取代反应燃烧、与高锰酸钾溶液反应、加成反应燃烧、取代反应、加成反应
结构性质知识支持单键:两个原子之间共用一对电子
的共价键。
双键:两个原子之间共用两对电子
的共价键。
叁键:两个原子之间共用三对电子
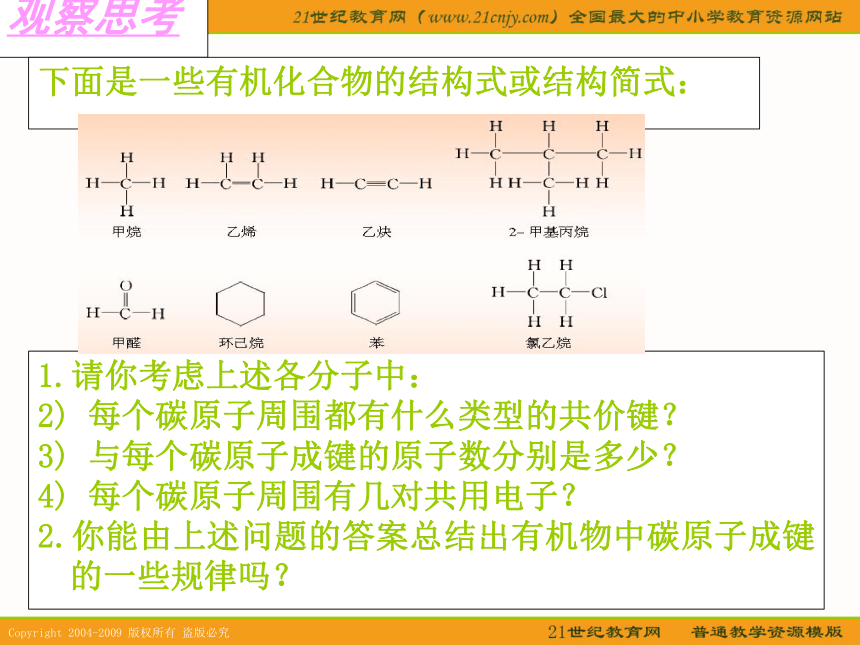
的共价键。共价键的分类及定义观察思考下面是一些有机化合物的结构式或结构简式:1.请你考虑上述各分子中:
2) 每个碳原子周围都有什么类型的共价键?
3) 与每个碳原子成键的原子数分别是多少?
4) 每个碳原子周围有几对共用电子?
2.你能由上述问题的答案总结出有机物中碳原子成键的一些规律吗?
对比归纳1) 与碳原子成键的是何种元素的原子?
每个碳原子周围都有四对共用电子。
碳原子最多与四个原子形成共价键,即四个单键。
有机化合物分子中,与4个原子形成共价键的碳原子,其价电子被利用的程度已达到饱和,称为饱和碳原子。成键原子数少于4的碳原子则称为不饱和碳原子。知识支持共价键键参数 人们常用键能、键长和键角等键参数描述共价键的特征。
键能 指101.3kPa、298K时,断开1mol气态AB分子中的化学键,使其生成气态A原子和气态B原子的过程中所吸收的能量。
键长 指两个成键原子间的平均核间距。
键角 指分子中两个共价键之间的夹角。 交流研讨1 请你根据上表所提供的数据,从键能和键长的角度结合乙烷、乙烯和乙炔的性质考虑下列问题,并与同组同学进行交流和讨论。
乙烯为什么容易发生加成反应?
将乙炔通入溴水或溴的四氯化碳溶液时会有什么现象发生?
碳原子的饱和程度与烃的化学性质有什么关系吗?分析归纳1 碳碳双键键能小于单键键能的2倍;键长大于单键键长的1/2。 碳碳叁键键能小于单键键能的3倍、小于单键和双键的键能之和。 叁键中三个键性质不同,其中两个较另一个容易断裂。乙炔容易发生加成反应。 双键中两个键性质不同,其中一个较另一个容易断裂。乙烯容易发生加成反应。 单键不容易断裂,饱和碳原子性质稳定,烷烃不能发生加成反应。不饱和碳原子性质较活泼,烯烃、炔烃容易发生加成反应。交流研讨2 观察上图四种烃分子的模型,回答下面的问题:
1 每个分子中任意两个共价键的键角是多少?
2 四种分子分别是什么空间构型?
3 键角与分子的空间构型有何关系?
4 已知碳原子的成键方式决定其周围共价键的键角,你能总结出其中有哪些规律吗?分析归纳2若一个碳原子与4个原子成键,则四个键的键角总是接近109.5o ,所以烷烃分子中的碳链是折线形碳链。
若一个碳原子与3个原子成键,则3个键的键角总是接近120o ,所以烯烃分子至少有6个原子共平面。芳香烃中至少有12个原子共平面。
若一个碳原子与2个原子成键,则2个键的键角总是接近180o ,所以炔烃分子中至少有4个原子共直线。109.5o
120o
180o
120o四个单键
两个单键、一个双键
一个单键、一个叁键
一个单键、两个特殊的碳碳键追根寻源甲烷分子的空间构型为什么是正四面体?
碳碳双键和叁键中为什么部分键容易断裂?
苯分子中碳碳键为何特殊?σ键、π键 和大π键 乙烯、乙炔分子中轨道杂化和重叠方式示意图极性键和非极性键 成键双方是同种元素的原子,吸引共用电子的能力相同,共用电子不偏向于成键原子的任何一方, 这样的共价键是非极性共价键(简称非极性键)。
成键双方是不同元素的原子,它们吸引电子的能力不同,共用电子将偏向电负性较大即吸引电子能力较强的一方,这样的共价键是极性共价键(简称极性键)。概括整合碳原子的成键方式极性键和非极性键(共价键的极性)有机化合物的性质单键、双
键和叁健
(碳原子
的饱和程
度)
谢谢各位老师!请多指教
结构性质知识支持单键:两个原子之间共用一对电子
的共价键。
双键:两个原子之间共用两对电子
的共价键。
叁键:两个原子之间共用三对电子
的共价键。共价键的分类及定义观察思考下面是一些有机化合物的结构式或结构简式:1.请你考虑上述各分子中:
2) 每个碳原子周围都有什么类型的共价键?
3) 与每个碳原子成键的原子数分别是多少?
4) 每个碳原子周围有几对共用电子?
2.你能由上述问题的答案总结出有机物中碳原子成键的一些规律吗?
对比归纳1) 与碳原子成键的是何种元素的原子?
每个碳原子周围都有四对共用电子。
碳原子最多与四个原子形成共价键,即四个单键。
有机化合物分子中,与4个原子形成共价键的碳原子,其价电子被利用的程度已达到饱和,称为饱和碳原子。成键原子数少于4的碳原子则称为不饱和碳原子。知识支持共价键键参数 人们常用键能、键长和键角等键参数描述共价键的特征。
键能 指101.3kPa、298K时,断开1mol气态AB分子中的化学键,使其生成气态A原子和气态B原子的过程中所吸收的能量。
键长 指两个成键原子间的平均核间距。
键角 指分子中两个共价键之间的夹角。 交流研讨1 请你根据上表所提供的数据,从键能和键长的角度结合乙烷、乙烯和乙炔的性质考虑下列问题,并与同组同学进行交流和讨论。
乙烯为什么容易发生加成反应?
将乙炔通入溴水或溴的四氯化碳溶液时会有什么现象发生?
碳原子的饱和程度与烃的化学性质有什么关系吗?分析归纳1 碳碳双键键能小于单键键能的2倍;键长大于单键键长的1/2。 碳碳叁键键能小于单键键能的3倍、小于单键和双键的键能之和。 叁键中三个键性质不同,其中两个较另一个容易断裂。乙炔容易发生加成反应。 双键中两个键性质不同,其中一个较另一个容易断裂。乙烯容易发生加成反应。 单键不容易断裂,饱和碳原子性质稳定,烷烃不能发生加成反应。不饱和碳原子性质较活泼,烯烃、炔烃容易发生加成反应。交流研讨2 观察上图四种烃分子的模型,回答下面的问题:
1 每个分子中任意两个共价键的键角是多少?
2 四种分子分别是什么空间构型?
3 键角与分子的空间构型有何关系?
4 已知碳原子的成键方式决定其周围共价键的键角,你能总结出其中有哪些规律吗?分析归纳2若一个碳原子与4个原子成键,则四个键的键角总是接近109.5o ,所以烷烃分子中的碳链是折线形碳链。
若一个碳原子与3个原子成键,则3个键的键角总是接近120o ,所以烯烃分子至少有6个原子共平面。芳香烃中至少有12个原子共平面。
若一个碳原子与2个原子成键,则2个键的键角总是接近180o ,所以炔烃分子中至少有4个原子共直线。109.5o
120o
180o
120o四个单键
两个单键、一个双键
一个单键、一个叁键
一个单键、两个特殊的碳碳键追根寻源甲烷分子的空间构型为什么是正四面体?
碳碳双键和叁键中为什么部分键容易断裂?
苯分子中碳碳键为何特殊?σ键、π键 和大π键 乙烯、乙炔分子中轨道杂化和重叠方式示意图极性键和非极性键 成键双方是同种元素的原子,吸引共用电子的能力相同,共用电子不偏向于成键原子的任何一方, 这样的共价键是非极性共价键(简称非极性键)。
成键双方是不同元素的原子,它们吸引电子的能力不同,共用电子将偏向电负性较大即吸引电子能力较强的一方,这样的共价键是极性共价键(简称极性键)。概括整合碳原子的成键方式极性键和非极性键(共价键的极性)有机化合物的性质单键、双
键和叁健
(碳原子
的饱和程
度)
谢谢各位老师!请多指教
