苏教版选修四专题一 化学反应与能量变化(课件)
文档属性
| 名称 | 苏教版选修四专题一 化学反应与能量变化(课件) |  | |
| 格式 | rar | ||
| 文件大小 | 111.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-17 09:01:00 | ||
图片预览








文档简介
课件23张PPT。反应热
定义:
符号:
单位:
测量仪器: 热化学方程式表示的意义
既表示出了反应中的物质变化
又表示出了反应中的能量变化热化学方程式中各物质前的化学计量数表示物质的量
不表示分子数,因而可用分数。盖斯定律及其应用
1、定义:化学反应的反应热只与反应的始末状态有关,而与具体的反应进行的途径无关。
2、应用:可通过方程式的加减间接求算某反应的反应热。CO(g)+1/2O2(g)C(s)+O2(g)CO2(g)2009年普通高等学校招生全国统一考试(山东卷)理科综合化学部分28(2)已知:O2(g) =O2+(g)+e- ; △H1=117 5.7 kJ·mol-1
PtF6(g) + e- = PtF6-(g) ;△H2= - 771.1 kJ·mol-1
O2+PtF6-(S) = O2+(g)+ PtF6- (g) ;△H3= 482.2 kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(S) 的△H=__________kJ·mol-1。利用盖斯定律,△H1+△H2+(-△H3)= —77.6 kJ·mol-1 判断一个化学反应是否能够自发进行 必须综合考虑反应的焓变和熵变△H -T△S
1.锌-锰电池(碱性电解质)
负极:锌粉。
正极:正极材料是二氧化锰,电解液是NaOH或KOH溶液。
负极:Zn+2OH--2e-=Zn(OH)2
正极:MnO2+H2O+e-=MnO(OH)+OH-
总反应:
Zn +2MnO2+2H2O=2MnO(OH)+ Zn(OH)2
优点:电池的容量和放电时间比前述普通锌-锰干电池增加几倍。故发展迅速。 电化学总: Zn+Ag2O+H2O=Zn(OH)2+2Ag2、银锌扣式电池
电池的正极呈片状,是由氧化银粉与胶体石墨压制而成。负极是由汞齐化的锌粉制成。隔膜多层复合制成。电解液是用氧化锌饱和了的NaOH溶液。电池盖用金属复合材料制成,它与电池的负极相连,电池壳体由钢镀镍而成,它与电池的正极相连。壳体和盖之间由塑料密封圈隔开。负极: Zn+2OH--2e-=Zn(OH)2正极: Ag2O+H2O+2e-=2Ag+2OH-3、铅蓄电池:
负极:Pb 正极PbO2 电解质 H2SO4
电极反应:
负极: Pb–2e-+SO42- = PbSO4
正极: PbO2 +2e-+SO42+ 4H+ =PbSO4+ 2H2O
总反应式:
Pb + PbO2 +2 SO42- + 4H+ = 2 PbSO4 + 2H2O 结果电解质H2SO4物质的量减少,浓度减少
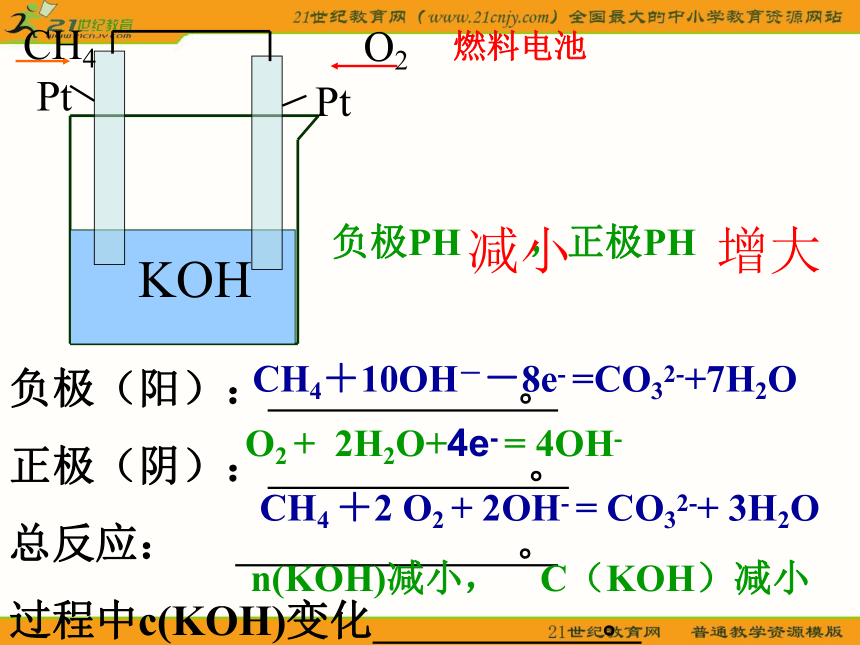
优点:电压稳定,使用方便、安全、可靠,又可以循环使用,因此广泛用于国防、科研、交通、生产和生活中。KOHCH4+10OH--8e- =CO32-+7H2OO2 + 2H2O+4e- = 4OH- CH4 +2 O2 + 2OH- = CO32-+ 3H2On(KOH)减小, C(KOH)减小减小 增大燃料电池(2007全国卷天津考题 )天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2 + LiC6 LiCoO2 + C6 ,下列说法正确的是 ( )
A.充电时,电池的负极反应为 LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低B右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
电解
KI + 3H2O = KIO3 + 3H2↑。下列有关说法正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I – – 6e – + 3H2O = IO3 – + 6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变BD据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O,则下列说法正确的是( )
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
E.充电时每生成1 mol CH3OH转移12mol电子D新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3-COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
请回答下列问题:(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氧化钠溶液反应的化学方程式 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
将含0.4molCuSO4和0.4molNaCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol铜,在另一个电极上析出气体在标准状况下的体积是______(不考虑生成的气体在水中的溶解)
A.5.6L B.6.72L C.13.44L D.11.2LA有一硝酸盐晶体,化学式为M(NO3)x·nH2O,经测定其摩质量为242g/mol,取1.21g此晶体溶于水,配制成100mL溶液,将其置于电解池中用惰性材料为电极进行电解,当有0.01mol电子通过电极时,溶液中全部金属离子即在电极上析出、经测定、阴极增重0.32g,①问1.21g此盐晶体物质的量是多少?x值是多少?②求M的相对原子质量和n值。③如电解过程中,溶液体积不变,计算电解结束后溶液的pH。n(晶体)=0.005molX=2n=3Ar(M)=64PH=1电解饱和食盐水反应原理 阳极反应:2Cl--2e- =Cl2↑(氧化反应)
阴极反应:2H++2e- =H2↑(还原反应)电解饱和食盐水的总反应可以表示为: 阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过,也就是说只允许Na+通过,而Cl-、OH-和气体则不能通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量。 离子交换膜法制烧碱 2009年高考重庆卷理综
26.(14分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。电解法阿伏加德罗常数测定(实验化学69-70页)拓展-晶体法测阿伏加德罗常数拓展-表面分散法测阿伏加德罗常数有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出
mgNaCl晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a仪器的刻
度线,即可测出NaCl固体的体积。上述操作中的a、b、c分别指……………… ( )
A.量筒、滴定管、水
B.容量瓶、滴定管、水
C.量筒、滴定管、苯
D.容量瓶、滴定管、四氯化碳
定义:
符号:
单位:
测量仪器: 热化学方程式表示的意义
既表示出了反应中的物质变化
又表示出了反应中的能量变化热化学方程式中各物质前的化学计量数表示物质的量
不表示分子数,因而可用分数。盖斯定律及其应用
1、定义:化学反应的反应热只与反应的始末状态有关,而与具体的反应进行的途径无关。
2、应用:可通过方程式的加减间接求算某反应的反应热。CO(g)+1/2O2(g)C(s)+O2(g)CO2(g)2009年普通高等学校招生全国统一考试(山东卷)理科综合化学部分28(2)已知:O2(g) =O2+(g)+e- ; △H1=117 5.7 kJ·mol-1
PtF6(g) + e- = PtF6-(g) ;△H2= - 771.1 kJ·mol-1
O2+PtF6-(S) = O2+(g)+ PtF6- (g) ;△H3= 482.2 kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(S) 的△H=__________kJ·mol-1。利用盖斯定律,△H1+△H2+(-△H3)= —77.6 kJ·mol-1 判断一个化学反应是否能够自发进行 必须综合考虑反应的焓变和熵变△H -T△S
1.锌-锰电池(碱性电解质)
负极:锌粉。
正极:正极材料是二氧化锰,电解液是NaOH或KOH溶液。
负极:Zn+2OH--2e-=Zn(OH)2
正极:MnO2+H2O+e-=MnO(OH)+OH-
总反应:
Zn +2MnO2+2H2O=2MnO(OH)+ Zn(OH)2
优点:电池的容量和放电时间比前述普通锌-锰干电池增加几倍。故发展迅速。 电化学总: Zn+Ag2O+H2O=Zn(OH)2+2Ag2、银锌扣式电池
电池的正极呈片状,是由氧化银粉与胶体石墨压制而成。负极是由汞齐化的锌粉制成。隔膜多层复合制成。电解液是用氧化锌饱和了的NaOH溶液。电池盖用金属复合材料制成,它与电池的负极相连,电池壳体由钢镀镍而成,它与电池的正极相连。壳体和盖之间由塑料密封圈隔开。负极: Zn+2OH--2e-=Zn(OH)2正极: Ag2O+H2O+2e-=2Ag+2OH-3、铅蓄电池:
负极:Pb 正极PbO2 电解质 H2SO4
电极反应:
负极: Pb–2e-+SO42- = PbSO4
正极: PbO2 +2e-+SO42+ 4H+ =PbSO4+ 2H2O
总反应式:
Pb + PbO2 +2 SO42- + 4H+ = 2 PbSO4 + 2H2O 结果电解质H2SO4物质的量减少,浓度减少
优点:电压稳定,使用方便、安全、可靠,又可以循环使用,因此广泛用于国防、科研、交通、生产和生活中。KOHCH4+10OH--8e- =CO32-+7H2OO2 + 2H2O+4e- = 4OH- CH4 +2 O2 + 2OH- = CO32-+ 3H2On(KOH)减小, C(KOH)减小减小 增大燃料电池(2007全国卷天津考题 )天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2 + LiC6 LiCoO2 + C6 ,下列说法正确的是 ( )
A.充电时,电池的负极反应为 LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低B右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
电解
KI + 3H2O = KIO3 + 3H2↑。下列有关说法正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I – – 6e – + 3H2O = IO3 – + 6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变BD据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O,则下列说法正确的是( )
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
E.充电时每生成1 mol CH3OH转移12mol电子D新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3-COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
请回答下列问题:(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氧化钠溶液反应的化学方程式 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
将含0.4molCuSO4和0.4molNaCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol铜,在另一个电极上析出气体在标准状况下的体积是______(不考虑生成的气体在水中的溶解)
A.5.6L B.6.72L C.13.44L D.11.2LA有一硝酸盐晶体,化学式为M(NO3)x·nH2O,经测定其摩质量为242g/mol,取1.21g此晶体溶于水,配制成100mL溶液,将其置于电解池中用惰性材料为电极进行电解,当有0.01mol电子通过电极时,溶液中全部金属离子即在电极上析出、经测定、阴极增重0.32g,①问1.21g此盐晶体物质的量是多少?x值是多少?②求M的相对原子质量和n值。③如电解过程中,溶液体积不变,计算电解结束后溶液的pH。n(晶体)=0.005molX=2n=3Ar(M)=64PH=1电解饱和食盐水反应原理 阳极反应:2Cl--2e- =Cl2↑(氧化反应)
阴极反应:2H++2e- =H2↑(还原反应)电解饱和食盐水的总反应可以表示为: 阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过,也就是说只允许Na+通过,而Cl-、OH-和气体则不能通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量。 离子交换膜法制烧碱 2009年高考重庆卷理综
26.(14分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。电解法阿伏加德罗常数测定(实验化学69-70页)拓展-晶体法测阿伏加德罗常数拓展-表面分散法测阿伏加德罗常数有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出
mgNaCl晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a仪器的刻
度线,即可测出NaCl固体的体积。上述操作中的a、b、c分别指……………… ( )
A.量筒、滴定管、水
B.容量瓶、滴定管、水
C.量筒、滴定管、苯
D.容量瓶、滴定管、四氯化碳
