苏教版选修四专题一第一单元 化学反应中的热效应(课件)(1)
文档属性
| 名称 | 苏教版选修四专题一第一单元 化学反应中的热效应(课件)(1) |

|
|
| 格式 | rar | ||
| 文件大小 | 66.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-17 08:38:00 | ||
图片预览






文档简介
课件22张PPT。专题1 化学反应与能量变化第一单元 化学反应的热效应
——化学反应的焓变问题讨论:
化学研究的目的是什么?获得物质和能源 通过反应可以获得新物质
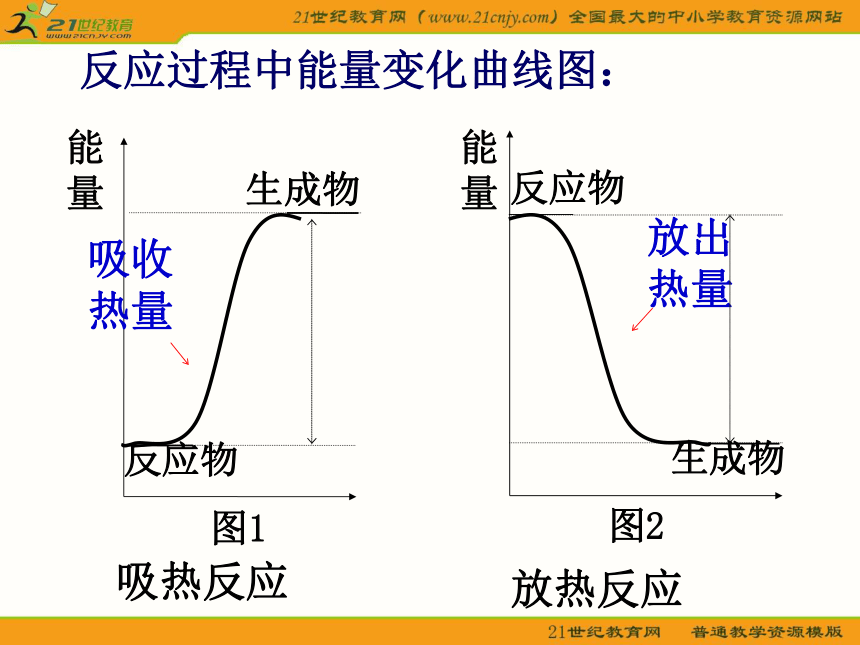
也可以获得能源(化学反应中伴随着能量变化)如何表示化学反应中的能量变化呢?一、反应的焓变 化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热.符号: ΔH ,单位:kJ/mol 或 kJ?mol-1 在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变吸热反应生成物反应物能量图1反应过程中能量变化曲线图:生成物图2反应物能量放热反应规 律: E反:反应物的能量之和
E生:生成物的能量之和(1)若E反> E生,(2)若E反< E生,放出能量 放热反应吸收能量 吸热反应反应热:△H = E生- E反
吸热反应:△H >0或者ΔH为“-”
放热反应:△H <0或者ΔH为“+”
吸热反应放热反应化学反应中 热量的反应化学反应中 热量的反应反
应吸收放出 常见的放热反应和吸热反应放热反应吸热反应燃料的燃烧
中和反应
金属与酸
大多数化合反应C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
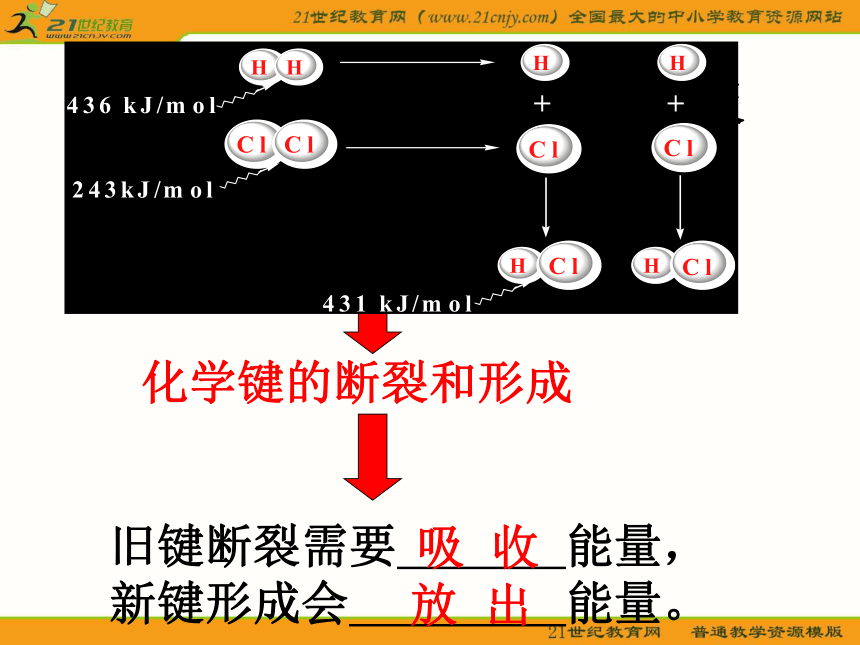
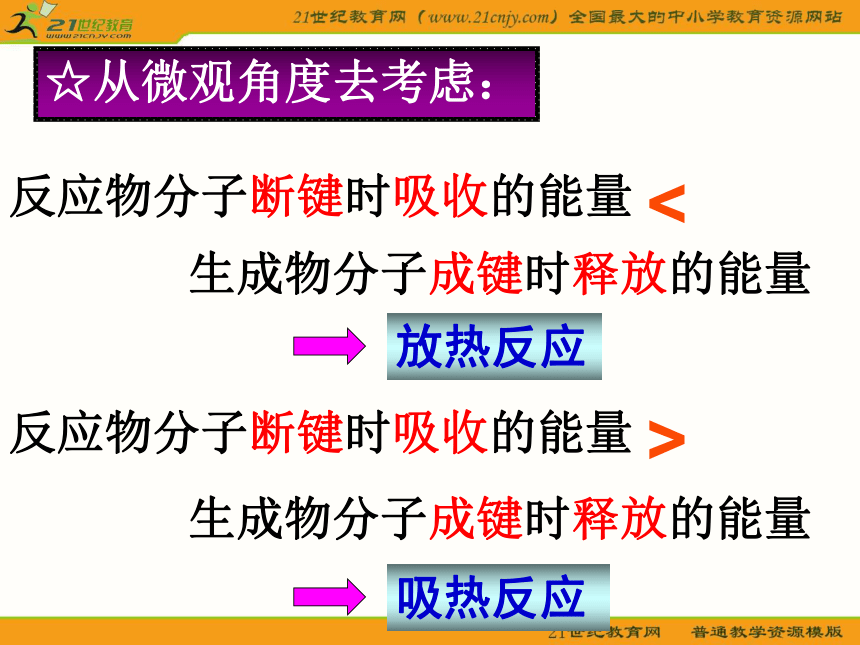
大多数分解反应问题探究:从本质上分析化学反应为什么伴随能量的变化化学反应的本质是什么?化学键的断裂和形成旧键断裂需要 能量,新键形成会 能量。放 出吸 收反应物分子断键时吸收的能量☆从微观角度去考虑:反应物分子断键时吸收的能量放热反应<生成物分子成键时释放的能量吸热反应>生成物分子成键时释放的能量小结:△H=E(生成物)- E(反应物)△H=反应物键能 - 生成物键能 温馨告白:化学反应中的能量变化,主要表现为热量变化,但还有光能、电能转化为热能等释放出来,或者是热能、电能或光能等转化为物质内部的能量(化学能)被“储存”起来的过程。二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。1.书写步骤(1)写出化学方程式
(2)注明反应物和生成物的状态
(3)标明焓变△H (注意单位和+、-)
☆要注明反应的温度和压强(一般不
注明,为一个大气压,25 0C)(4)热化学方程式中各物质前的化学计量数表示物质的量不表示
分子数,因而必要时可用简单分数。一般出现分数时是以某一
反应物或生成物为“1mol”时其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol (5) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例(6)当化学反应逆向进行时, △H数值不变,但符号相反.
(7)可逆反应中的△H数值是指该反应完全进行时的数值.
写出下列反应的热化学方程式:1.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,2.已知在25℃、101kPa下,1g C8H18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。2H2(g)+O2(g)=2H2O( g );
ΔH=-484kJ·mol-1C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(l)
△H= - 5518kJ·mol -13.46g C2H5OH (l)完全 燃烧生成CO2 (g)
和H2O (l) ,放出1366.8KJ热量。C2H5OH (l) + 3O2(g)= 2CO2(g) +3H2O(l)
△H= - 1366.8KJ·mol -1练习巩固: 已知键能:
N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。
2.热化学方程式的意义质→量→能1)表示什么物质参加反应,结
果生成什么物质2)反应物和生成物之间的质量
比、物质的量比3)反应物完全变成生成物后所
放出或吸收的热量。1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着
能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有
的总能量和反应物具有的总能量
E、分解反应肯定是吸热反应
F、物质燃烧放出热量 BCE巩固练习:2、氢气在氧气中燃烧产生蓝色火焰,已知
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3
B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3
D. Q1 + Q2 = Q3B3、在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
A.H2(g)+Cl2(g)=2HCl(g); △H1 =-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g); △H2=-Q2
B.C(s)+1/2O2(g)=CO (g); △H1=-Q1
C(s)+O2(g)=CO2 (g); △H2=-Q2
C.2H2(g)+O2(g)=2H2O(l); △H1=-Q1
2H2(g)+O2(g)=2H2O(g); △H2=-Q2
D.S(g)+O2(g)=SO2 (g); △H1=-Q1
S(s)+O2(g)=SO2 (g); △H2=-Q2B 4、 1mol C与1mol 水蒸气反应生成1mol CO 和1mol H2,需要吸收 131.5 kJ的热量。写出此反应的热化学方程式。C6、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
——化学反应的焓变问题讨论:
化学研究的目的是什么?获得物质和能源 通过反应可以获得新物质
也可以获得能源(化学反应中伴随着能量变化)如何表示化学反应中的能量变化呢?一、反应的焓变 化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热.符号: ΔH ,单位:kJ/mol 或 kJ?mol-1 在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变吸热反应生成物反应物能量图1反应过程中能量变化曲线图:生成物图2反应物能量放热反应规 律: E反:反应物的能量之和
E生:生成物的能量之和(1)若E反> E生,(2)若E反< E生,放出能量 放热反应吸收能量 吸热反应反应热:△H = E生- E反
吸热反应:△H >0或者ΔH为“-”
放热反应:△H <0或者ΔH为“+”
吸热反应放热反应化学反应中 热量的反应化学反应中 热量的反应反
应吸收放出 常见的放热反应和吸热反应放热反应吸热反应燃料的燃烧
中和反应
金属与酸
大多数化合反应C+CO2 , H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大多数分解反应问题探究:从本质上分析化学反应为什么伴随能量的变化化学反应的本质是什么?化学键的断裂和形成旧键断裂需要 能量,新键形成会 能量。放 出吸 收反应物分子断键时吸收的能量☆从微观角度去考虑:反应物分子断键时吸收的能量放热反应<生成物分子成键时释放的能量吸热反应>生成物分子成键时释放的能量小结:△H=E(生成物)- E(反应物)△H=反应物键能 - 生成物键能 温馨告白:化学反应中的能量变化,主要表现为热量变化,但还有光能、电能转化为热能等释放出来,或者是热能、电能或光能等转化为物质内部的能量(化学能)被“储存”起来的过程。二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。1.书写步骤(1)写出化学方程式
(2)注明反应物和生成物的状态
(3)标明焓变△H (注意单位和+、-)
☆要注明反应的温度和压强(一般不
注明,为一个大气压,25 0C)(4)热化学方程式中各物质前的化学计量数表示物质的量不表示
分子数,因而必要时可用简单分数。一般出现分数时是以某一
反应物或生成物为“1mol”时其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol (5) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例(6)当化学反应逆向进行时, △H数值不变,但符号相反.
(7)可逆反应中的△H数值是指该反应完全进行时的数值.
写出下列反应的热化学方程式:1.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,2.已知在25℃、101kPa下,1g C8H18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。2H2(g)+O2(g)=2H2O( g );
ΔH=-484kJ·mol-1C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(l)
△H= - 5518kJ·mol -13.46g C2H5OH (l)完全 燃烧生成CO2 (g)
和H2O (l) ,放出1366.8KJ热量。C2H5OH (l) + 3O2(g)= 2CO2(g) +3H2O(l)
△H= - 1366.8KJ·mol -1练习巩固: 已知键能:
N≡N 946KJ/mol, H-H 436KJ/mol,
H-N 391KJ/mol,写出合成氨反应的热化学方程式。
2.热化学方程式的意义质→量→能1)表示什么物质参加反应,结
果生成什么物质2)反应物和生成物之间的质量
比、物质的量比3)反应物完全变成生成物后所
放出或吸收的热量。1、下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还伴随着
能量的变化
B、放热反应不需要加热即可发生
C、需要加热条件的化学反应都是吸热反应
D、化学反应是吸热还是放热决定于生成物具有
的总能量和反应物具有的总能量
E、分解反应肯定是吸热反应
F、物质燃烧放出热量 BCE巩固练习:2、氢气在氧气中燃烧产生蓝色火焰,已知
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3
B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3
D. Q1 + Q2 = Q3B3、在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
A.H2(g)+Cl2(g)=2HCl(g); △H1 =-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g); △H2=-Q2
B.C(s)+1/2O2(g)=CO (g); △H1=-Q1
C(s)+O2(g)=CO2 (g); △H2=-Q2
C.2H2(g)+O2(g)=2H2O(l); △H1=-Q1
2H2(g)+O2(g)=2H2O(g); △H2=-Q2
D.S(g)+O2(g)=SO2 (g); △H1=-Q1
S(s)+O2(g)=SO2 (g); △H2=-Q2B 4、 1mol C与1mol 水蒸气反应生成1mol CO 和1mol H2,需要吸收 131.5 kJ的热量。写出此反应的热化学方程式。C6、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
