苏教版选修六专题七课题一 硫酸亚铁铵的制备(课件)
文档属性
| 名称 | 苏教版选修六专题七课题一 硫酸亚铁铵的制备(课件) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-20 00:00:00 | ||
图片预览






文档简介
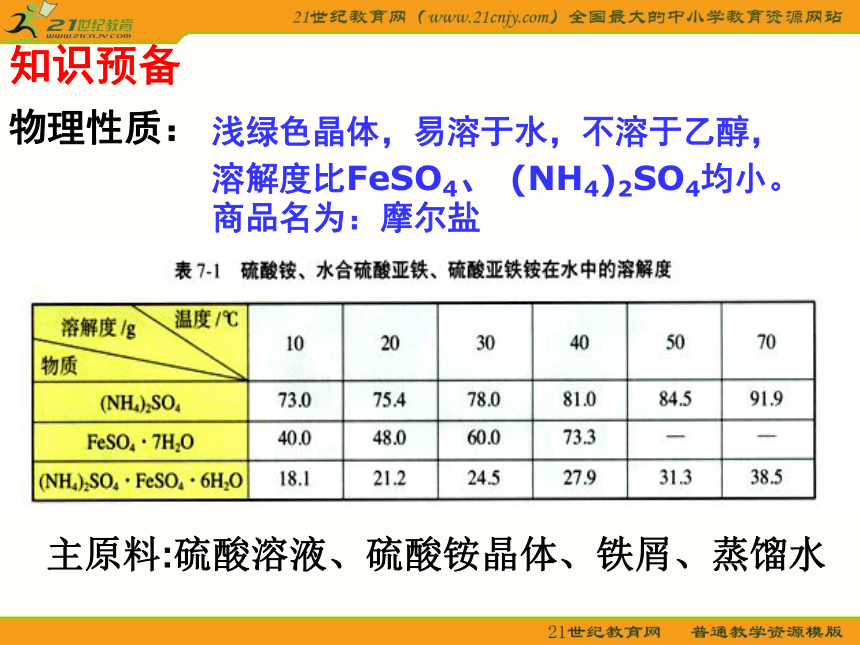
课件15张PPT。专题7 物质的制备与合成课题1 硫酸亚铁铵的制备原料:硫酸溶液、硫酸铵晶体、铁屑、蒸馏水等硫酸亚铁铵?怎么制备知识预备物理性质:浅绿色晶体,易溶于水,不溶于乙醇,
溶解度比FeSO4、 (NH4)2SO4均小。
商品名为:摩尔盐
主原料:硫酸溶液、硫酸铵晶体、铁屑、蒸馏水知识预备1.实验原理思考:1. 如何从FeSO4 、 (NH4)2SO4的混和液中
得到硫酸亚铁铵晶体?为什么?将含有FeSO4和(NH4)2SO4的混合溶液蒸发浓缩,冷却后可得硫酸亚铁铵晶体。2. 实验步骤 :硫酸亚铁的制备、硫酸亚铁铵的制备铁屑的净化、请阅读P89的具体实验步骤,思考下列问题?
ⅰ铁屑的净化:
(1)实验操作?
(2)对铁屑的选择你认为要注意什么?
(3)Na2CO3溶液的作用是什么 ?
(4)有何实验现象?
铁屑开始呈现银白色光泽。 浸泡→倾析法分离→洗涤→晾干
(煮沸) (烘干)ⅱ制取硫酸亚铁溶液
(1)实验操作?
(2)在铁和硫酸反应加热时要适当补充水的目的是什么?加入硫酸的目的是什么?
(3)在制备过程中,还要注意什么?
(4)有何实验现象?
产生大量气泡,溶液逐渐变为浅绿色。放出有刺激性气味的气体 加热→振荡→补充水→加H2SO4 →趁热过滤
(水浴) (抽滤)
→洗涤瓶、渣→转移至蒸发皿
(热水)ⅲ硫酸亚铁铵的制备
(1)实验操作?
(2) FeSO4 溶液、与 (NH4)2SO4溶液混和
有什么要求?
(3)在制备过程中,还要注意什么?
(4)有何实验现象?
液面开始出现一层膜。放置冷却。有大量晶体析出。过滤得到浅绿色晶体。加硫酸铵饱和溶液→蒸发浓缩→冷却结晶→抽滤
(出现晶膜)
→酒精洗涤晶体加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。流 程 图3.计算产率4.2g25.0g28.2g88.6思考:分离固体和互不相容的液体的有哪些方法?请完成P90的交流与讨论(NH4)2SO4·FeSO4·6H2O纯度检测
称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
①滴定时,将KMnO4酸性溶液装在 (酸式或碱式)滴定管,操作时用 手拿锥形瓶,眼睛 。
②已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
________________________________________,
③判断该反应到达滴定终点的现象为 。
④假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L。
⑤在检验产品中Fe2+含量时,为什么要用不含氧的去离子水 ?思考:硫酸亚铁铵的制备实验注意事项1.铁屑的选择。
(1)为缩短反应时间,应设法增大铁的表面积,,最好选用刨花车间加工的生铁碎铁屑(丝),或选用细弹簧弯曲状废铁;废旧铁丝纱窗也可,但净化处理、烘干后要剪成小段。
(2)避免使用锈蚀程度过大的铁屑,因其表面Fe2O3过多无法被铁完全还原,会导致Fe3+留在溶液中而影响产品的质量。
(3)市售的清洁用钢丝球不适合作为原料,因为钢丝球中金属铬、镍含量较高,最终会导致铬、镍化合物进入产品而显墨绿色。
(4)铁屑颗粒不宜太细,与酸反应时容易被反应产生的泡沫冲上浮在液面或粘在锥形瓶壁而脱离溶液;小段细铁丝也有类似情况。硫酸亚铁的制备实验注意事项2.硫酸的浓度不宜太大或太小。浓度小,反应慢;浓度太大,易产生Fe3+、SO2,使溶液出现黄色,或形成块状黑色物。3.Fe稍过量时,产品质量较好。4.反应基本结束后,为防止水解,加lmL H2SO4溶液;为防止因冷却使FeSO4晶体析出而造成损失,采用趁热过滤。5.酸溶过程中有必要进行尾气处理。
6.酸溶时要振荡,及时使铁屑回落进入酸液反应。
7.注意分次补充少量水,可防止FeSO4析出,也可控制硫酸浓度不过大。
8.实验耗时太长,而且后阶段反应越来越慢,实验时可稍微多加铁屑,溶解大部分铁屑即可,不必将所有铁屑溶解完。 硫酸亚铁的制备实验注意事项9.注意计算(NH4)2SO4的用量,略小于铁屑的物质的量,基本保持滤液(NH4)2SO4和FeSO4的物质的量1︰1,溶解之前按溶解度计算蒸馏水的用量并煮沸。在室温20℃下,(NH4)2SO4的溶解度为75.4g,9.5g(NH4)2SO4配成饱和溶液应需蒸馏水约12.5mL,溶解时可适当将烧杯在石棉网上用酒精灯加热,边搅拌。 硫酸亚铁铵的制备实验注意事项10.蒸发浓缩初期要搅拌,发现晶膜出现后停止搅拌,冷却后可结晶得到颗粒较大或块状的晶体,便于分离产率高、质量好。 11.为防止因时间过长,导致FeSO4被空气氧化,建议前后两次均采用抽滤(滤纸要压实),缩短时间较好。 12.最后,得到的(NH4)2SO4·FeSO4·6H2O晶体,用无水酒精洗涤2~3次,不能用蒸馏水或母液洗晶体。 硫酸亚铁铵的制备实验注意事项
溶解度比FeSO4、 (NH4)2SO4均小。
商品名为:摩尔盐
主原料:硫酸溶液、硫酸铵晶体、铁屑、蒸馏水知识预备1.实验原理思考:1. 如何从FeSO4 、 (NH4)2SO4的混和液中
得到硫酸亚铁铵晶体?为什么?将含有FeSO4和(NH4)2SO4的混合溶液蒸发浓缩,冷却后可得硫酸亚铁铵晶体。2. 实验步骤 :硫酸亚铁的制备、硫酸亚铁铵的制备铁屑的净化、请阅读P89的具体实验步骤,思考下列问题?
ⅰ铁屑的净化:
(1)实验操作?
(2)对铁屑的选择你认为要注意什么?
(3)Na2CO3溶液的作用是什么 ?
(4)有何实验现象?
铁屑开始呈现银白色光泽。 浸泡→倾析法分离→洗涤→晾干
(煮沸) (烘干)ⅱ制取硫酸亚铁溶液
(1)实验操作?
(2)在铁和硫酸反应加热时要适当补充水的目的是什么?加入硫酸的目的是什么?
(3)在制备过程中,还要注意什么?
(4)有何实验现象?
产生大量气泡,溶液逐渐变为浅绿色。放出有刺激性气味的气体 加热→振荡→补充水→加H2SO4 →趁热过滤
(水浴) (抽滤)
→洗涤瓶、渣→转移至蒸发皿
(热水)ⅲ硫酸亚铁铵的制备
(1)实验操作?
(2) FeSO4 溶液、与 (NH4)2SO4溶液混和
有什么要求?
(3)在制备过程中,还要注意什么?
(4)有何实验现象?
液面开始出现一层膜。放置冷却。有大量晶体析出。过滤得到浅绿色晶体。加硫酸铵饱和溶液→蒸发浓缩→冷却结晶→抽滤
(出现晶膜)
→酒精洗涤晶体加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。流 程 图3.计算产率4.2g25.0g28.2g88.6思考:分离固体和互不相容的液体的有哪些方法?请完成P90的交流与讨论(NH4)2SO4·FeSO4·6H2O纯度检测
称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
①滴定时,将KMnO4酸性溶液装在 (酸式或碱式)滴定管,操作时用 手拿锥形瓶,眼睛 。
②已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
________________________________________,
③判断该反应到达滴定终点的现象为 。
④假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L。
⑤在检验产品中Fe2+含量时,为什么要用不含氧的去离子水 ?思考:硫酸亚铁铵的制备实验注意事项1.铁屑的选择。
(1)为缩短反应时间,应设法增大铁的表面积,,最好选用刨花车间加工的生铁碎铁屑(丝),或选用细弹簧弯曲状废铁;废旧铁丝纱窗也可,但净化处理、烘干后要剪成小段。
(2)避免使用锈蚀程度过大的铁屑,因其表面Fe2O3过多无法被铁完全还原,会导致Fe3+留在溶液中而影响产品的质量。
(3)市售的清洁用钢丝球不适合作为原料,因为钢丝球中金属铬、镍含量较高,最终会导致铬、镍化合物进入产品而显墨绿色。
(4)铁屑颗粒不宜太细,与酸反应时容易被反应产生的泡沫冲上浮在液面或粘在锥形瓶壁而脱离溶液;小段细铁丝也有类似情况。硫酸亚铁的制备实验注意事项2.硫酸的浓度不宜太大或太小。浓度小,反应慢;浓度太大,易产生Fe3+、SO2,使溶液出现黄色,或形成块状黑色物。3.Fe稍过量时,产品质量较好。4.反应基本结束后,为防止水解,加lmL H2SO4溶液;为防止因冷却使FeSO4晶体析出而造成损失,采用趁热过滤。5.酸溶过程中有必要进行尾气处理。
6.酸溶时要振荡,及时使铁屑回落进入酸液反应。
7.注意分次补充少量水,可防止FeSO4析出,也可控制硫酸浓度不过大。
8.实验耗时太长,而且后阶段反应越来越慢,实验时可稍微多加铁屑,溶解大部分铁屑即可,不必将所有铁屑溶解完。 硫酸亚铁的制备实验注意事项9.注意计算(NH4)2SO4的用量,略小于铁屑的物质的量,基本保持滤液(NH4)2SO4和FeSO4的物质的量1︰1,溶解之前按溶解度计算蒸馏水的用量并煮沸。在室温20℃下,(NH4)2SO4的溶解度为75.4g,9.5g(NH4)2SO4配成饱和溶液应需蒸馏水约12.5mL,溶解时可适当将烧杯在石棉网上用酒精灯加热,边搅拌。 硫酸亚铁铵的制备实验注意事项10.蒸发浓缩初期要搅拌,发现晶膜出现后停止搅拌,冷却后可结晶得到颗粒较大或块状的晶体,便于分离产率高、质量好。 11.为防止因时间过长,导致FeSO4被空气氧化,建议前后两次均采用抽滤(滤纸要压实),缩短时间较好。 12.最后,得到的(NH4)2SO4·FeSO4·6H2O晶体,用无水酒精洗涤2~3次,不能用蒸馏水或母液洗晶体。 硫酸亚铁铵的制备实验注意事项
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
