苏教版选修六专题一课题三 硝酸钾晶体的制备(课件)
文档属性
| 名称 | 苏教版选修六专题一课题三 硝酸钾晶体的制备(课件) |

|
|
| 格式 | rar | ||
| 文件大小 | 707.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-20 13:09:00 | ||
图片预览








文档简介
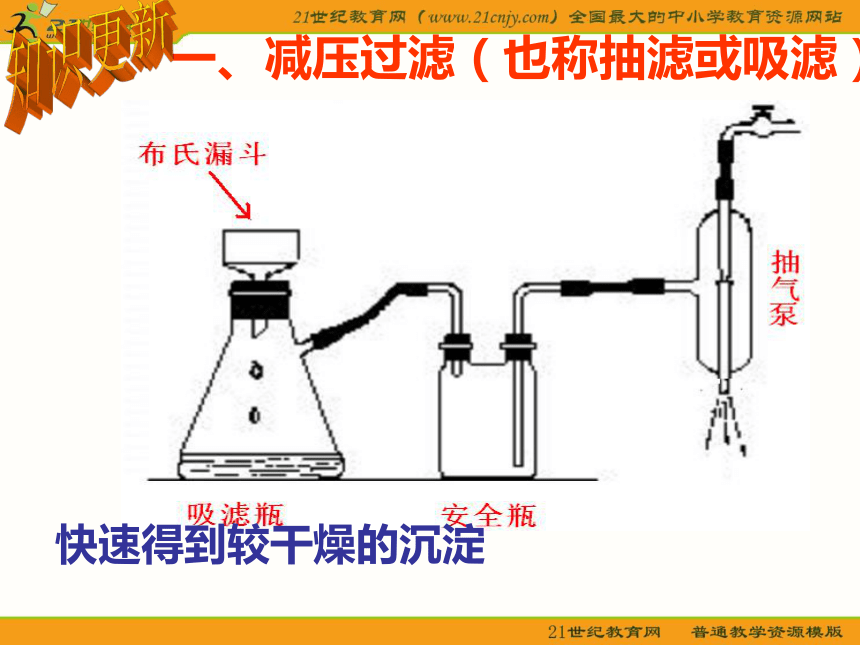
课件23张PPT。课题3 硝酸钾晶体的制备 知识回顾 我们在以前的学习中学过一些实验方法,可用于混合物的分离和提纯,请同学们回忆一下,你了解哪些分离、提纯的方法?过滤 通常用来分离液体和不溶的固体。1.常压过滤2.减压过滤
(也称抽滤或吸滤)3.热过滤1.蒸发结晶注意事项:a.蒸发皿中的溶液不超过容积的2/3;
b.加热时要不断搅拌,以免溶液溅出;
c.当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。结晶2.冷却结晶 适用于溶解度不同的固体混合物的分离。▲操作注意:
1.充分振荡,充分静止,然后分液;
2.分液时保持漏斗内与大气压一致;下层溶液下口出,上层溶液上口出。
萃取之后一般通过分液的方法将互不相溶的液体分离。萃取蒸馏注意点:①实验前在蒸馏烧瓶中先加入几粒沸石(或碎瓷片)—防止液体暴沸③冷凝水的方向:练习: 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF一、减压过滤(也称抽滤或吸滤) 快速得到较干燥的沉淀 知识更新二、热过滤装置滤纸的折叠保温漏斗 注意: 热过滤时一般不用玻璃棒引流,以免加速降温;接受滤液的容器内壁不要贴紧漏斗颈,以免滤液迅速冷却析出晶体,堵塞漏斗口。思考1:工业上生产硝酸钾是以硝酸钠和氯化钾为原料制备,请同学们根据以下表格中的数据和以前所学习的物质分离和提纯的方法,找出一种最佳方法分离出硝酸钾晶体?问题解决表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水) 溶解度的差异结晶 NaNO3 + KCl = NaCl + KNO3
溶解度随温度变化: 大 小 小 大高温下, 达到饱和的NaCl先结晶分离;然后, 在低温下, KNO3达饱和,得到产品。实验原理思路:思考2:
这样得到的晶体是否纯净?若不纯,应如何提纯? 初次结晶得到的晶体中 常会混有少量NaCl杂质。将所得晶体溶于少量水中,然后进行冷却、 结晶、过滤,如此反复的操作。 热过滤:
趁热过滤,
得KNO3饱和溶液
(回收NaCl晶体)结晶:
KNO3溶液冷却
有KNO3晶体
析出蒸发:
小火加热
至有较多
晶体析出 溶解:
20g NaNO3
17g KCl
35ml水抽滤:
得KNO3晶体称量:
称量得 ,
粗KNO3质量1. 制备KNO3粗品实验操作溶解:
按KNO3∶H2O= 2∶1
加适量水溶解2.KNO3提纯(重结晶)加热:
沸腾
即止冷却:
有针状
KNO3析出抽滤:
得KNO3晶体 烘干:
水浴烘干
(在表面皿中)称重:
精品KNO3 将所得晶体溶于少量溶剂中,然后进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。 水蒸气烘干装置水蒸气烘干产物烘干思考3:请设计一个实验来检验两种情况下制备得到产品的纯度大小?练习:1.某实验小组只领取了下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,下列实验操作不能进行的是( )
A. 蒸发 B. 萃取
C. 过滤 D. 蒸馏CD2. 减压吸滤装备和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是( )
A. 可过滤胶状沉淀
B. 可过滤颗粒更小的沉淀
C. 可使沉淀中的杂质减少
D. 可得到较干燥的沉淀D3. 将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,有晶体析出。趁热过滤,分离出晶体A。将上述滤液冷却至室温,又有晶体的B析出。
(1)晶体A的主要成分是________,含有的少量杂质是_________,要除去晶体 A中的少量杂质的方法是_______________.
(2)晶体B的主要成分是________,含有的少量杂质是_________,要除去晶体 B中的少量杂质的方法是_______________.
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法,这种方法适用于晶体 ____(填A或B)NaClKNO3加少量水溶解再过滤KNO3NaCl重结晶A交流与讨论:阅读P16谢谢大家!
(也称抽滤或吸滤)3.热过滤1.蒸发结晶注意事项:a.蒸发皿中的溶液不超过容积的2/3;
b.加热时要不断搅拌,以免溶液溅出;
c.当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。结晶2.冷却结晶 适用于溶解度不同的固体混合物的分离。▲操作注意:
1.充分振荡,充分静止,然后分液;
2.分液时保持漏斗内与大气压一致;下层溶液下口出,上层溶液上口出。
萃取之后一般通过分液的方法将互不相溶的液体分离。萃取蒸馏注意点:①实验前在蒸馏烧瓶中先加入几粒沸石(或碎瓷片)—防止液体暴沸③冷凝水的方向:练习: 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF一、减压过滤(也称抽滤或吸滤) 快速得到较干燥的沉淀 知识更新二、热过滤装置滤纸的折叠保温漏斗 注意: 热过滤时一般不用玻璃棒引流,以免加速降温;接受滤液的容器内壁不要贴紧漏斗颈,以免滤液迅速冷却析出晶体,堵塞漏斗口。思考1:工业上生产硝酸钾是以硝酸钠和氯化钾为原料制备,请同学们根据以下表格中的数据和以前所学习的物质分离和提纯的方法,找出一种最佳方法分离出硝酸钾晶体?问题解决表1 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水) 溶解度的差异结晶 NaNO3 + KCl = NaCl + KNO3
溶解度随温度变化: 大 小 小 大高温下, 达到饱和的NaCl先结晶分离;然后, 在低温下, KNO3达饱和,得到产品。实验原理思路:思考2:
这样得到的晶体是否纯净?若不纯,应如何提纯? 初次结晶得到的晶体中 常会混有少量NaCl杂质。将所得晶体溶于少量水中,然后进行冷却、 结晶、过滤,如此反复的操作。 热过滤:
趁热过滤,
得KNO3饱和溶液
(回收NaCl晶体)结晶:
KNO3溶液冷却
有KNO3晶体
析出蒸发:
小火加热
至有较多
晶体析出 溶解:
20g NaNO3
17g KCl
35ml水抽滤:
得KNO3晶体称量:
称量得 ,
粗KNO3质量1. 制备KNO3粗品实验操作溶解:
按KNO3∶H2O= 2∶1
加适量水溶解2.KNO3提纯(重结晶)加热:
沸腾
即止冷却:
有针状
KNO3析出抽滤:
得KNO3晶体 烘干:
水浴烘干
(在表面皿中)称重:
精品KNO3 将所得晶体溶于少量溶剂中,然后进行蒸发(或冷却)、结晶、过滤,如此反复的操作称为重结晶。 水蒸气烘干装置水蒸气烘干产物烘干思考3:请设计一个实验来检验两种情况下制备得到产品的纯度大小?练习:1.某实验小组只领取了下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。只用上述仪器或用品,下列实验操作不能进行的是( )
A. 蒸发 B. 萃取
C. 过滤 D. 蒸馏CD2. 减压吸滤装备和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是( )
A. 可过滤胶状沉淀
B. 可过滤颗粒更小的沉淀
C. 可使沉淀中的杂质减少
D. 可得到较干燥的沉淀D3. 将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾,有晶体析出。趁热过滤,分离出晶体A。将上述滤液冷却至室温,又有晶体的B析出。
(1)晶体A的主要成分是________,含有的少量杂质是_________,要除去晶体 A中的少量杂质的方法是_______________.
(2)晶体B的主要成分是________,含有的少量杂质是_________,要除去晶体 B中的少量杂质的方法是_______________.
(3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的方法,这种方法适用于晶体 ____(填A或B)NaClKNO3加少量水溶解再过滤KNO3NaCl重结晶A交流与讨论:阅读P16谢谢大家!
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
