江苏省常州新桥中学化学学案(选修3):原子核外电子排布的周期性
文档属性
| 名称 | 江苏省常州新桥中学化学学案(选修3):原子核外电子排布的周期性 |
|
|
| 格式 | rar | ||
| 文件大小 | 15.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-22 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一课时 原子核外电子排布的周期性
【学习目标】掌握原子核外电子排布的周期性变化及部分性质的周期性变化。
【课前预习】
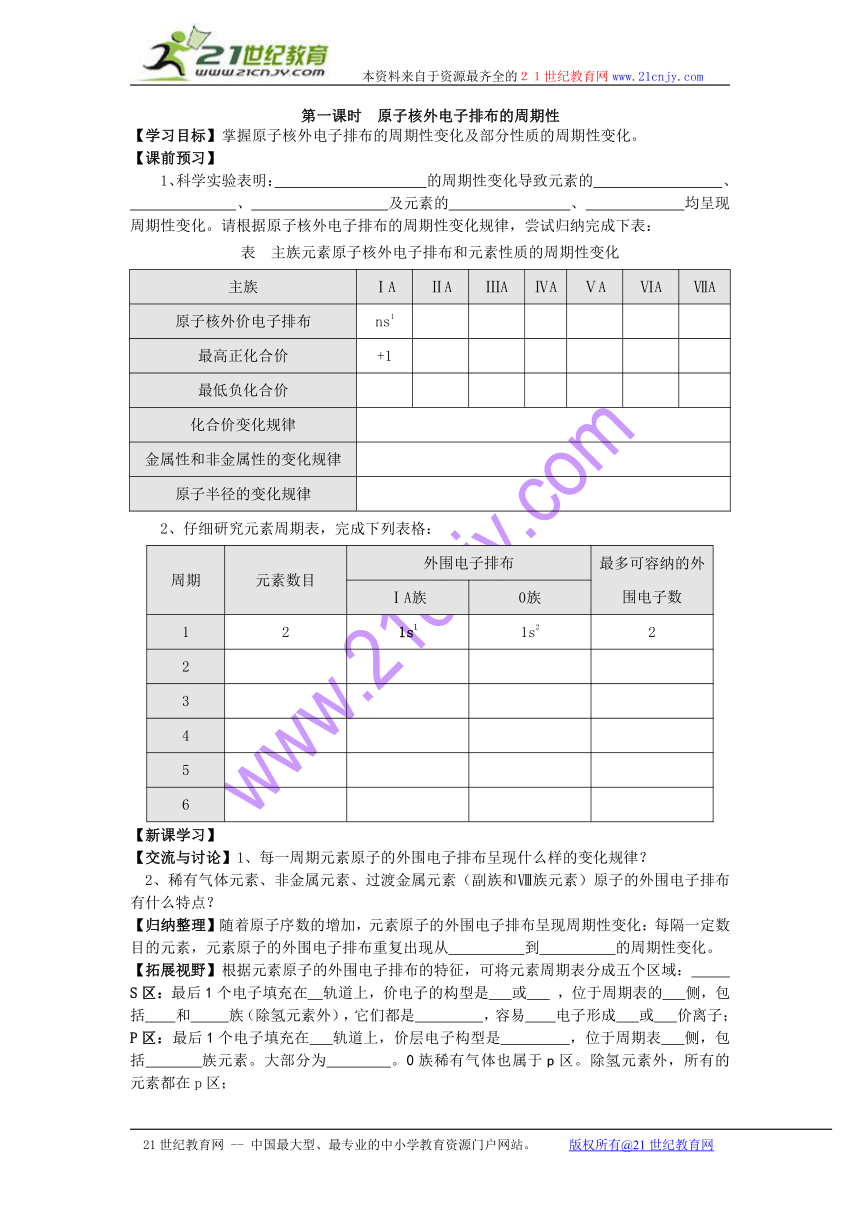
1、科学实验表明: 的周期性变化导致元素的 、
、 及元素的 、 均呈现周期性变化。请根据原子核外电子排布的周期性变化规律,尝试归纳完成下表:
表 主族元素原子核外电子排布和元素性质的周期性变化
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布 ns1
最高正化合价 +1
最低负化合价
化合价变化规律
金属性和非金属性的变化规律
原子半径的变化规律
2、仔细研究元素周期表,完成下列表格:
周期 元素数目 外围电子排布 最多可容纳的外围电子数
ⅠA族 0族
1 2 1s1 1s2 2
2
3
4
5
6
【新课学习】
【交流与讨论】1、每一周期元素原子的外围电子排布呈现什么样的变化规律?
2、稀有气体元素、非金属元素、过渡金属元素(副族和Ⅷ族元素)原子的外围电子排布有什么特点?
【归纳整理】随着原子序数的增加,元素原子的外围电子排布呈现周期性变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从 到 的周期性变化。
【拓展视野】根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:
S区:最后1个电子填充在 轨道上,价电子的构型是 或 ,位于周期表的 侧,包括 和 族(除氢元素外),它们都是 ,容易 电子形成 或 价离子;
P区:最后1个电子填充在 轨道上,价层电子构型是 ,位于周期表 侧,包括 族元素。大部分为 。0族稀有气体也属于p区。除氢元素外,所有的 元素都在p区;
s区和p区的共同特点是: 都排布在 , 等于该元素的 数。s区和p区就是按族划分的周期表中的 族。
d区:它们的价层电子构型是 ,最后1个电子基本都是填充在倒数第二层
轨道上的元素,位于长周期的 部。这些元素都是 ,常有 ,称为 。它包括 族元素。
ds区价层电子构型是 ,即 轨道是 的, 上有 个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括 和 族,处于周期
表 区和 区之间。它们都是 ,也属 。
f区:最后1个电子填充在 轨道上,价电子构型是: 或 ,它包括 元素(各有 种元素)。
【归纳小结】各区元素特点:
包括元素 价电子排布 化学性质
s区
p区
d区
ds区
f区
【巩固练习】
1、具有以下结构的原子,一定属于主族元素的是( )
A、最外层有3个电子的原子 B、最外层电子排布为ns2的原子
C、最外层有3个未成对电子的原子 D、次外层无未成对电子的原子
2、若x是ⅡB族的原子序数,则原子序数为(x+1)的元素在( )
A、ⅡA B、ⅢB C、ⅢA D、无法确定
3、下列说法中,正确的是 ( )
A、s 区元素都是金属元素 B、p 区元素全部是非金属元素
C、过渡元素由d区、ds区和f区元素组成 D、短周期只有s区、p区
4、某元素基态(能量最低状态)原子最外层为4s1,它位于周期表哪个区?第几周期第几族?写出相应的最高价氧化物的化学式。
5、已知某元素的原子序数是50,试推测:
(1)该元素原子的核外电子排布情况;
(2)该元素在周期表中的位置;
(3)该元素是金属元素还是非金属元素;
(4)最高价氧化物及其水化物的酸碱性。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一课时 原子核外电子排布的周期性
【学习目标】掌握原子核外电子排布的周期性变化及部分性质的周期性变化。
【课前预习】
1、科学实验表明: 的周期性变化导致元素的 、
、 及元素的 、 均呈现周期性变化。请根据原子核外电子排布的周期性变化规律,尝试归纳完成下表:
表 主族元素原子核外电子排布和元素性质的周期性变化
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布 ns1
最高正化合价 +1
最低负化合价
化合价变化规律
金属性和非金属性的变化规律
原子半径的变化规律
2、仔细研究元素周期表,完成下列表格:
周期 元素数目 外围电子排布 最多可容纳的外围电子数
ⅠA族 0族
1 2 1s1 1s2 2
2
3
4
5
6
【新课学习】
【交流与讨论】1、每一周期元素原子的外围电子排布呈现什么样的变化规律?
2、稀有气体元素、非金属元素、过渡金属元素(副族和Ⅷ族元素)原子的外围电子排布有什么特点?
【归纳整理】随着原子序数的增加,元素原子的外围电子排布呈现周期性变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从 到 的周期性变化。
【拓展视野】根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:
S区:最后1个电子填充在 轨道上,价电子的构型是 或 ,位于周期表的 侧,包括 和 族(除氢元素外),它们都是 ,容易 电子形成 或 价离子;
P区:最后1个电子填充在 轨道上,价层电子构型是 ,位于周期表 侧,包括 族元素。大部分为 。0族稀有气体也属于p区。除氢元素外,所有的 元素都在p区;
s区和p区的共同特点是: 都排布在 , 等于该元素的 数。s区和p区就是按族划分的周期表中的 族。
d区:它们的价层电子构型是 ,最后1个电子基本都是填充在倒数第二层
轨道上的元素,位于长周期的 部。这些元素都是 ,常有 ,称为 。它包括 族元素。
ds区价层电子构型是 ,即 轨道是 的, 上有 个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括 和 族,处于周期
表 区和 区之间。它们都是 ,也属 。
f区:最后1个电子填充在 轨道上,价电子构型是: 或 ,它包括 元素(各有 种元素)。
【归纳小结】各区元素特点:
包括元素 价电子排布 化学性质
s区
p区
d区
ds区
f区
【巩固练习】
1、具有以下结构的原子,一定属于主族元素的是( )
A、最外层有3个电子的原子 B、最外层电子排布为ns2的原子
C、最外层有3个未成对电子的原子 D、次外层无未成对电子的原子
2、若x是ⅡB族的原子序数,则原子序数为(x+1)的元素在( )
A、ⅡA B、ⅢB C、ⅢA D、无法确定
3、下列说法中,正确的是 ( )
A、s 区元素都是金属元素 B、p 区元素全部是非金属元素
C、过渡元素由d区、ds区和f区元素组成 D、短周期只有s区、p区
4、某元素基态(能量最低状态)原子最外层为4s1,它位于周期表哪个区?第几周期第几族?写出相应的最高价氧化物的化学式。
5、已知某元素的原子序数是50,试推测:
(1)该元素原子的核外电子排布情况;
(2)该元素在周期表中的位置;
(3)该元素是金属元素还是非金属元素;
(4)最高价氧化物及其水化物的酸碱性。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
