溶液的配制及分析集体备课
文档属性
| 名称 | 溶液的配制及分析集体备课 |  | |
| 格式 | rar | ||
| 文件大小 | 290.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-24 10:16:00 | ||
图片预览







文档简介
课件23张PPT。溶液的配制及分析溶液中溶质的质量分数(ω):
溶质B的质量和溶液的质量之比复习:溶液浓度一份血样检查报告单单核细胞比率 13.7(3.0-8.0%) 中性粒细胞比率 31.1(40.0-60.0%) 血红蛋白 111(120-160g/l) 白蛋白 51.6(35.0-55.0g/l)
总胆红素: 正常情况(5.1-17.1)umol/L
间接胆红素: 正常情况(1.7-13.7)umol/L
直接胆红素: 正常情况(0-3.4)umol/L一、物质的量浓度以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用c(B)表示。注意:1L=1dm3
1mL=1cm3
1L=1000mL(1)将1gNaCl溶于水制成1L溶液 ,则所得溶
液中NaCl的物质的量浓度为1mol/L。
(2)将1mol NaCl溶于1L水 ,则所得溶
液中NaCl的物质的量浓度为1mol/L 。(3)将1mol NaCl溶于水制成1L溶液,则所得
溶液中NaCl的物质的量浓度为1mol/L 。练习1:判断下列说法是否正确错错对练习2:配制 100mL 0.100mol/L 的Na2CO3溶液,需要碳酸钠固体的质量是多少?配制一定质量分数的溶液可分三步:1、计算
2、称量
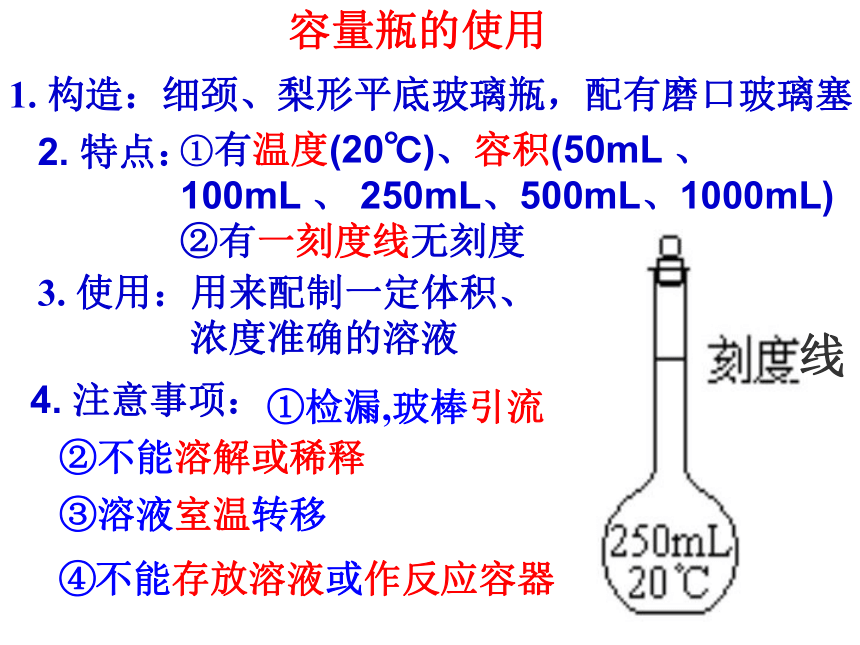
3、溶解例:怎样配制 100mL 0.100mol/L 的Na2CO3溶液?容量瓶的使用1. 构造:细颈、梨形平底玻璃瓶,配有磨口玻璃塞①有温度(20℃)、容积(50mL 、 100mL 、 250mL、500mL、1000mL)
②有一刻度线无刻度3. 使用:用来配制一定体积、
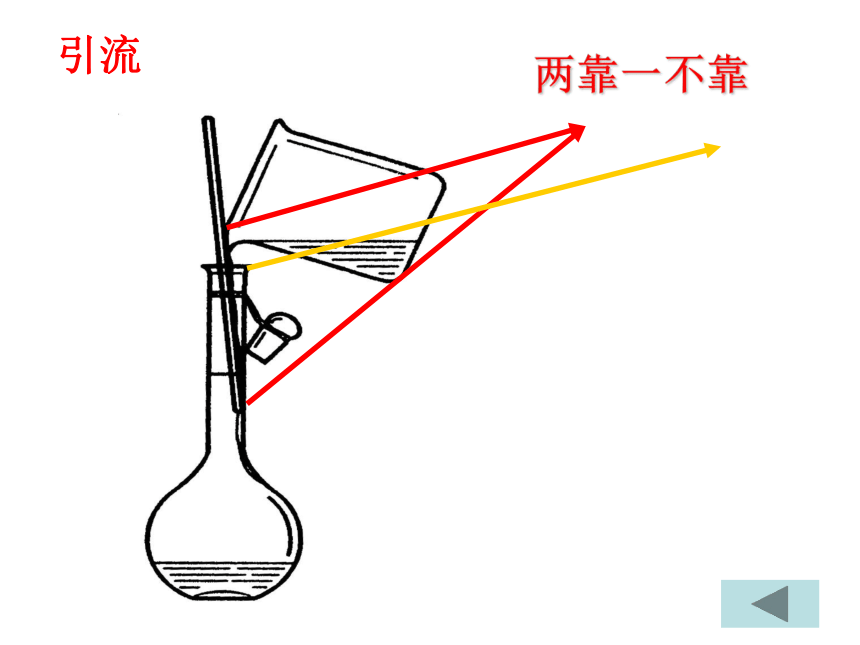
浓度准确的溶液①检漏,玻棒引流②不能溶解或稀释③溶液室温转移线4. 注意事项:2. 特点:④不能存放溶液或作反应容器两靠一不靠引流定容加入蒸馏水,距刻度1~2cm,用胶头滴管滴加至刻度线。平视装瓶贴签不能存放溶液,把溶液转移到试剂瓶中,
贴标签,溶液名称和浓度。操作注意事项: 1、用烧杯溶解
2、溶解后,需冷却才能转移
3、玻璃棒引流时应做到二靠一不靠
4、要洗涤烧杯和玻璃棒,并将洗涤液完全转移 到容量瓶中
5、定容时要平视
6、需将溶液装入试剂瓶①用天平称取氢氧化钠固体 克
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯适量冷却玻璃棒250练习3:欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:.0③用少量蒸馏水洗涤烧杯内壁和玻璃
棒 次,将洗涤液移入 中。
④向容量瓶内加水至刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~31~2厘米胶头滴管偏低重新配制摇匀容量瓶试剂瓶作业: P26第4题2. 称量注意事项:
(1)调零
(2)托盘上各放称量纸
(3)左物右码
(4)砝码从大到小取用
(5)砝码回盒,游码归零思考:NaOH能否直接放在称量纸上称量?
为什么?应如何操作?3. 溶解注意事项:
烧杯中溶解,不能在容量瓶中溶解。提问:还需哪些仪器?注意?玻璃棒。
沿着一定方向,不碰烧杯底,烧杯壁
玻璃棒不放实验台,以免弄脏。思考:若量取的是浓硫酸需要稀释,
应如何操作才是正确的?容量瓶体积受温度影响。溶解伴随着热效应,热胀冷缩使体积不准确,
导致容量瓶炸裂。4. 转移 注意事项:
容量瓶瓶颈较细,玻璃棒引流。提问:
转移氯化钠溶液时,溶质是否完全被转移?如何处理?残留烧杯壁,玻璃棒上。
用蒸馏水洗涤烧杯和玻璃棒。洗涤注意事项:
少量蒸馏水洗涤2~3次,洗涤液转移容量瓶中。思考:如果用量筒量取液体药品,量筒要洗涤吗?量筒量取液体药品,量筒不必洗涤。
若洗涤后转移导致所配溶液浓度偏高。
注意量筒与量取液体的体积匹配。5.定容加入蒸馏水,距刻度1~2cm,用胶头滴管滴加至刻度线。思考:
定容液面超过刻度线,怎么办?
用胶头滴管把多余的液体取出吗?必须重新配制摇匀盖好塞子,倒转和摇动多次,使溶液混合均匀。思考:
摇匀后液面低于刻线,能否补充水?不能。因为是部分溶液润湿瓶口损失所致。交流与讨论 若用2mol/L盐酸,配制250 mL0.2mol/L盐酸,上面的操作有哪些需要改进?实验所需仪器 容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平或量筒(液体溶质使用)
溶质B的质量和溶液的质量之比复习:溶液浓度一份血样检查报告单单核细胞比率 13.7(3.0-8.0%) 中性粒细胞比率 31.1(40.0-60.0%) 血红蛋白 111(120-160g/l) 白蛋白 51.6(35.0-55.0g/l)
总胆红素: 正常情况(5.1-17.1)umol/L
间接胆红素: 正常情况(1.7-13.7)umol/L
直接胆红素: 正常情况(0-3.4)umol/L一、物质的量浓度以单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。用c(B)表示。注意:1L=1dm3
1mL=1cm3
1L=1000mL(1)将1gNaCl溶于水制成1L溶液 ,则所得溶
液中NaCl的物质的量浓度为1mol/L。
(2)将1mol NaCl溶于1L水 ,则所得溶
液中NaCl的物质的量浓度为1mol/L 。(3)将1mol NaCl溶于水制成1L溶液,则所得
溶液中NaCl的物质的量浓度为1mol/L 。练习1:判断下列说法是否正确错错对练习2:配制 100mL 0.100mol/L 的Na2CO3溶液,需要碳酸钠固体的质量是多少?配制一定质量分数的溶液可分三步:1、计算
2、称量
3、溶解例:怎样配制 100mL 0.100mol/L 的Na2CO3溶液?容量瓶的使用1. 构造:细颈、梨形平底玻璃瓶,配有磨口玻璃塞①有温度(20℃)、容积(50mL 、 100mL 、 250mL、500mL、1000mL)
②有一刻度线无刻度3. 使用:用来配制一定体积、
浓度准确的溶液①检漏,玻棒引流②不能溶解或稀释③溶液室温转移线4. 注意事项:2. 特点:④不能存放溶液或作反应容器两靠一不靠引流定容加入蒸馏水,距刻度1~2cm,用胶头滴管滴加至刻度线。平视装瓶贴签不能存放溶液,把溶液转移到试剂瓶中,
贴标签,溶液名称和浓度。操作注意事项: 1、用烧杯溶解
2、溶解后,需冷却才能转移
3、玻璃棒引流时应做到二靠一不靠
4、要洗涤烧杯和玻璃棒,并将洗涤液完全转移 到容量瓶中
5、定容时要平视
6、需将溶液装入试剂瓶①用天平称取氢氧化钠固体 克
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯适量冷却玻璃棒250练习3:欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:.0③用少量蒸馏水洗涤烧杯内壁和玻璃
棒 次,将洗涤液移入 中。
④向容量瓶内加水至刻度线 时,改用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~31~2厘米胶头滴管偏低重新配制摇匀容量瓶试剂瓶作业: P26第4题2. 称量注意事项:
(1)调零
(2)托盘上各放称量纸
(3)左物右码
(4)砝码从大到小取用
(5)砝码回盒,游码归零思考:NaOH能否直接放在称量纸上称量?
为什么?应如何操作?3. 溶解注意事项:
烧杯中溶解,不能在容量瓶中溶解。提问:还需哪些仪器?注意?玻璃棒。
沿着一定方向,不碰烧杯底,烧杯壁
玻璃棒不放实验台,以免弄脏。思考:若量取的是浓硫酸需要稀释,
应如何操作才是正确的?容量瓶体积受温度影响。溶解伴随着热效应,热胀冷缩使体积不准确,
导致容量瓶炸裂。4. 转移 注意事项:
容量瓶瓶颈较细,玻璃棒引流。提问:
转移氯化钠溶液时,溶质是否完全被转移?如何处理?残留烧杯壁,玻璃棒上。
用蒸馏水洗涤烧杯和玻璃棒。洗涤注意事项:
少量蒸馏水洗涤2~3次,洗涤液转移容量瓶中。思考:如果用量筒量取液体药品,量筒要洗涤吗?量筒量取液体药品,量筒不必洗涤。
若洗涤后转移导致所配溶液浓度偏高。
注意量筒与量取液体的体积匹配。5.定容加入蒸馏水,距刻度1~2cm,用胶头滴管滴加至刻度线。思考:
定容液面超过刻度线,怎么办?
用胶头滴管把多余的液体取出吗?必须重新配制摇匀盖好塞子,倒转和摇动多次,使溶液混合均匀。思考:
摇匀后液面低于刻线,能否补充水?不能。因为是部分溶液润湿瓶口损失所致。交流与讨论 若用2mol/L盐酸,配制250 mL0.2mol/L盐酸,上面的操作有哪些需要改进?实验所需仪器 容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平或量筒(液体溶质使用)
