化学反应热的计算
图片预览





文档简介
课件19张PPT。选修4 第一章
第三节 化学反应热的计算
北京市东城区教师研修中心 周业虹
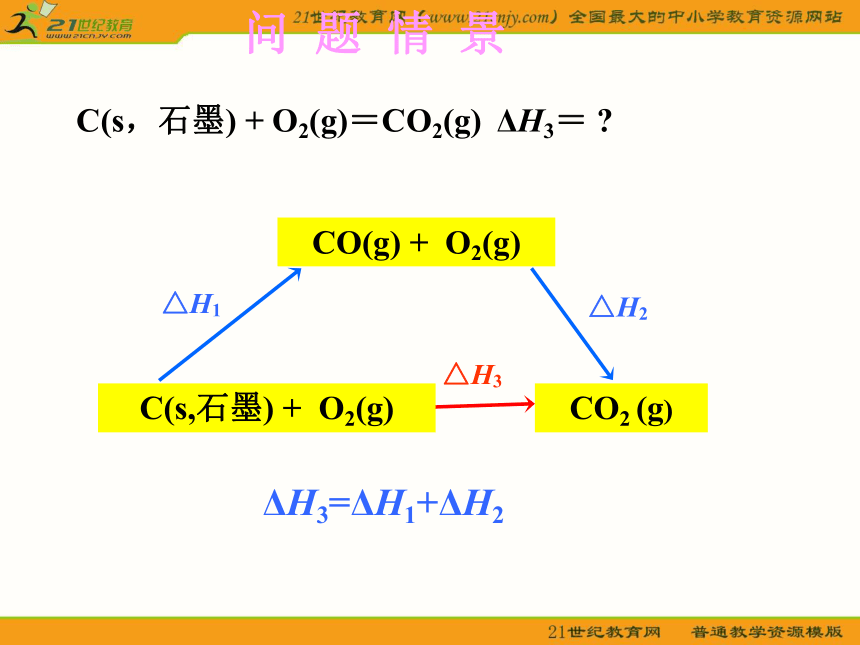
北京市24中 冯杰利ΔH3 =ΔH1 + ΔH2
= -110.5 kJ/mol +(- 283.0 kJ/mol)
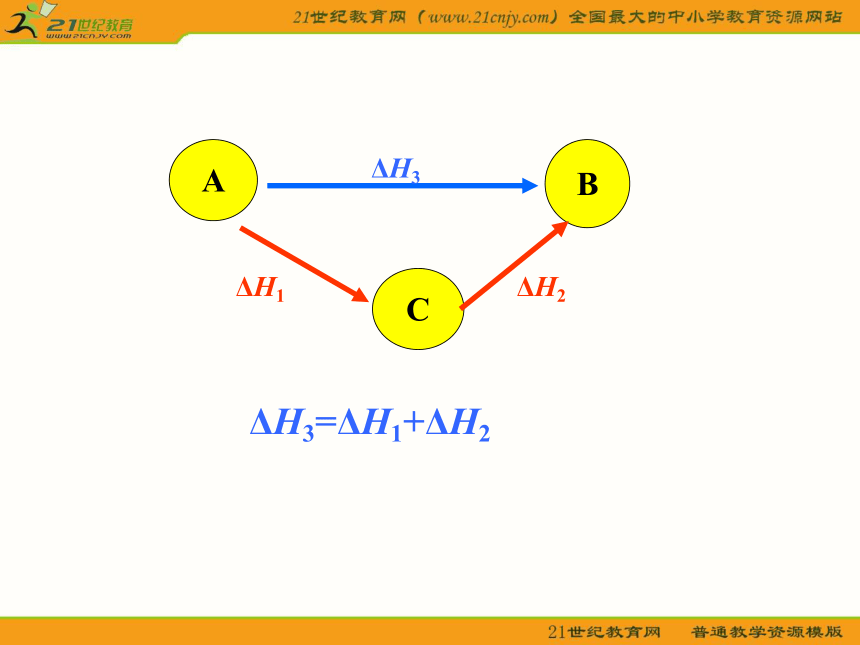
= -393.5 kJ/mol 在学案资料卡片中查找石墨的燃烧热数据,验证这一结果是否正确 .-393.5 kJ/mol问 题 情 景CO(g) + O2(g) CO2 (g) △H3△H2△H1C(s,石墨) + O2(g)ΔH3=ΔH1+ΔH2C(s,石墨) + O2(g)=CO2(g) ΔH3= ?问 题 情 景ΔH3=ΔH1+ΔH2BACΔH1ΔH21.如何用文字表述盖斯定律?
2.如何从能量守恒角度论证盖斯定律的正确性?
3.盖斯定律在生产和科研中有何重要作用?思考与交流1.盖斯定律的内容 不管化学反应是一步完成或是分几步完成,其总反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
1.盖斯定律的内容请把下面生活实例与盖斯定律进行类比(1)登山类比盖斯定律坐缆车
或步行 S(始态) L(终态)△H1〈 0△H 2〉0△H1+ △H 2≡ 02.从能量守恒角度论证盖斯定律为什么 △H1+△H2≠0 ?思考与交流C (s ,石墨)+O2(g)==CO2(g) △H1= -393.5 kJ/mol
CO2(g) == C (s ,金刚石)+O2(g) △H2= +395.0 kJ/mol3. 盖斯定律的应用 盖斯定律可用来计算难以直接测定的化学反应的反应热,如反应慢、副反应多、反应不易直接发生等。提示:所需要数据可在学案资料卡片中查找如何利用盖斯定律设计适当的反应路径计算出来?提升应用ΔH1=ΔH3-ΔH2
=- 890.315 kJ/mol –(-283.0 kJ/mol)
=-607.31 kJ/molCO(g)+O2(g)CO2(g)CH4(g)+ O2(g)提升应用CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ΔH1= -890.31 kJ/mol甲烷完全然烧与不完全燃烧的反应热对比 1 mol甲烷由于不完全燃烧损失热量283 kJ,热量损失率高达32%!提升应用 一般家庭用气量在25 m3/月左右,每个月由于燃料不完全燃烧而损失的热量相当于8 m3甲烷完全燃烧放出的热量!
若目前北京市天然气价格2.15元/米3,则每个家庭每年要为燃料不完全燃烧付多少钱?提升应用 通过本节课的学习,你掌握了哪些新知识?课堂小结1.根据下列信息写出石墨转化成金刚石的热化学方程式:
①C (s ,石墨)+O2(g)=CO2(g) △H1= -393.5 kJ/mol
② CO2(g) =C (s ,金刚石)+O2(g) △H2= +395.0 kJ/mol拓展练习C(s,金刚石)+O2(g)C(s,石墨)+O2(g)CO2(g)所以, ΔH3=ΔH1+ΔH2
ΔH3 = - 393.5 kJ/mol + 395.0 kJ/mol
= +1.5 kJ/molC(石墨,s)= C(金刚石,s) △H= +1.5 kJ/mol拓展练习谢谢大家!
第三节 化学反应热的计算
北京市东城区教师研修中心 周业虹
北京市24中 冯杰利ΔH3 =ΔH1 + ΔH2
= -110.5 kJ/mol +(- 283.0 kJ/mol)
= -393.5 kJ/mol 在学案资料卡片中查找石墨的燃烧热数据,验证这一结果是否正确 .-393.5 kJ/mol问 题 情 景CO(g) + O2(g) CO2 (g) △H3△H2△H1C(s,石墨) + O2(g)ΔH3=ΔH1+ΔH2C(s,石墨) + O2(g)=CO2(g) ΔH3= ?问 题 情 景ΔH3=ΔH1+ΔH2BACΔH1ΔH21.如何用文字表述盖斯定律?
2.如何从能量守恒角度论证盖斯定律的正确性?
3.盖斯定律在生产和科研中有何重要作用?思考与交流1.盖斯定律的内容 不管化学反应是一步完成或是分几步完成,其总反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
1.盖斯定律的内容请把下面生活实例与盖斯定律进行类比(1)登山类比盖斯定律坐缆车
或步行 S(始态) L(终态)△H1〈 0△H 2〉0△H1+ △H 2≡ 02.从能量守恒角度论证盖斯定律为什么 △H1+△H2≠0 ?思考与交流C (s ,石墨)+O2(g)==CO2(g) △H1= -393.5 kJ/mol
CO2(g) == C (s ,金刚石)+O2(g) △H2= +395.0 kJ/mol3. 盖斯定律的应用 盖斯定律可用来计算难以直接测定的化学反应的反应热,如反应慢、副反应多、反应不易直接发生等。提示:所需要数据可在学案资料卡片中查找如何利用盖斯定律设计适当的反应路径计算出来?提升应用ΔH1=ΔH3-ΔH2
=- 890.315 kJ/mol –(-283.0 kJ/mol)
=-607.31 kJ/molCO(g)+O2(g)CO2(g)CH4(g)+ O2(g)提升应用CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ΔH1= -890.31 kJ/mol甲烷完全然烧与不完全燃烧的反应热对比 1 mol甲烷由于不完全燃烧损失热量283 kJ,热量损失率高达32%!提升应用 一般家庭用气量在25 m3/月左右,每个月由于燃料不完全燃烧而损失的热量相当于8 m3甲烷完全燃烧放出的热量!
若目前北京市天然气价格2.15元/米3,则每个家庭每年要为燃料不完全燃烧付多少钱?提升应用 通过本节课的学习,你掌握了哪些新知识?课堂小结1.根据下列信息写出石墨转化成金刚石的热化学方程式:
①C (s ,石墨)+O2(g)=CO2(g) △H1= -393.5 kJ/mol
② CO2(g) =C (s ,金刚石)+O2(g) △H2= +395.0 kJ/mol拓展练习C(s,金刚石)+O2(g)C(s,石墨)+O2(g)CO2(g)所以, ΔH3=ΔH1+ΔH2
ΔH3 = - 393.5 kJ/mol + 395.0 kJ/mol
= +1.5 kJ/molC(石墨,s)= C(金刚石,s) △H= +1.5 kJ/mol拓展练习谢谢大家!
