相对原子质量和相对分子质量
图片预览








文档简介
课件24张PPT。第1节 化学式原子有质量吗?各种原子的质量一样大吗?你怎样测量原子质量的大小呢?一个碳原子的质量是:
一个铁原子的质量是:
0.00000000000000000000000009288千克即1.993×10-26千克即9.288×10-26千克0.00000000000000000000000001993千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克 一个氢原子的质量是:
0.000000000000000000000000001674千克
即1、674×10-27千克一个氢原子的质量:1.674×10-27千克
一个碳原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克问题:1、一个甲烷CH4分子和一个足球烯C60分子的质量分别是多少?
2、谈一谈计算过程中有什么体会?国际上规定:
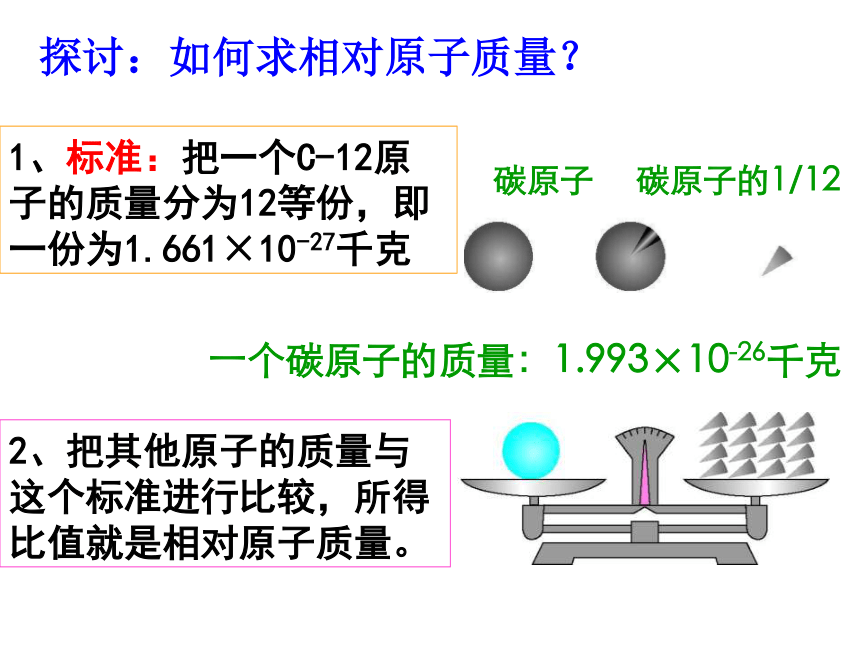
采用相对原子质量来表示原子的质量关系。 探讨:如何求相对原子质量?一个碳原子的质量:1.993×10-26千克1、标准:把一个C-12原子的质量分为12等份,即一份为1.661×10-27千克2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。一、相对原子质量1、以碳-12原子质量的1/12作为标准,其他原子的质量跟它相比所得的比值,就是该种原子的相对原子质量2、相对原子质量是比值,没有单位3、A原子相对质量=A原子的实际质量碳-12原子实际质量×1/12一个铁原子的质量是
9.288×10-26千克,
一个标准的碳原子的质量是
1.993×10-26千克,
计算铁的相对原子质量。练一练:答:铁的相对原子质量为56。2.657×10-26千克氧的相对原子质量= 氢的相对原子质量= 碳的相对原子质量= 1.661×10-27千克 1.674×10-27千克=161.661×10-27千克1.993×10-26千克=11.661×10-27千克=12练习求出氧、氢、碳的相对原子质量 相对原子质量与原子质量的比较 : 思考:1、相对原子质量最小的是什么原子?H2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?能,相对原子质量越大,原子的实际质量越大。3、相对原子质量与原子的实际质量相比,有什么优点?数值比较简单,便于书写、运算、记忆。1、已知一个碳-12原子的质量为m千克,另知A原子质量为n千克。则A原子的相对原子质量为多少?2、若以碳-12原子质量的1/2作为标准,则氧原子的相对原子质量为( )
A 16克 B 16 C 8 D 2.667D练习3、碳-12原子的质量为1.993×10-26kg,某原子的相对原子质量是80,则该原子的质量是______________kg。 1.33×10-254、下列原子各1克,
所含原子数最多的是( ) 所含原子数最少的是( ) A.氧原子 B.氢原子 C.碳原子 D.镁原子BD5、我们要用到某原子的相对质量,是否都需要进行计算? 从元素周期表(附录)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
H_________ C_________
O________ Mg__________练一练402735.51081121624质子、中子、电子的相对质量读表后有什么启发? 相对原子质量 = 质子数 + 中子数24171456总结1、相对原子质量即原子量2、相对原子质量求法相对原子质量 = 质子数 + 中子数A原子相对质量=A原子的实际质量碳-12原子实际质量×1/12式量:一个分子中各原子的
相对原子质量总和 二、式量原子质量可以用相对质量表示,分子质量也可以用相对分子质量即式量表示。求二氧化碳、硫酸的式量试一试:CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
1×2 + 32 + 16×4 = 98求式量步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和试一试:已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24 Cu—64
求出下列式量:
CH4_____ 3H2O_____ Ca(OH)2_____CO(NH2)2_____ (NH4)2SO4______5Mg(OH)2_____
CuSO4·5H2O__________练一练:
一个铁原子的质量是:
0.00000000000000000000000009288千克即1.993×10-26千克即9.288×10-26千克0.00000000000000000000000001993千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克 一个氢原子的质量是:
0.000000000000000000000000001674千克
即1、674×10-27千克一个氢原子的质量:1.674×10-27千克
一个碳原子的质量:1.993×10-26千克
一个氧原子的质量:2.657×10-26千克问题:1、一个甲烷CH4分子和一个足球烯C60分子的质量分别是多少?
2、谈一谈计算过程中有什么体会?国际上规定:
采用相对原子质量来表示原子的质量关系。 探讨:如何求相对原子质量?一个碳原子的质量:1.993×10-26千克1、标准:把一个C-12原子的质量分为12等份,即一份为1.661×10-27千克2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。一、相对原子质量1、以碳-12原子质量的1/12作为标准,其他原子的质量跟它相比所得的比值,就是该种原子的相对原子质量2、相对原子质量是比值,没有单位3、A原子相对质量=A原子的实际质量碳-12原子实际质量×1/12一个铁原子的质量是
9.288×10-26千克,
一个标准的碳原子的质量是
1.993×10-26千克,
计算铁的相对原子质量。练一练:答:铁的相对原子质量为56。2.657×10-26千克氧的相对原子质量= 氢的相对原子质量= 碳的相对原子质量= 1.661×10-27千克 1.674×10-27千克=161.661×10-27千克1.993×10-26千克=11.661×10-27千克=12练习求出氧、氢、碳的相对原子质量 相对原子质量与原子质量的比较 : 思考:1、相对原子质量最小的是什么原子?H2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?能,相对原子质量越大,原子的实际质量越大。3、相对原子质量与原子的实际质量相比,有什么优点?数值比较简单,便于书写、运算、记忆。1、已知一个碳-12原子的质量为m千克,另知A原子质量为n千克。则A原子的相对原子质量为多少?2、若以碳-12原子质量的1/2作为标准,则氧原子的相对原子质量为( )
A 16克 B 16 C 8 D 2.667D练习3、碳-12原子的质量为1.993×10-26kg,某原子的相对原子质量是80,则该原子的质量是______________kg。 1.33×10-254、下列原子各1克,
所含原子数最多的是( ) 所含原子数最少的是( ) A.氧原子 B.氢原子 C.碳原子 D.镁原子BD5、我们要用到某原子的相对质量,是否都需要进行计算? 从元素周期表(附录)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
H_________ C_________
O________ Mg__________练一练402735.51081121624质子、中子、电子的相对质量读表后有什么启发? 相对原子质量 = 质子数 + 中子数24171456总结1、相对原子质量即原子量2、相对原子质量求法相对原子质量 = 质子数 + 中子数A原子相对质量=A原子的实际质量碳-12原子实际质量×1/12式量:一个分子中各原子的
相对原子质量总和 二、式量原子质量可以用相对质量表示,分子质量也可以用相对分子质量即式量表示。求二氧化碳、硫酸的式量试一试:CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
1×2 + 32 + 16×4 = 98求式量步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和试一试:已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24 Cu—64
求出下列式量:
CH4_____ 3H2O_____ Ca(OH)2_____CO(NH2)2_____ (NH4)2SO4______5Mg(OH)2_____
CuSO4·5H2O__________练一练:
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
