2011届高考化学总复习课件(人教)系列 第八章 第2讲 原电池 化学电源
文档属性
| 名称 | 2011届高考化学总复习课件(人教)系列 第八章 第2讲 原电池 化学电源 | 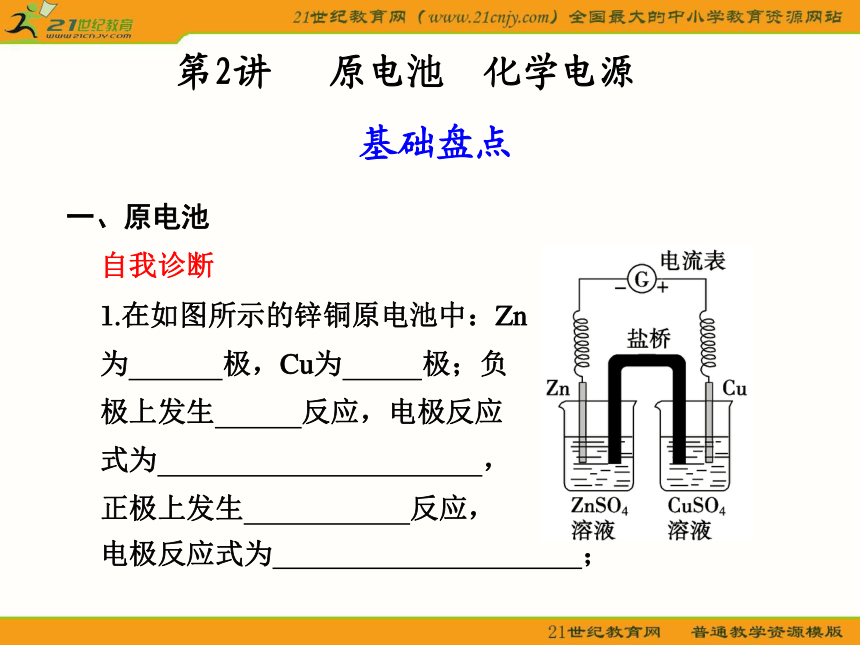 | |
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-28 12:15:00 | ||
图片预览








文档简介
课件100张PPT。一、原电池
自我诊断
1.在如图所示的锌铜原电池中:Zn
为 极,Cu为 极;负
极上发生 反应,电极反应
式为 ,
正极上发生 反应,
电极反应式为 ;基础盘点第2讲 原电池 化学电源 电子流出的极是 极,电子流入的极是_______ 极;电流方向 。
盐桥中的盐溶液是 溶液,其作用为
。
盐桥中的 会移向ZnSO4溶液, 移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性。该原电池工作一段时间后,两电极的质量将会 。
答案 负 正 氧化 Zn-2e- Zn2+ 还原Cu2++2e- Cu 负 正 沿导线从Cu极流向Zn极 饱和KCl 提供定向移动的阴、阳离子 Cl-
K+ Zn极减小,Cu极增加基础回归
1.概念
把 转化为 的装置。
2.构成条件
(1)能自发地发生 反应。
(2)电解质溶液(构成电路或参加反应)。
(3)由还原剂和导体构成 极系统,由氧化剂和导体构成 极系统。
(4)形成 (两电极接触或用导线连接)。化学能电能氧化还原负正闭合回路3.工作原理
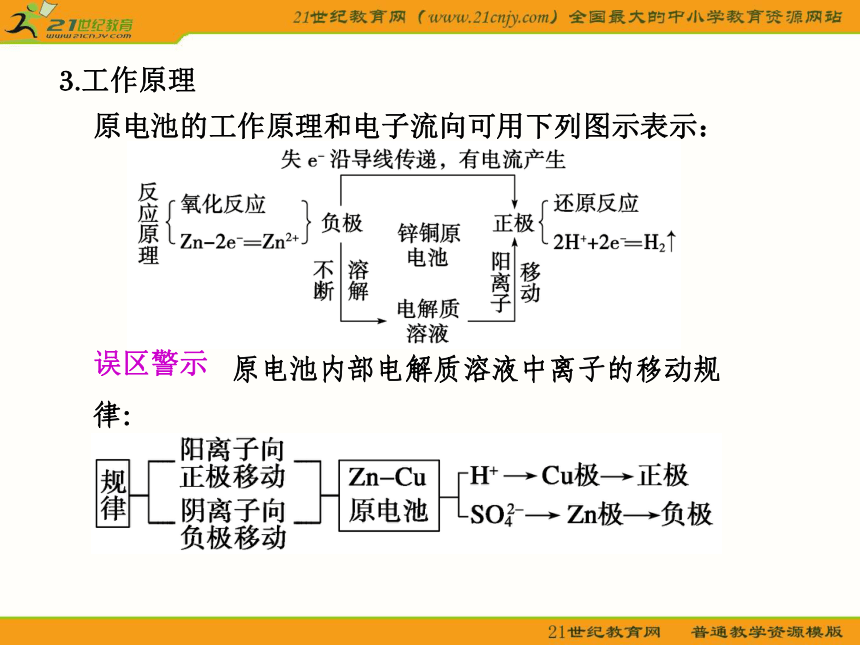
原电池的工作原理和电子流向可用下列图示表示:
原电池内部电解质溶液中离子的移动规律: 误区警示二、化学电源
自我诊断
2.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。根据上述情况判断:
(1)工作时,电解质溶液的pH (填“增大”、“减小”或“不变”)。
(2)工作时,电解质溶液中阴离子移向 极。
(3)电流方向从 极流向 极。
(4)写出负极的电极反应式: 。答案 (1)增大 (2)负 (3)正 负
(4)Pb+SO -2e- PbSO4
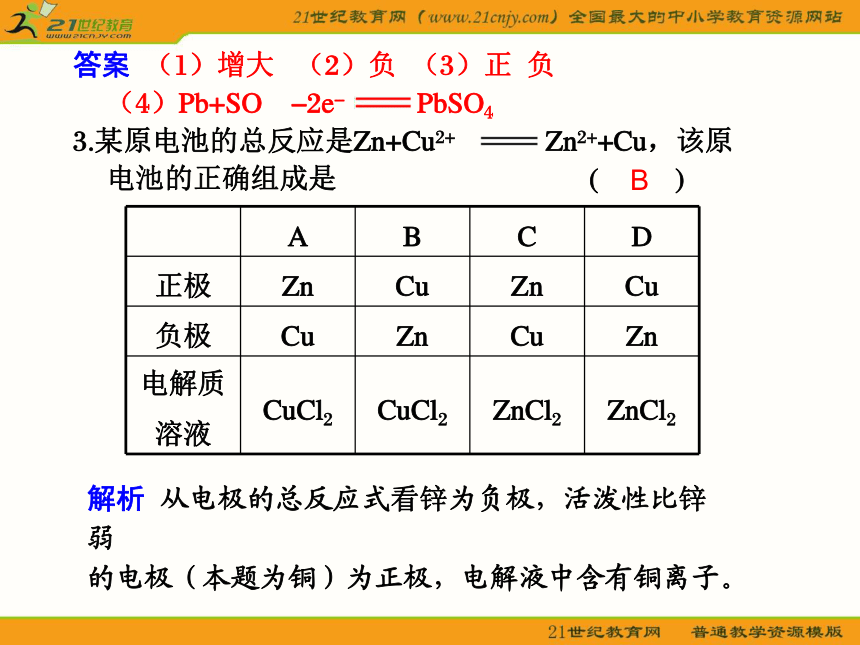
3.某原电池的总反应是Zn+Cu2+ Zn2++Cu,该原电池的正确组成是 ( )解析 从电极的总反应式看锌为负极,活泼性比锌弱
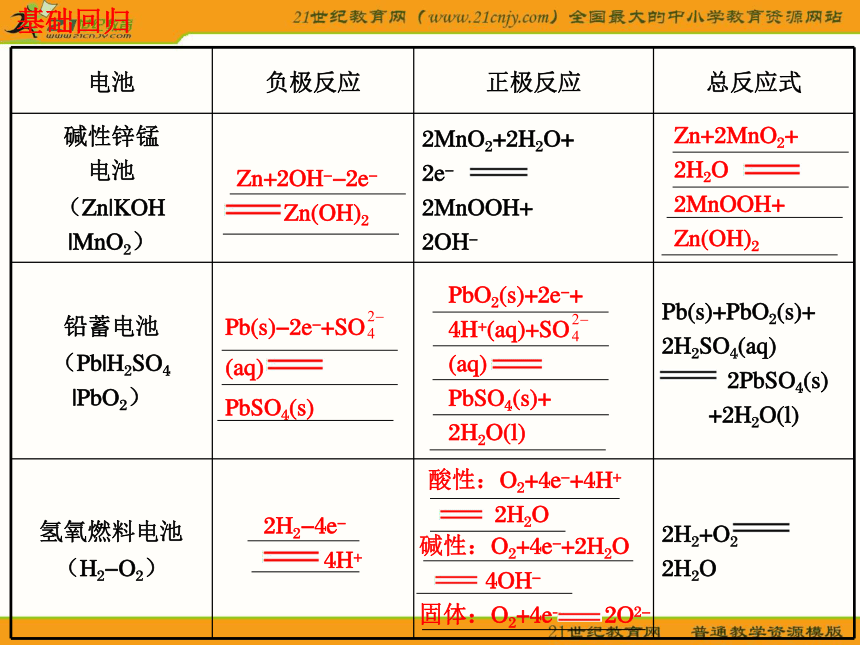
的电极(本题为铜)为正极,电解液中含有铜离子。B基础回归Zn+2OH--2e-
Zn(OH)2Zn+2MnO2+
2H2O
2MnOOH+
Zn(OH)2Pb(s)-2e-+SO
(aq)
PbSO4(s)PbO2(s)+2e-+
4H+(aq)+SO
(aq)
PbSO4(s)+
2H2O(l)2H2-4e-
4H+酸性:O2+4e-+4H+
2H2O碱性:O2+4e-+2H2O
4OH-
固体:O2+4e- 2O2-迷津指点
1.化学电源优劣的判断标准:单位质量或单位体积所能输出电能的多少,或输出功率的大小,电池的使用寿命的长短,以及对环境污染程度的大小。
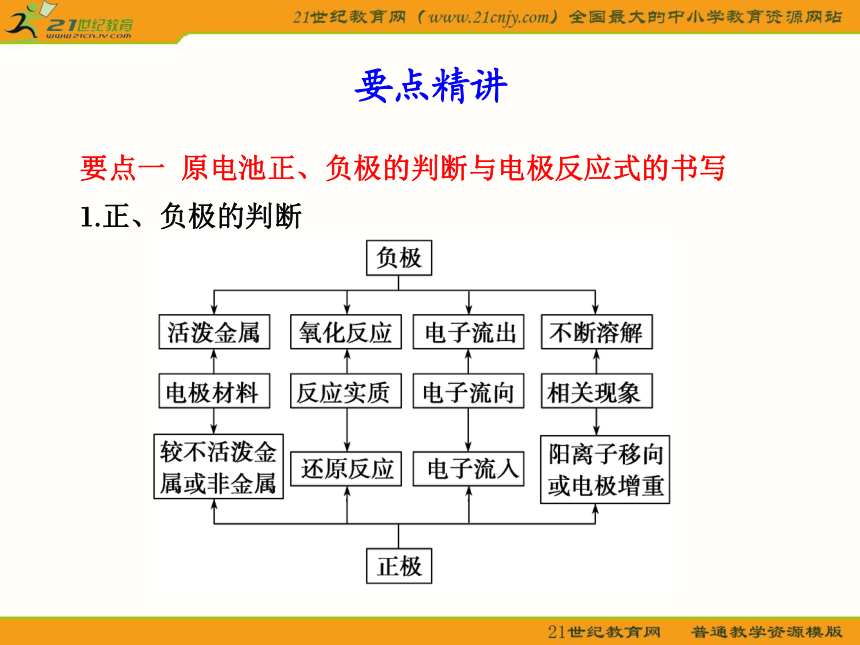
2.燃料电池和普通电池不同,必须使用辅助电极,电极本身不参与反应,所采用的燃料一般为H2、CH4、CH3OH等,助燃剂一般为O2(或空气)。要点一 原电池正、负极的判断与电极反应式的书写
1.正、负极的判断要点精讲特别提醒 ①原电池正、负极的判断基础是自发进行的氧化还原反应,如果给出一个方程式判断正、负极,可以直接根据化合价的升降来判断。发生氧化反应的一极为负极,发生还原反应的一极为正极。
②判断电极时,不能简单地依据金属的活泼性来判断,要看反应的具体情况,如:a.Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极;b.Fe、Al在浓HNO3中钝化后,比Cu等金属更难失电子,Cu等金属作负极,Fe、Al作正极。2.电极反应式的书写
(1)一般电极反应式的书写
按照负极发生氧化反应,正极发生还
原反应,判断出电极反应产物,找出
得失电子的数量。
电极产物在电解质溶液的环境中,应
能稳定存在,如碱性介质中生成的H+应
让其结合OH-生成水。
电极反应式要遵守电荷守恒和质量守恒、
电子守恒等加以配平。列物质
标得失看环境
配守恒两电极反应式相加,与总反应离子方程式对照验证。两式加
验总式(2)复杂电极反应式的书写:
= -
如CH4酸性燃料电池中,负极反应式为:
CH4+2O2 CO2+2H2O……总反应式
2O2+8H++8e- 4H2O……正极反应式
CH4+2H2O-8e- CO2+8H+……负极反应式复杂电极反应式总反应式较简单一极的
电极反应式特别提醒 原电池中正、负极的电极反应式作为一种
特殊的离子方程式,对于强、弱电解质的书写形式,没
有严格的规定,但必须遵循原子守恒和电荷守恒规律。【典例导析1】 镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是 ( )
A.此燃料电池的总反应为:Mg+H2O2
Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-
2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向正极移动 解析 由于电解质溶液中加入一定量的酸,Mg(OH)2
不能存在,电池总反应为:Mg+H2O2+2H+
Mg2++2H2O。负极反应为:Mg-2e- Mg2+;正极反
应为H2O2+2H++2e- 2H2O,消耗H+,工作时正极
周围海水pH增大,溶液中的H+向正极移动。
答案 A迁移应用1 一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是 ( )
A.在熔融电解质中,O2-移向负极
B.电池的总反应是:2C4H10+13O2
8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e-
2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10
+26e-+13O2- 4CO2↑+5H2O 解析 由原电池原理知阴离子移向负极,A正确;原电池反应就是一个氧化还原反应,只是氧化反应和还原反应分别在两极进行,由丁烷的燃烧反应知,该电池的总反应为:2C4H10+13O2 8CO2
+10H2O,且丁烷失电子,O2得电子,故选D。
答案 D迁移应用2 我国首创以铝-空气-海水电池作为能源
的新型海水标志灯,它以海水为电解质溶液,靠空
气中的氧气使铝不断氧化而产生电流。只要把灯放
入海水中数分钟,就会发出耀眼的白光。则;
(1)该电源负极材料为 ;正极材料为 。
(2)负极反应为 。
(3)正极反应为 。 解析 Al、O2(空气)之间的氧化还原反应为:4Al+3O2 2Al2O3,首先分析出该反应的还原
剂为Al,作负极;氧化剂为O2,可以用碳棒作
正极,完成O2得电子的反应,然后写出二者得
失电子的情况。负极:4Al-12e- 4Al3+;
正极:3O2+12e- 6O2-。而由于O2-离子半
径太小,会吸引H+而生成OH-。也就是6O2-+
6H2O 12OH-,把二者结合起来就得到正极
反应:3O2+6H2O+12e- 12OH-。答案 (1)铝 石墨 (2)4Al-12e- 4Al3+
(3)3O2+6H2O+12e- 12OH-要点二 原电池原理及其应用
1.原电池原理
利用氧化还原反应可将化学能转变为电能,具体如下:
负极失电子发
生氧化反应电子沿导线传递,从而产生电流
即化学能转化为电能正极得电子发
生还原反应2.原电池原理在化工、农业生产及科研中的应用
(1)加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反
应速率增大。例如,在Zn与稀H2SO4反应时加入少
量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作负极的金
属比作正极的金属活泼。
(3)用于金属的防护
使被保护的金属制品作原电池正极而得到保护。例
如,要保护一个铁质的输水管道或钢铁桥梁等,可
用导线将其与一块锌块相连,使锌作原电池的负极。 (4)设计制作化学电源
设计原电池时要紧扣原电池的构成条件。具体方法
是:
①首先将已知氧化还原反应拆分为两个半反应;
②根据原电池的电极反应特点,结合两个半反应找
出正负极材料及电解质溶液。
a.电极材料的选择
在原电池中,选择还原性较强的物质作为负极;氧
化性较强的物质作为正极。并且,原电池的电极必
须导电。电池中的负极必须能够与电解质溶液反应。 b.电解质溶液的选择
电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在锌—铜—硫酸构成的原电池中,负极金属锌浸泡在含有Zn2+的电解质溶液中,而正极金属铜浸泡在含有Cu2+的溶液中。③按要求画出原电池装置图。
如根据以下反应设计的原电池:碱性溶液特别提醒 应用原电池原理可以设计任一自发的氧化还原反应的电池,但有的电流相当微弱。同时要注意电解质溶液不一定参与反应,如燃料电池,水中一般要加入NaOH、H2SO4或Na2SO4等。【典例导析2】 依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是
; (2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。 解析 根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu应作负极,AgNO3溶液为电解质溶液,从而推知:
(1)X的材料为铜,Y是AgNO3溶液。 (2)银为原电池的正极,发生的电极反应式为Ag++e- Ag。X电极上发生的电极反应式为Cu-2e- Cu2+。
(3)外电路中的电子从X(负)电极流向银(正)电极。 答案 (1)铜(或Cu) AgNO3溶液
(2)正 Ag++e- Ag Cu-2e- Cu2+
(3)负(Cu) 正(Ag) 归纳总结 原电池原理的考查主要从三个方面考
查:一是外电路电子定向移动;二是电极上的氧化还原反应;三是溶液中离子运动,溶液中离子定向移动。迁移应用3 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是 ( ) A.铝罐将逐渐被腐蚀
B.炭粒和炭棒上发生的反应为O2+4e- 2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
解析 在原电池工作时,活泼金属铝作负极,电极反应式为:Al-3e- Al3+,炭棒作正极,电极反应式为O2+2H2O+4e- 4OH-,由此可知炭棒和炭粒的质量不会改变。由于炭棒作正极,因此应与玩具电机的正极相连。
答案 A迁移应用4 X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是 ( )
A.X>Z>W>Y B.Z>X>Y>W
C.X>Y>Z>W D.Y>W>Z>X 解析 在原电池中,活泼金属作为原电池的负极,失去电子发生氧化反应;不活泼的金属作为原电
池的正极,得到电子发生还原反应。电子由负极
经导线流向正极,与电流的方向相反,因此,X、
Y相连时,X为负极,则活泼性X>Y;Z、W相连
时,电流方向是W→Z,则活泼性Z>W;X、Z相
连时,Z极上产生大量气泡,则活泼性X>Z;W、
Y相连时,W极发生氧化反应,则W>Y。综上,
可以得出金属的活泼性顺序是X>Z>W>Y。答案
为A。
答案 A迁移应用5 利用反应Fe+CuSO4 FeSO4+Cu设计一个原电池,画出实验装置图,并指出:
(1)正极材料为 ,电极反应式为
;
(2)负极材料为 ,电极反应式为 ;
(3)电解质溶液为 。
解析 该反应中的氧化反应为:Fe-2e- Fe2+,还原反应为Cu2++2e- Cu。因此,Fe一定是负极,正极可选用Pt棒或C棒等惰性电极。选择含Cu2+的溶液作电解质溶液。
画实验装置图时要注意电极不可全部没入液面以下,以防有副反应发生。答案
实验装置图
(1)稳定金属或C Cu2++2e- Cu
(2)Fe Fe-2e- Fe2+
(3)CuSO4溶液对点训练题组一 原电池原理及其应用
1. 理论上不能用于设计成原电池的反应是( )
A.HCl+NaOH NaCl+H2O ΔH<0
B.2CH3OH(l)+3O2(g) 2CO2(g)
+4H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3(s)
ΔH<0
D.2H2(g)+O2(g) 2H2O(l) ΔH<0点燃 解析 本题考查原电池形成条件。只有能自发进行的氧化还原反应才可能用于设计原电池,非氧化还原反应因没有电子转移所以不能设计成原电池,题中只有A项不是氧化还原反应。
答案 A2. 有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为
燃料的用途之一就是用于制作燃料电池。有科技工作者
制造了一种甲烷燃料电池,一个电极通入空气,另一个
电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它
在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e- 2O2-
B.电池负极发生的反应:CH4+4O2--8e-
CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极
流向负极) 解析 因为放电时,电池正极发生还原反应(元素化合价降低),负极发生氧化反应(元素化合价升高)。所以正极反应式是O2+4e- 2O2-,负极反应式是CH4+4O2--8e- CO2+2H2O。由上述电池的正、负极反应式可以看出:正极反应“源源不断”地产生O2-,负极反应要持续进行,则需要“持续不断”的O2-供应,故电池内O2-的移动方向是由正极流向负极。电池的负极发生氧化反应,失去电子,故外电路电子从负极流出,所以D错误。
答案 D3.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
( ) 解析 a中加入CuSO4溶液,被置换出的铜覆盖在Zn的表面,形成原电池,产生H2的速率加快,反应所需时间缩短,但置换铜时消耗了一部分锌,故与稀硫酸反应的锌的质量减少,完全反应后生成的H2的量比b少,答案为A。
答案 A题组二 原电池正负极的判断与电极反应式的书写
4. 燃料电池的基本组成为电极、电解质、燃料和氧化
剂。此种电池的能量利用率可高达80%(一般柴油
发电机只有40%左右),产物污染也少。下列有关
燃料电池的说法错误的是 ( )
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇
等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该
电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH溶液,该电池
的负极反应为C2H5OH-12e- 2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-
4OH- 解析 氢气、甲烷、乙醇等在燃料电池中,发生的反应为氧化反应,故作为电池的负极。电解质为强碱KOH溶液,因此不可能生成二氧化碳,应该生成CO ,即负极反应为:C2H5OH-12e-+16OH-
2CO +11H2O,故C错误。
答案 C5.固体氧化物燃料电池是由美国西屋(Westinghouse)
公司研制开发的。它以固体氧化锆—氧化钇为电解
质,这种固体电解质在高温下允许氧离子(O2-)在
其间通过。该电池的工作原理如图所示,其中多孔
电极a、b均不参与电极反应。下列判断正确的是 ( ) A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-
4OH-
D.该电池的总反应方程式为:2H2+O2 2H2O 解析 H2在O2中燃烧的方程式为2H2+O2
2H2O,所以氢氧燃料电池的总方程式为2H2+O2
2H2O,D对;而O2为氧化剂,在正极反应,所以a极为正极,A错;因反应介质中没有水,所以正极反应式为O2+4e- 2O2-,C错;根据总反应写出负极反应式为2H2+2O2--4e- 2H2O;H2为可燃物,为负极反应物,B错。
答案 D点燃6.锌银电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn (OH)2 Ag2O+Zn+H2O
在此电池放电时,负极上发生反应的物质是
( )
A.Ag B.Zn(OH)2
C.Ag2O D.Zn
解析 充电是电解过程,放电是原电池反应。充电
放电D7.(1)将Al片和Cu片用导线相连,插入稀H2SO4中
组成原电池,写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
(2)若将Al片和Cu片用导线相连,插入浓HNO3中
能否组成原电池? (填“能”或“不能”),
若能组成原电池,写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。 解析 (1)Al片和Cu片用导线相连,插入稀H2SO4中时,Al比Cu活泼,Al为负极,失电子被氧化为
Al3+,Cu为正极,溶液中的H+得电子被还原为H2。
(2)Al片和Cu片用导线相连,插入浓HNO3中
时,由于铝钝化,不能溶解,Al为正极,Cu为负
极,失电子被氧化为Cu2+。答案 (1)负极 2Al-6e- 2Al3+
正极 6H++6e- 3H2↑
(2)能 正极 2NO +4H++2e- 2NO2↑+2H2O
负极 Cu-2e- Cu2+8. 燃料在电池中直接被氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式: ;并指出电解质溶液中,OH-向
哪极移动: 。 解析 肼燃料电池总反应为N2H4+O2 N2+2H2O,负极反应为:N2H4-4e-+4OH- N2↑+4H2O,正极反应为:O2+4e-+2H2O 4OH-。负极上消耗OH-,正极上产生OH-,故OH-向负极移动。答案 负极:N2H4-4e-+4OH- N2 ↑+4H2O,
正极:O2+4e-+2H2O 4OH-,
总反应式:N2H4+O2 N2+2H2O
OH-向负极移动9. 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展。
(1)目前市场上某些品牌笔记本电脑(如神舟电脑、IBM电脑等)的外壳一改以往的有机合成材料,而使用镁铝合金、钛铝合金等材料。镁铝合金材料在电脑上代替有机合成材料的目的是 。
(多选)
A.降低成本 B.增强美观 C.利于散热
D.增加强度 E.增加运算速度 (2)某学校研究性学习小组欲以镁条、铝片为电极,以稀NaOH溶液为电解质溶液设计原电池。
①给你一只安培表,请你画出该原电池的示意图,并标出正负极。
②一段时间后,铝片发生的电极反应式是
;
镁条表面只有极少量的气泡产生,则镁电极发生的主要反应的电极反应式为 。 解析 (1)铝合金材料比有机合成材料在价格上要高,所以A错;实际上铝合金材料在电脑外壳上的使用是从“增加强度”和“增强美观”的角度考虑的,当然铝合金作为电脑的外壳材料散热效果要比有机合成材料好的多;铝合金材料的
应用与电脑的运算速度没有关系。
(2)铝能够与NaOH溶液反应,
所以作为原电池的负极,而镁
与NaOH溶液不反应作正极。 答案 (1)BCD
(2)①如图所示 ②Al+4OH--3e- AlO
+2H2O 2H2O+2e- H2↑+2OH-一、选择题(本题包括12小题,每小题5分,共60分)
1.(2009·广东理基,34)下列有关电池的说法不正确的是 ( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向
锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极定时检测 解析 锂离子电池可以充电后再次使用,属于二次电池,A项正确;铜锌原电池中铜为正极,故外电路中电流为铜流向锌,而电子是由锌流向铜,B项错;电池的实质即是化学能转化成电能,C项正确;Zn失去电子生成Zn2+,故作为负极,D项正确。
答案 B2.(2009·福建理综,11)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原
电池。下列判断不正确的是 ( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙
中石墨电极为负极 解析 反应开始后,乙中石墨电极上发生的反应为
2I--2e- I2,为氧化反应,A说法正确;甲中石
墨电极上发生的反应为2Fe3++2e- 2Fe2+,Fe3+
被还原,B正确;电流计读数为零时,电极上得到
和失去的电子数相等,反应达到化学平衡状态,C
正确;电流计读数为零(反应达到化学平衡状态)
后,在甲中溶入FeCl2固体,则平衡向逆反应方向
移动,I2被还原,乙中的石墨电极为正极,D错误。
答案 D3.(2009·江苏,12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( ) A.该电池能够在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-
6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生
成标准状况下CO2气体 L 解析 高温下,微生物失活,A错误;B正确;放电过程中,H+移向正极区,C错误;葡萄糖燃料电池的总反应式为:C6H12O6+6O2 6CO2+6H2O,即
1 mol O2~1 mol CO2,每消耗1 mol O2,理论上生成标
准状况下CO2气体为22.4 L,D错误。
答案 B4.(2008·广东,5)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④ 解析 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、盐桥构成一个原电池,Cu作负极,Ag作正极,两极电极反应分别为:负极:Cu-2e- Cu2+,正极:2Ag++2e- 2Ag,盐桥起到了传导离子、形成闭合回路的作用,电子的流向是由负极流向正极,电流的方向和电子的流向相反,因此C正确。
答案 C5.(2008·宁夏理综,10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是 ( )
A.CH3OH(g)+O2(g)-2e- H2O(l)+CO2(g)
+2H+(aq)
B.O2(g)+4H+(aq)+4e- 2H2O(l)
C.CH3OH(g)+H2O(l)-6e- CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e- 4OH- 解析 甲醇燃料电池是甲醇在负极发生氧化反应,氧气在正极发生还原反应,故B、D错误;A项不是电极反应式。
答案 C6. X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
解析 X投入Z的硝酸盐溶液中,X的表面有Z析出,说明活泼性X>Z;X与Y组成原电池时,Y为电池的负极,说明Y>X,因此X、Y、Z三种金属的活泼性顺序为Y>X>Z。C7. 在如图所示的8个装置中,属于原电池的是 ( )
A.①④ B.③④⑤
C.④⑧ D.②④⑥⑦ 解析 根据原电池的构成条件可知:①中一个电
极,③中两电极材料相同,⑤中酒精不是电解质,
⑧中两电极材料相同且无闭合回路,故①③⑤⑧均不能构成原电池。
答案 D8. 在盛有稀硫酸的烧杯中放入导线连接的铜片和锌片,下列叙述正确的是 ( )
A.正极附近的SO 离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2放出
D.铜片上有H2放出
解析 形成原电池工作时,锌为负极,电子通过导线流向铜极,在铜极上H+放电生成H2逸出,B、C项错误;溶液中靠参与反应的离子的定向移动形成回路,电解质溶液中阴离子向负极移动,故正极附近的SO 浓度降低,A项错误。D9. 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是 ( )
A.锌片是负极
B.两个铜片上都发生氧化反应
C.石墨是阴极
D.两个番茄都形成原电池 解析 由于番茄汁显酸性,左侧番茄形成原电池,Zn作负极,右侧番茄形成电解池,Cu作阴极,故选项中只有A正确。
答案 A10.将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢 解析 因乙杯中锌片和铜片没有接触,故不能构成原电池,A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;又因两杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。
答案 C11.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4+10OH--8e- CO +7H2O;通入O2的另一极,其电极反应式是:2O2+4H2O+8e- OH-。下列叙述不正确的是
( )
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH 解析 在原电池中,负极上发生氧化反应,正极上发生还原反应,故B项错。
答案 B12.关于铅蓄电池的说法正确的是 ( )
A.在放电时,正极发生的反应是Pb(s)+SO
(aq)-2e- PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e- Pb(s)+SO (aq) 解析 A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO +2e- PbSO4+
2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生PbSO4+2H2O-2e-
PbO2+4H++SO 。
答案 B二、非选择题(本题包括4小题,共40分)
13.(8分)(2009·天津理综,10)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化
的主要形式是 ,在导线中
电子流动方向为 (用a、
b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是 。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
Ⅱ.LiH+H2O LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。 ②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
解析 (1)氢氧燃料电池是原电池装置,将化学能转化为电能,在燃料电池中通H2的一极发生了氧化反应为负极,所以电子流向为a→b。 (2)书写该原电池的电极反应式时要注意溶液的
酸碱性,KOH为电解质溶液时,负极反应为:H2+2OH--2e- 2H2O。
(3)由题干信息可知电极表面镀铂粉目的是为了
增强铂吸附气体的能力,可加快电极的反应速度。
(4)②
③Ⅰ中消耗H2 10 mol,则生成LiH为20 mol,则Ⅱ
中可生成H2 20 moL,20 mol H2用作燃料电池的负
极反应,则转移40 mol电子,若能量转化率为
80%,则转移32 mol电子。 答案 (1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e- 4H2O或H2+2OH--2e-
2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率 (4)①Li H2O ②1/1 148或8.71×10-4 ③3214.(12分)(2008·山东理综,29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC CH(g)+H2(g)
ΔH1=+156.6 kJ/mol
CH3CH CH2(g) CH4(g)+HC CH(g)
ΔH2=+32.4 kJ/mol
则相同条件下,反应C3H8(g) CH3CH CH2(g)+
H2(g)的ΔH= kJ/mol。 (2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;
放电时,CO 移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO +
H+的平衡常数K1= 。(已知:
10-5.60=2.5×10-6) (4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO )(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
解析 (1)由C3H8(g) CH4(g)+
HC≡CH(g)+H2(g) ΔH1=+156.6 kJ/mol ①
CH3CH=CH2(g) CH4(g)+HC≡CH(g)
ΔH=+32.4 kJ/mol ②
①-②可以得到
C3H8(g) CH3CH=CH2(g)+H2(g)
ΔH=ΔH1-ΔH2=156.6 kJ/mol-32.4 kJ/mol
=124.2 kJ/mol (2)电池反应为:C3H8+5O2 3CO2+4H2O
原电池负极失电子,正极得电子,电解质溶液中阴离子移向负极,阳离子移向正极。
(3)由H2CO3 H++HCO 得平衡常数
K1= 其pH=5.60
则c(H+)=2.5×10-6mol/L=c(HCO )
因此K1=
=4.2×10-7mol/Lc(H+)·c(HCO )
c(H2CO3)2.5×10-6×2.5×10-6(mol/L)2
1.5×10-5mol/L (4)由于NaHCO3溶液中HCO 的水解使pH大
于8,又因HCO 也存在电离,即存在两个平衡:
HCO +H2O OH-+H2CO3
HCO H++CO
由于c(H+) 因此c(H2CO3)>c(CO ),即HCO 的水解程度大于电离
程度。 答案 (1)+124.2
(2)C3H8+5O2 3CO2+4H2O 负
(3)4.2×10-7
(4)> HCO +H2O CO +H3O+(或HCO
CO +H+),HCO +H2O H2CO3
+OH-,HCO 的水解程度大于电离程度15.(8分)新型高能钠-硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS
Na2Sx。
(1)放电时Na发生 反应,S作 极。
(2)充电时Na所在电极与直流电源的 极相连。
(3)放电时负极反应为 ;
充电时阳极反应为 。放电
充电 (4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为 g。
解析 该题考查化学“两池”(原电池、电解池)的原理及应用,以新的科技成果即新型高能钠-硫电池为背景,要求考生学会应用原电池的原理解释新问题、新现象。主要考查对知识的应用能力、计算能力、推理能力等。 解答本题要仔细审题,寻找突破口——“电池放电时为原电池”,根据原电池的知识,失电子,发生氧化反应的电极是负极;得电子,发生还原反应的电极是正极。(1)Na作负极,S作正极。负极反应为Na-e- Na+;(2)“充电时为电解池”,根据电解的知识,阳极失电子,发生氧化反应;阴极得电子,发生还原反应。因此Na所在的电极是阴极,与直流电源的负极相连,S所在的电极是阳极,与直流电源的正极相连,阳极反应式为S -
2xe- xS。(4)电解饱和NaCl溶液阳极产生的气体是Cl2,由2Cl--2e- Cl2,又2Na-2e-
2Na+,可列式求得Na的质量为69克。 答案 (1)氧化 正 (2)负
(3)Na-e- Na+ S -2xe- xS
(4)6916.(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。 正极反应: ;
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤: 。 (4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式: ;
。
劣质不锈钢腐蚀的实验现象: 。解析 (1)该反应是FeCl3氧化金属铜,其离子方程
式为2Fe3++Cu 2Fe2++Cu2+。
(2)将(1)中反应设计成原电池必须是Cu作负极,
选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作
电解质溶液,装置图如右图:
正极:2Fe3++2e- 2Fe2+,
负极:Cu-2e- Cu2+。(3)根据表中给出的数据可知,把Cu2+中混有的Fe2+、
Fe3+除掉的方法是将Fe2+氧化成Fe3+,调节溶液的pH到
3.2~4.7,Fe3+以Fe(OH)3的形式沉淀,过滤除去。根据
除杂原则,去杂不能加杂,选择氧化剂为Cl2,并加入
CuO调节溶液的pH。
(4)根据题给条件,此不锈钢在盐溶液中腐蚀明
显,可选择的药品为CuO、浓硫酸,先用水稀释浓硫
酸,再用H2SO4与CuO反应生成CuSO4溶液,不锈钢
与CuSO4溶液反应在不锈钢的表面有紫红色的物质生
成,即可验证劣质不锈钢易被腐蚀。 答案 (1)2Fe3++Cu 2Fe2++Cu2+
(2)装置图
2Fe3++2e- 2Fe2+
Cu-2e- Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]
(4)CuO+H2SO4 CuSO4+H2O
CuSO4+Fe FeSO4+Cu
不锈钢表面有紫红色物质生成返回
自我诊断
1.在如图所示的锌铜原电池中:Zn
为 极,Cu为 极;负
极上发生 反应,电极反应
式为 ,
正极上发生 反应,
电极反应式为 ;基础盘点第2讲 原电池 化学电源 电子流出的极是 极,电子流入的极是_______ 极;电流方向 。
盐桥中的盐溶液是 溶液,其作用为
。
盐桥中的 会移向ZnSO4溶液, 移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性。该原电池工作一段时间后,两电极的质量将会 。
答案 负 正 氧化 Zn-2e- Zn2+ 还原Cu2++2e- Cu 负 正 沿导线从Cu极流向Zn极 饱和KCl 提供定向移动的阴、阳离子 Cl-
K+ Zn极减小,Cu极增加基础回归
1.概念
把 转化为 的装置。
2.构成条件
(1)能自发地发生 反应。
(2)电解质溶液(构成电路或参加反应)。
(3)由还原剂和导体构成 极系统,由氧化剂和导体构成 极系统。
(4)形成 (两电极接触或用导线连接)。化学能电能氧化还原负正闭合回路3.工作原理
原电池的工作原理和电子流向可用下列图示表示:
原电池内部电解质溶液中离子的移动规律: 误区警示二、化学电源
自我诊断
2.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。根据上述情况判断:
(1)工作时,电解质溶液的pH (填“增大”、“减小”或“不变”)。
(2)工作时,电解质溶液中阴离子移向 极。
(3)电流方向从 极流向 极。
(4)写出负极的电极反应式: 。答案 (1)增大 (2)负 (3)正 负
(4)Pb+SO -2e- PbSO4
3.某原电池的总反应是Zn+Cu2+ Zn2++Cu,该原电池的正确组成是 ( )解析 从电极的总反应式看锌为负极,活泼性比锌弱
的电极(本题为铜)为正极,电解液中含有铜离子。B基础回归Zn+2OH--2e-
Zn(OH)2Zn+2MnO2+
2H2O
2MnOOH+
Zn(OH)2Pb(s)-2e-+SO
(aq)
PbSO4(s)PbO2(s)+2e-+
4H+(aq)+SO
(aq)
PbSO4(s)+
2H2O(l)2H2-4e-
4H+酸性:O2+4e-+4H+
2H2O碱性:O2+4e-+2H2O
4OH-
固体:O2+4e- 2O2-迷津指点
1.化学电源优劣的判断标准:单位质量或单位体积所能输出电能的多少,或输出功率的大小,电池的使用寿命的长短,以及对环境污染程度的大小。
2.燃料电池和普通电池不同,必须使用辅助电极,电极本身不参与反应,所采用的燃料一般为H2、CH4、CH3OH等,助燃剂一般为O2(或空气)。要点一 原电池正、负极的判断与电极反应式的书写
1.正、负极的判断要点精讲特别提醒 ①原电池正、负极的判断基础是自发进行的氧化还原反应,如果给出一个方程式判断正、负极,可以直接根据化合价的升降来判断。发生氧化反应的一极为负极,发生还原反应的一极为正极。
②判断电极时,不能简单地依据金属的活泼性来判断,要看反应的具体情况,如:a.Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极;b.Fe、Al在浓HNO3中钝化后,比Cu等金属更难失电子,Cu等金属作负极,Fe、Al作正极。2.电极反应式的书写
(1)一般电极反应式的书写
按照负极发生氧化反应,正极发生还
原反应,判断出电极反应产物,找出
得失电子的数量。
电极产物在电解质溶液的环境中,应
能稳定存在,如碱性介质中生成的H+应
让其结合OH-生成水。
电极反应式要遵守电荷守恒和质量守恒、
电子守恒等加以配平。列物质
标得失看环境
配守恒两电极反应式相加,与总反应离子方程式对照验证。两式加
验总式(2)复杂电极反应式的书写:
= -
如CH4酸性燃料电池中,负极反应式为:
CH4+2O2 CO2+2H2O……总反应式
2O2+8H++8e- 4H2O……正极反应式
CH4+2H2O-8e- CO2+8H+……负极反应式复杂电极反应式总反应式较简单一极的
电极反应式特别提醒 原电池中正、负极的电极反应式作为一种
特殊的离子方程式,对于强、弱电解质的书写形式,没
有严格的规定,但必须遵循原子守恒和电荷守恒规律。【典例导析1】 镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是 ( )
A.此燃料电池的总反应为:Mg+H2O2
Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-
2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向正极移动 解析 由于电解质溶液中加入一定量的酸,Mg(OH)2
不能存在,电池总反应为:Mg+H2O2+2H+
Mg2++2H2O。负极反应为:Mg-2e- Mg2+;正极反
应为H2O2+2H++2e- 2H2O,消耗H+,工作时正极
周围海水pH增大,溶液中的H+向正极移动。
答案 A迁移应用1 一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是 ( )
A.在熔融电解质中,O2-移向负极
B.电池的总反应是:2C4H10+13O2
8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e-
2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10
+26e-+13O2- 4CO2↑+5H2O 解析 由原电池原理知阴离子移向负极,A正确;原电池反应就是一个氧化还原反应,只是氧化反应和还原反应分别在两极进行,由丁烷的燃烧反应知,该电池的总反应为:2C4H10+13O2 8CO2
+10H2O,且丁烷失电子,O2得电子,故选D。
答案 D迁移应用2 我国首创以铝-空气-海水电池作为能源
的新型海水标志灯,它以海水为电解质溶液,靠空
气中的氧气使铝不断氧化而产生电流。只要把灯放
入海水中数分钟,就会发出耀眼的白光。则;
(1)该电源负极材料为 ;正极材料为 。
(2)负极反应为 。
(3)正极反应为 。 解析 Al、O2(空气)之间的氧化还原反应为:4Al+3O2 2Al2O3,首先分析出该反应的还原
剂为Al,作负极;氧化剂为O2,可以用碳棒作
正极,完成O2得电子的反应,然后写出二者得
失电子的情况。负极:4Al-12e- 4Al3+;
正极:3O2+12e- 6O2-。而由于O2-离子半
径太小,会吸引H+而生成OH-。也就是6O2-+
6H2O 12OH-,把二者结合起来就得到正极
反应:3O2+6H2O+12e- 12OH-。答案 (1)铝 石墨 (2)4Al-12e- 4Al3+
(3)3O2+6H2O+12e- 12OH-要点二 原电池原理及其应用
1.原电池原理
利用氧化还原反应可将化学能转变为电能,具体如下:
负极失电子发
生氧化反应电子沿导线传递,从而产生电流
即化学能转化为电能正极得电子发
生还原反应2.原电池原理在化工、农业生产及科研中的应用
(1)加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反
应速率增大。例如,在Zn与稀H2SO4反应时加入少
量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作负极的金
属比作正极的金属活泼。
(3)用于金属的防护
使被保护的金属制品作原电池正极而得到保护。例
如,要保护一个铁质的输水管道或钢铁桥梁等,可
用导线将其与一块锌块相连,使锌作原电池的负极。 (4)设计制作化学电源
设计原电池时要紧扣原电池的构成条件。具体方法
是:
①首先将已知氧化还原反应拆分为两个半反应;
②根据原电池的电极反应特点,结合两个半反应找
出正负极材料及电解质溶液。
a.电极材料的选择
在原电池中,选择还原性较强的物质作为负极;氧
化性较强的物质作为正极。并且,原电池的电极必
须导电。电池中的负极必须能够与电解质溶液反应。 b.电解质溶液的选择
电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在锌—铜—硫酸构成的原电池中,负极金属锌浸泡在含有Zn2+的电解质溶液中,而正极金属铜浸泡在含有Cu2+的溶液中。③按要求画出原电池装置图。
如根据以下反应设计的原电池:碱性溶液特别提醒 应用原电池原理可以设计任一自发的氧化还原反应的电池,但有的电流相当微弱。同时要注意电解质溶液不一定参与反应,如燃料电池,水中一般要加入NaOH、H2SO4或Na2SO4等。【典例导析2】 依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是
; (2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。 解析 根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu应作负极,AgNO3溶液为电解质溶液,从而推知:
(1)X的材料为铜,Y是AgNO3溶液。 (2)银为原电池的正极,发生的电极反应式为Ag++e- Ag。X电极上发生的电极反应式为Cu-2e- Cu2+。
(3)外电路中的电子从X(负)电极流向银(正)电极。 答案 (1)铜(或Cu) AgNO3溶液
(2)正 Ag++e- Ag Cu-2e- Cu2+
(3)负(Cu) 正(Ag) 归纳总结 原电池原理的考查主要从三个方面考
查:一是外电路电子定向移动;二是电极上的氧化还原反应;三是溶液中离子运动,溶液中离子定向移动。迁移应用3 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是 ( ) A.铝罐将逐渐被腐蚀
B.炭粒和炭棒上发生的反应为O2+4e- 2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
解析 在原电池工作时,活泼金属铝作负极,电极反应式为:Al-3e- Al3+,炭棒作正极,电极反应式为O2+2H2O+4e- 4OH-,由此可知炭棒和炭粒的质量不会改变。由于炭棒作正极,因此应与玩具电机的正极相连。
答案 A迁移应用4 X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是 ( )
A.X>Z>W>Y B.Z>X>Y>W
C.X>Y>Z>W D.Y>W>Z>X 解析 在原电池中,活泼金属作为原电池的负极,失去电子发生氧化反应;不活泼的金属作为原电
池的正极,得到电子发生还原反应。电子由负极
经导线流向正极,与电流的方向相反,因此,X、
Y相连时,X为负极,则活泼性X>Y;Z、W相连
时,电流方向是W→Z,则活泼性Z>W;X、Z相
连时,Z极上产生大量气泡,则活泼性X>Z;W、
Y相连时,W极发生氧化反应,则W>Y。综上,
可以得出金属的活泼性顺序是X>Z>W>Y。答案
为A。
答案 A迁移应用5 利用反应Fe+CuSO4 FeSO4+Cu设计一个原电池,画出实验装置图,并指出:
(1)正极材料为 ,电极反应式为
;
(2)负极材料为 ,电极反应式为 ;
(3)电解质溶液为 。
解析 该反应中的氧化反应为:Fe-2e- Fe2+,还原反应为Cu2++2e- Cu。因此,Fe一定是负极,正极可选用Pt棒或C棒等惰性电极。选择含Cu2+的溶液作电解质溶液。
画实验装置图时要注意电极不可全部没入液面以下,以防有副反应发生。答案
实验装置图
(1)稳定金属或C Cu2++2e- Cu
(2)Fe Fe-2e- Fe2+
(3)CuSO4溶液对点训练题组一 原电池原理及其应用
1. 理论上不能用于设计成原电池的反应是( )
A.HCl+NaOH NaCl+H2O ΔH<0
B.2CH3OH(l)+3O2(g) 2CO2(g)
+4H2O(l) ΔH<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3(s)
ΔH<0
D.2H2(g)+O2(g) 2H2O(l) ΔH<0点燃 解析 本题考查原电池形成条件。只有能自发进行的氧化还原反应才可能用于设计原电池,非氧化还原反应因没有电子转移所以不能设计成原电池,题中只有A项不是氧化还原反应。
答案 A2. 有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为
燃料的用途之一就是用于制作燃料电池。有科技工作者
制造了一种甲烷燃料电池,一个电极通入空气,另一个
电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它
在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e- 2O2-
B.电池负极发生的反应:CH4+4O2--8e-
CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极
流向负极) 解析 因为放电时,电池正极发生还原反应(元素化合价降低),负极发生氧化反应(元素化合价升高)。所以正极反应式是O2+4e- 2O2-,负极反应式是CH4+4O2--8e- CO2+2H2O。由上述电池的正、负极反应式可以看出:正极反应“源源不断”地产生O2-,负极反应要持续进行,则需要“持续不断”的O2-供应,故电池内O2-的移动方向是由正极流向负极。电池的负极发生氧化反应,失去电子,故外电路电子从负极流出,所以D错误。
答案 D3.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
( ) 解析 a中加入CuSO4溶液,被置换出的铜覆盖在Zn的表面,形成原电池,产生H2的速率加快,反应所需时间缩短,但置换铜时消耗了一部分锌,故与稀硫酸反应的锌的质量减少,完全反应后生成的H2的量比b少,答案为A。
答案 A题组二 原电池正负极的判断与电极反应式的书写
4. 燃料电池的基本组成为电极、电解质、燃料和氧化
剂。此种电池的能量利用率可高达80%(一般柴油
发电机只有40%左右),产物污染也少。下列有关
燃料电池的说法错误的是 ( )
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇
等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该
电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH溶液,该电池
的负极反应为C2H5OH-12e- 2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-
4OH- 解析 氢气、甲烷、乙醇等在燃料电池中,发生的反应为氧化反应,故作为电池的负极。电解质为强碱KOH溶液,因此不可能生成二氧化碳,应该生成CO ,即负极反应为:C2H5OH-12e-+16OH-
2CO +11H2O,故C错误。
答案 C5.固体氧化物燃料电池是由美国西屋(Westinghouse)
公司研制开发的。它以固体氧化锆—氧化钇为电解
质,这种固体电解质在高温下允许氧离子(O2-)在
其间通过。该电池的工作原理如图所示,其中多孔
电极a、b均不参与电极反应。下列判断正确的是 ( ) A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-
4OH-
D.该电池的总反应方程式为:2H2+O2 2H2O 解析 H2在O2中燃烧的方程式为2H2+O2
2H2O,所以氢氧燃料电池的总方程式为2H2+O2
2H2O,D对;而O2为氧化剂,在正极反应,所以a极为正极,A错;因反应介质中没有水,所以正极反应式为O2+4e- 2O2-,C错;根据总反应写出负极反应式为2H2+2O2--4e- 2H2O;H2为可燃物,为负极反应物,B错。
答案 D点燃6.锌银电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn (OH)2 Ag2O+Zn+H2O
在此电池放电时,负极上发生反应的物质是
( )
A.Ag B.Zn(OH)2
C.Ag2O D.Zn
解析 充电是电解过程,放电是原电池反应。充电
放电D7.(1)将Al片和Cu片用导线相连,插入稀H2SO4中
组成原电池,写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
(2)若将Al片和Cu片用导线相连,插入浓HNO3中
能否组成原电池? (填“能”或“不能”),
若能组成原电池,写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。 解析 (1)Al片和Cu片用导线相连,插入稀H2SO4中时,Al比Cu活泼,Al为负极,失电子被氧化为
Al3+,Cu为正极,溶液中的H+得电子被还原为H2。
(2)Al片和Cu片用导线相连,插入浓HNO3中
时,由于铝钝化,不能溶解,Al为正极,Cu为负
极,失电子被氧化为Cu2+。答案 (1)负极 2Al-6e- 2Al3+
正极 6H++6e- 3H2↑
(2)能 正极 2NO +4H++2e- 2NO2↑+2H2O
负极 Cu-2e- Cu2+8. 燃料在电池中直接被氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式: ;并指出电解质溶液中,OH-向
哪极移动: 。 解析 肼燃料电池总反应为N2H4+O2 N2+2H2O,负极反应为:N2H4-4e-+4OH- N2↑+4H2O,正极反应为:O2+4e-+2H2O 4OH-。负极上消耗OH-,正极上产生OH-,故OH-向负极移动。答案 负极:N2H4-4e-+4OH- N2 ↑+4H2O,
正极:O2+4e-+2H2O 4OH-,
总反应式:N2H4+O2 N2+2H2O
OH-向负极移动9. 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展。
(1)目前市场上某些品牌笔记本电脑(如神舟电脑、IBM电脑等)的外壳一改以往的有机合成材料,而使用镁铝合金、钛铝合金等材料。镁铝合金材料在电脑上代替有机合成材料的目的是 。
(多选)
A.降低成本 B.增强美观 C.利于散热
D.增加强度 E.增加运算速度 (2)某学校研究性学习小组欲以镁条、铝片为电极,以稀NaOH溶液为电解质溶液设计原电池。
①给你一只安培表,请你画出该原电池的示意图,并标出正负极。
②一段时间后,铝片发生的电极反应式是
;
镁条表面只有极少量的气泡产生,则镁电极发生的主要反应的电极反应式为 。 解析 (1)铝合金材料比有机合成材料在价格上要高,所以A错;实际上铝合金材料在电脑外壳上的使用是从“增加强度”和“增强美观”的角度考虑的,当然铝合金作为电脑的外壳材料散热效果要比有机合成材料好的多;铝合金材料的
应用与电脑的运算速度没有关系。
(2)铝能够与NaOH溶液反应,
所以作为原电池的负极,而镁
与NaOH溶液不反应作正极。 答案 (1)BCD
(2)①如图所示 ②Al+4OH--3e- AlO
+2H2O 2H2O+2e- H2↑+2OH-一、选择题(本题包括12小题,每小题5分,共60分)
1.(2009·广东理基,34)下列有关电池的说法不正确的是 ( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向
锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极定时检测 解析 锂离子电池可以充电后再次使用,属于二次电池,A项正确;铜锌原电池中铜为正极,故外电路中电流为铜流向锌,而电子是由锌流向铜,B项错;电池的实质即是化学能转化成电能,C项正确;Zn失去电子生成Zn2+,故作为负极,D项正确。
答案 B2.(2009·福建理综,11)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原
电池。下列判断不正确的是 ( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙
中石墨电极为负极 解析 反应开始后,乙中石墨电极上发生的反应为
2I--2e- I2,为氧化反应,A说法正确;甲中石
墨电极上发生的反应为2Fe3++2e- 2Fe2+,Fe3+
被还原,B正确;电流计读数为零时,电极上得到
和失去的电子数相等,反应达到化学平衡状态,C
正确;电流计读数为零(反应达到化学平衡状态)
后,在甲中溶入FeCl2固体,则平衡向逆反应方向
移动,I2被还原,乙中的石墨电极为正极,D错误。
答案 D3.(2009·江苏,12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( ) A.该电池能够在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-
6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生
成标准状况下CO2气体 L 解析 高温下,微生物失活,A错误;B正确;放电过程中,H+移向正极区,C错误;葡萄糖燃料电池的总反应式为:C6H12O6+6O2 6CO2+6H2O,即
1 mol O2~1 mol CO2,每消耗1 mol O2,理论上生成标
准状况下CO2气体为22.4 L,D错误。
答案 B4.(2008·广东,5)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④ 解析 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、盐桥构成一个原电池,Cu作负极,Ag作正极,两极电极反应分别为:负极:Cu-2e- Cu2+,正极:2Ag++2e- 2Ag,盐桥起到了传导离子、形成闭合回路的作用,电子的流向是由负极流向正极,电流的方向和电子的流向相反,因此C正确。
答案 C5.(2008·宁夏理综,10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是 ( )
A.CH3OH(g)+O2(g)-2e- H2O(l)+CO2(g)
+2H+(aq)
B.O2(g)+4H+(aq)+4e- 2H2O(l)
C.CH3OH(g)+H2O(l)-6e- CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e- 4OH- 解析 甲醇燃料电池是甲醇在负极发生氧化反应,氧气在正极发生还原反应,故B、D错误;A项不是电极反应式。
答案 C6. X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
解析 X投入Z的硝酸盐溶液中,X的表面有Z析出,说明活泼性X>Z;X与Y组成原电池时,Y为电池的负极,说明Y>X,因此X、Y、Z三种金属的活泼性顺序为Y>X>Z。C7. 在如图所示的8个装置中,属于原电池的是 ( )
A.①④ B.③④⑤
C.④⑧ D.②④⑥⑦ 解析 根据原电池的构成条件可知:①中一个电
极,③中两电极材料相同,⑤中酒精不是电解质,
⑧中两电极材料相同且无闭合回路,故①③⑤⑧均不能构成原电池。
答案 D8. 在盛有稀硫酸的烧杯中放入导线连接的铜片和锌片,下列叙述正确的是 ( )
A.正极附近的SO 离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2放出
D.铜片上有H2放出
解析 形成原电池工作时,锌为负极,电子通过导线流向铜极,在铜极上H+放电生成H2逸出,B、C项错误;溶液中靠参与反应的离子的定向移动形成回路,电解质溶液中阴离子向负极移动,故正极附近的SO 浓度降低,A项错误。D9. 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是 ( )
A.锌片是负极
B.两个铜片上都发生氧化反应
C.石墨是阴极
D.两个番茄都形成原电池 解析 由于番茄汁显酸性,左侧番茄形成原电池,Zn作负极,右侧番茄形成电解池,Cu作阴极,故选项中只有A正确。
答案 A10.将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢 解析 因乙杯中锌片和铜片没有接触,故不能构成原电池,A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;又因两杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。
答案 C11.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4+10OH--8e- CO +7H2O;通入O2的另一极,其电极反应式是:2O2+4H2O+8e- OH-。下列叙述不正确的是
( )
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH 解析 在原电池中,负极上发生氧化反应,正极上发生还原反应,故B项错。
答案 B12.关于铅蓄电池的说法正确的是 ( )
A.在放电时,正极发生的反应是Pb(s)+SO
(aq)-2e- PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e- Pb(s)+SO (aq) 解析 A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO +2e- PbSO4+
2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生PbSO4+2H2O-2e-
PbO2+4H++SO 。
答案 B二、非选择题(本题包括4小题,共40分)
13.(8分)(2009·天津理综,10)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化
的主要形式是 ,在导线中
电子流动方向为 (用a、
b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是 。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
Ⅱ.LiH+H2O LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。 ②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
解析 (1)氢氧燃料电池是原电池装置,将化学能转化为电能,在燃料电池中通H2的一极发生了氧化反应为负极,所以电子流向为a→b。 (2)书写该原电池的电极反应式时要注意溶液的
酸碱性,KOH为电解质溶液时,负极反应为:H2+2OH--2e- 2H2O。
(3)由题干信息可知电极表面镀铂粉目的是为了
增强铂吸附气体的能力,可加快电极的反应速度。
(4)②
③Ⅰ中消耗H2 10 mol,则生成LiH为20 mol,则Ⅱ
中可生成H2 20 moL,20 mol H2用作燃料电池的负
极反应,则转移40 mol电子,若能量转化率为
80%,则转移32 mol电子。 答案 (1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e- 4H2O或H2+2OH--2e-
2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率 (4)①Li H2O ②1/1 148或8.71×10-4 ③3214.(12分)(2008·山东理综,29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC CH(g)+H2(g)
ΔH1=+156.6 kJ/mol
CH3CH CH2(g) CH4(g)+HC CH(g)
ΔH2=+32.4 kJ/mol
则相同条件下,反应C3H8(g) CH3CH CH2(g)+
H2(g)的ΔH= kJ/mol。 (2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;
放电时,CO 移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO +
H+的平衡常数K1= 。(已知:
10-5.60=2.5×10-6) (4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO )(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
解析 (1)由C3H8(g) CH4(g)+
HC≡CH(g)+H2(g) ΔH1=+156.6 kJ/mol ①
CH3CH=CH2(g) CH4(g)+HC≡CH(g)
ΔH=+32.4 kJ/mol ②
①-②可以得到
C3H8(g) CH3CH=CH2(g)+H2(g)
ΔH=ΔH1-ΔH2=156.6 kJ/mol-32.4 kJ/mol
=124.2 kJ/mol (2)电池反应为:C3H8+5O2 3CO2+4H2O
原电池负极失电子,正极得电子,电解质溶液中阴离子移向负极,阳离子移向正极。
(3)由H2CO3 H++HCO 得平衡常数
K1= 其pH=5.60
则c(H+)=2.5×10-6mol/L=c(HCO )
因此K1=
=4.2×10-7mol/Lc(H+)·c(HCO )
c(H2CO3)2.5×10-6×2.5×10-6(mol/L)2
1.5×10-5mol/L (4)由于NaHCO3溶液中HCO 的水解使pH大
于8,又因HCO 也存在电离,即存在两个平衡:
HCO +H2O OH-+H2CO3
HCO H++CO
由于c(H+)
程度。 答案 (1)+124.2
(2)C3H8+5O2 3CO2+4H2O 负
(3)4.2×10-7
(4)> HCO +H2O CO +H3O+(或HCO
CO +H+),HCO +H2O H2CO3
+OH-,HCO 的水解程度大于电离程度15.(8分)新型高能钠-硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS
Na2Sx。
(1)放电时Na发生 反应,S作 极。
(2)充电时Na所在电极与直流电源的 极相连。
(3)放电时负极反应为 ;
充电时阳极反应为 。放电
充电 (4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为 g。
解析 该题考查化学“两池”(原电池、电解池)的原理及应用,以新的科技成果即新型高能钠-硫电池为背景,要求考生学会应用原电池的原理解释新问题、新现象。主要考查对知识的应用能力、计算能力、推理能力等。 解答本题要仔细审题,寻找突破口——“电池放电时为原电池”,根据原电池的知识,失电子,发生氧化反应的电极是负极;得电子,发生还原反应的电极是正极。(1)Na作负极,S作正极。负极反应为Na-e- Na+;(2)“充电时为电解池”,根据电解的知识,阳极失电子,发生氧化反应;阴极得电子,发生还原反应。因此Na所在的电极是阴极,与直流电源的负极相连,S所在的电极是阳极,与直流电源的正极相连,阳极反应式为S -
2xe- xS。(4)电解饱和NaCl溶液阳极产生的气体是Cl2,由2Cl--2e- Cl2,又2Na-2e-
2Na+,可列式求得Na的质量为69克。 答案 (1)氧化 正 (2)负
(3)Na-e- Na+ S -2xe- xS
(4)6916.(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。 正极反应: ;
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤: 。 (4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式: ;
。
劣质不锈钢腐蚀的实验现象: 。解析 (1)该反应是FeCl3氧化金属铜,其离子方程
式为2Fe3++Cu 2Fe2++Cu2+。
(2)将(1)中反应设计成原电池必须是Cu作负极,
选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作
电解质溶液,装置图如右图:
正极:2Fe3++2e- 2Fe2+,
负极:Cu-2e- Cu2+。(3)根据表中给出的数据可知,把Cu2+中混有的Fe2+、
Fe3+除掉的方法是将Fe2+氧化成Fe3+,调节溶液的pH到
3.2~4.7,Fe3+以Fe(OH)3的形式沉淀,过滤除去。根据
除杂原则,去杂不能加杂,选择氧化剂为Cl2,并加入
CuO调节溶液的pH。
(4)根据题给条件,此不锈钢在盐溶液中腐蚀明
显,可选择的药品为CuO、浓硫酸,先用水稀释浓硫
酸,再用H2SO4与CuO反应生成CuSO4溶液,不锈钢
与CuSO4溶液反应在不锈钢的表面有紫红色的物质生
成,即可验证劣质不锈钢易被腐蚀。 答案 (1)2Fe3++Cu 2Fe2++Cu2+
(2)装置图
2Fe3++2e- 2Fe2+
Cu-2e- Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]
(4)CuO+H2SO4 CuSO4+H2O
CuSO4+Fe FeSO4+Cu
不锈钢表面有紫红色物质生成返回
