2011届高考化学总复习课件(人教)系列 第八章 实验探究 电化学原理在实验中的应用
文档属性
| 名称 | 2011届高考化学总复习课件(人教)系列 第八章 实验探究 电化学原理在实验中的应用 |  | |
| 格式 | rar | ||
| 文件大小 | 315.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-09-28 12:15:00 | ||
图片预览





文档简介
课件14张PPT。 电化学原理在生产、生活中的应用非常广泛,在化学实验中的作用亦不可低估。如改变反应速率、制备通常方法难以制备的物质等很多方面,现分别列举如下:
应用一 加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率增大。如实验室制H2时,在Zn与稀H2SO4反应时加入少量CuSO4溶液,就能使产生H2的反应速率加快。实验探究电化学原理在实验中的应用 应用二 比较金属活动性的强弱
两种金属分别做原电池的两极时,一般作负极的金属比作正极的金属活泼。
应用三 制备通常方法难以制备的物质
电解是最强有力的氧化还原手段,可以制备F2等氧化性很强的物质,也可以制备Na、Mg、Al等还原性很强的物质等。
应用四 利用有关量的关系进行某些测量或测定
可以利用电子与物质间的关系测元素的相对原子质量、阿伏加德罗常数等。【实验探究1】用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L O2(标准状况),则可知M的原子量为 ( ) 解析 本题意在考查学生对电解原理的理解,并以
电解原理为素材,考查学生思维的敏捷性。
由题干可知,在用惰性电极电解硝酸盐溶液时,两
极发生的反应是:阳极:4OH--4e- 2H2O+O2↑
阴极:Mx++xe- M
已知阳极上有b L氧气(标准状况)生成,其物质的量为 mol,从阳极反应来看,应有 mol电子转移,因为在阴极上也应有同样物质的量的电子转移,设
Ar(M)为M的相对原子质量,则
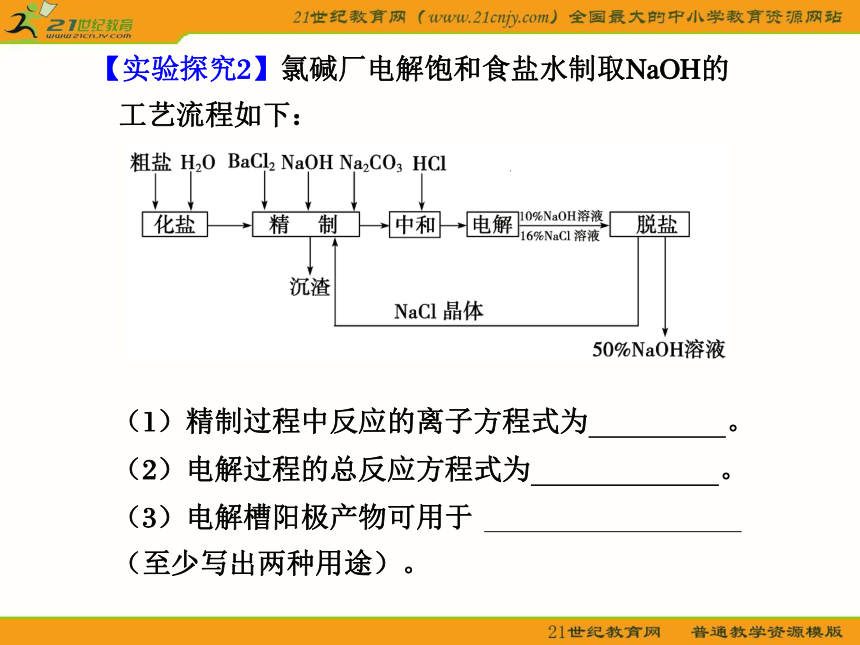
答案 C【实验探究2】氯碱厂电解饱和食盐水制取NaOH的
工艺流程如下:
(1)精制过程中反应的离子方程式为 。
(2)电解过程的总反应方程式为 。
(3)电解槽阳极产物可用于
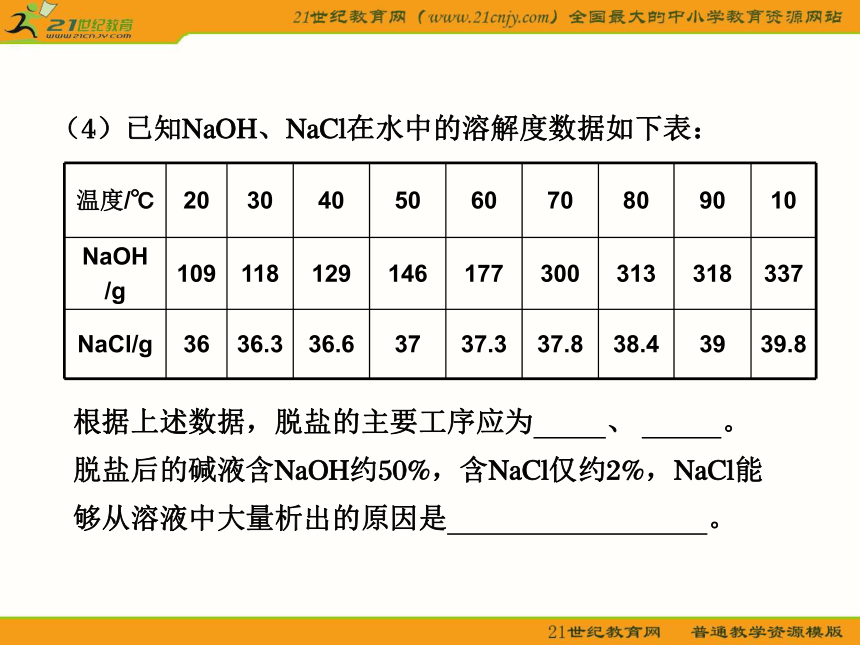
(至少写出两种用途)。(4)已知NaOH、NaCl在水中的溶解度数据如下表:根据上述数据,脱盐的主要工序应为 、 。
脱盐后的碱液含NaOH约50%,含NaCl仅约2%,NaCl能
够从溶液中大量析出的原因是 。答案 (1)Ba2++SO BaSO4↓,
Mg2++2OH- Mg(OH)2↓,
Ca2++CO CaCO3↓,Ba2++CO BaCO3↓
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、
合成塑料等(任选两种)
(4)蒸发浓缩 过滤 蒸发过程中溶剂(水)大量减
少,Na+浓度显著增大促进NaCl的沉淀溶解平衡向沉
淀方向移动(或:Na+浓度显著增大抑制了NaCl的溶
解)电解【实验探究3】 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。正极反应式: ;
负极反应式: 。
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验
证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不
能雷同): ,
用离子方程式表示其反应原理: 。 解析 比较或验证金属活动性方案有很多,可以利用金属与酸反应的难易来判断或验证;也可以利用原电池原理,负极是较活泼的金属;也可以利用金属单质间的置换反应来完成。
答案 方案Ⅰ:Fe+2H+ Fe2++H2↑
方案Ⅱ:
2H++2e- H2↑
Fe-2e- Fe2+
方案Ⅲ:把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质
Fe+Cu2+ Cu+Fe2+【实验探究4】 (1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②若已知电子电荷为1.60×10-19 C,通过导线的电量为3.85×104 C,试计算阿伏加德罗常数NA。解析 (1)锌片与银片和稀硫酸构成原电池,锌片为
负极,发生氧化反应:Zn-2e- Zn2+;银片为正极,
发生还原反应:2H++2e- H2 。
(2)①锌片与银片减少的质量等于生成氢气所消耗
的锌的质量,设产生的氢气体积为x。
Zn+2H+ Zn2++H2↑
65 g 22.4 L
60 g-47 g=13 g x
x=13 g×22.4 L÷65 g=4.48 L
②反应消耗的锌为:13 g÷65 g/mol=0.20 mol
1 mol Zn变为Zn2+时,转移2 mol e-,则通过的电量可
表示为:0.20 mol×2×NA×1.60×10-19 C=3.85×104 C
解之得:NA=6.02×1023 mol-1。
答案 (1)Zn-2e- Zn2+ 2H++2e- H2↑
(2)①4.48 L ②6.02×1023 mol-1返回
应用一 加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率增大。如实验室制H2时,在Zn与稀H2SO4反应时加入少量CuSO4溶液,就能使产生H2的反应速率加快。实验探究电化学原理在实验中的应用 应用二 比较金属活动性的强弱
两种金属分别做原电池的两极时,一般作负极的金属比作正极的金属活泼。
应用三 制备通常方法难以制备的物质
电解是最强有力的氧化还原手段,可以制备F2等氧化性很强的物质,也可以制备Na、Mg、Al等还原性很强的物质等。
应用四 利用有关量的关系进行某些测量或测定
可以利用电子与物质间的关系测元素的相对原子质量、阿伏加德罗常数等。【实验探究1】用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L O2(标准状况),则可知M的原子量为 ( ) 解析 本题意在考查学生对电解原理的理解,并以
电解原理为素材,考查学生思维的敏捷性。
由题干可知,在用惰性电极电解硝酸盐溶液时,两
极发生的反应是:阳极:4OH--4e- 2H2O+O2↑
阴极:Mx++xe- M
已知阳极上有b L氧气(标准状况)生成,其物质的量为 mol,从阳极反应来看,应有 mol电子转移,因为在阴极上也应有同样物质的量的电子转移,设
Ar(M)为M的相对原子质量,则
答案 C【实验探究2】氯碱厂电解饱和食盐水制取NaOH的
工艺流程如下:
(1)精制过程中反应的离子方程式为 。
(2)电解过程的总反应方程式为 。
(3)电解槽阳极产物可用于
(至少写出两种用途)。(4)已知NaOH、NaCl在水中的溶解度数据如下表:根据上述数据,脱盐的主要工序应为 、 。
脱盐后的碱液含NaOH约50%,含NaCl仅约2%,NaCl能
够从溶液中大量析出的原因是 。答案 (1)Ba2++SO BaSO4↓,
Mg2++2OH- Mg(OH)2↓,
Ca2++CO CaCO3↓,Ba2++CO BaCO3↓
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、
合成塑料等(任选两种)
(4)蒸发浓缩 过滤 蒸发过程中溶剂(水)大量减
少,Na+浓度显著增大促进NaCl的沉淀溶解平衡向沉
淀方向移动(或:Na+浓度显著增大抑制了NaCl的溶
解)电解【实验探究3】 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。正极反应式: ;
负极反应式: 。
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验
证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不
能雷同): ,
用离子方程式表示其反应原理: 。 解析 比较或验证金属活动性方案有很多,可以利用金属与酸反应的难易来判断或验证;也可以利用原电池原理,负极是较活泼的金属;也可以利用金属单质间的置换反应来完成。
答案 方案Ⅰ:Fe+2H+ Fe2++H2↑
方案Ⅱ:
2H++2e- H2↑
Fe-2e- Fe2+
方案Ⅲ:把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质
Fe+Cu2+ Cu+Fe2+【实验探究4】 (1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②若已知电子电荷为1.60×10-19 C,通过导线的电量为3.85×104 C,试计算阿伏加德罗常数NA。解析 (1)锌片与银片和稀硫酸构成原电池,锌片为
负极,发生氧化反应:Zn-2e- Zn2+;银片为正极,
发生还原反应:2H++2e- H2 。
(2)①锌片与银片减少的质量等于生成氢气所消耗
的锌的质量,设产生的氢气体积为x。
Zn+2H+ Zn2++H2↑
65 g 22.4 L
60 g-47 g=13 g x
x=13 g×22.4 L÷65 g=4.48 L
②反应消耗的锌为:13 g÷65 g/mol=0.20 mol
1 mol Zn变为Zn2+时,转移2 mol e-,则通过的电量可
表示为:0.20 mol×2×NA×1.60×10-19 C=3.85×104 C
解之得:NA=6.02×1023 mol-1。
答案 (1)Zn-2e- Zn2+ 2H++2e- H2↑
(2)①4.48 L ②6.02×1023 mol-1返回
