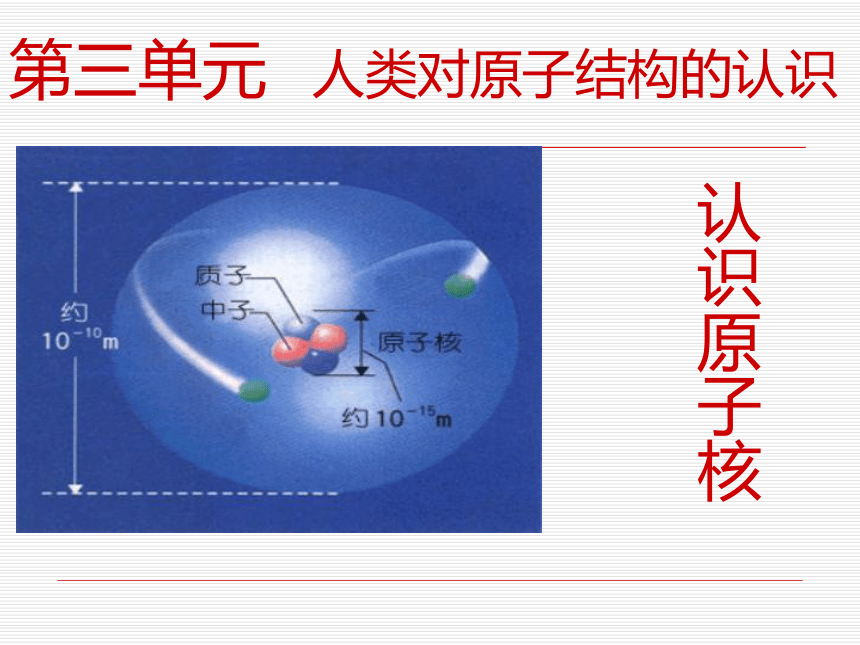
认识原子核
图片预览



文档简介
课件24张PPT。第三单元 人类对原子结构的认识认识原子核阅读教材P30,思考下列问题1.原子是构成物质的一种微粒,原子
是否可以再分?如果原子可以再分,
它是有哪些更小的微粒构成的呢?
2.相对原子的质量定义为“某原子的
质量与12C原子质量的1/12的比。
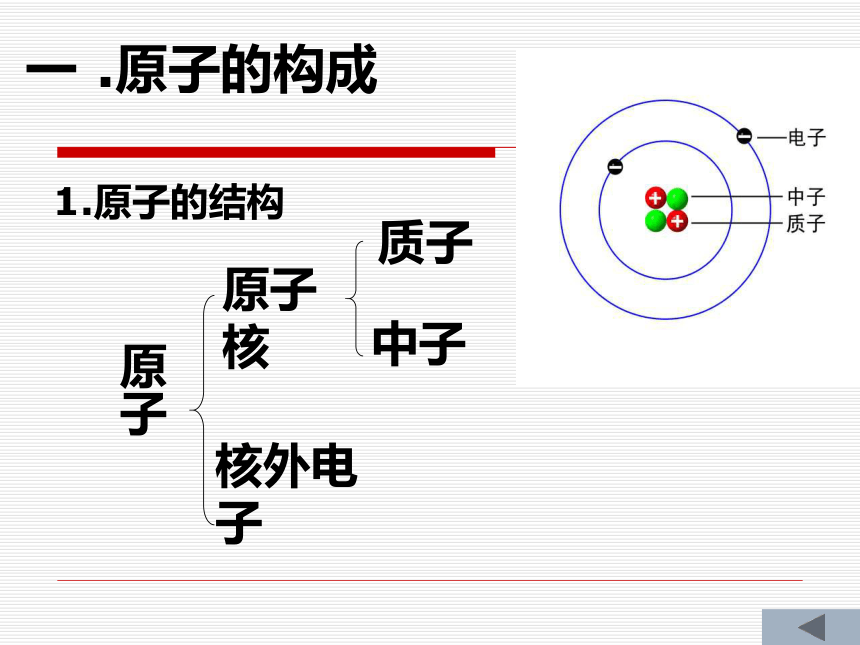
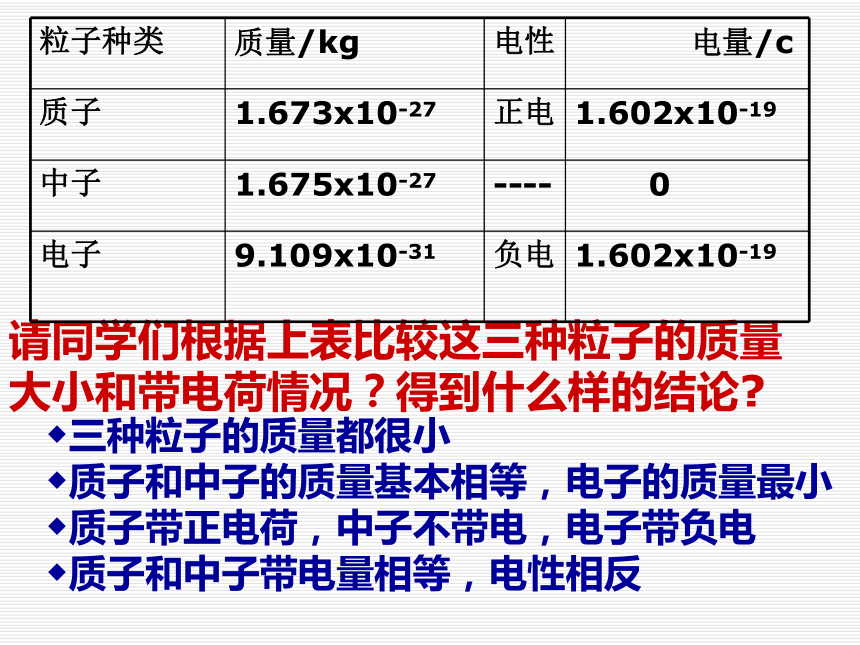
12C原子指的是什么原子?原子原子核核外电子质子中子一 .原子的构成1.原子的结构请同学们根据上表比较这三种粒子的质量大小和带电荷情况?得到什么样的结论?◆三种粒子的质量都很小
◆质子和中子的质量基本相等,电子的质量最小
◆质子带正电荷,中子不带电,电子带负电
◆质子和中子带电量相等,电性相反
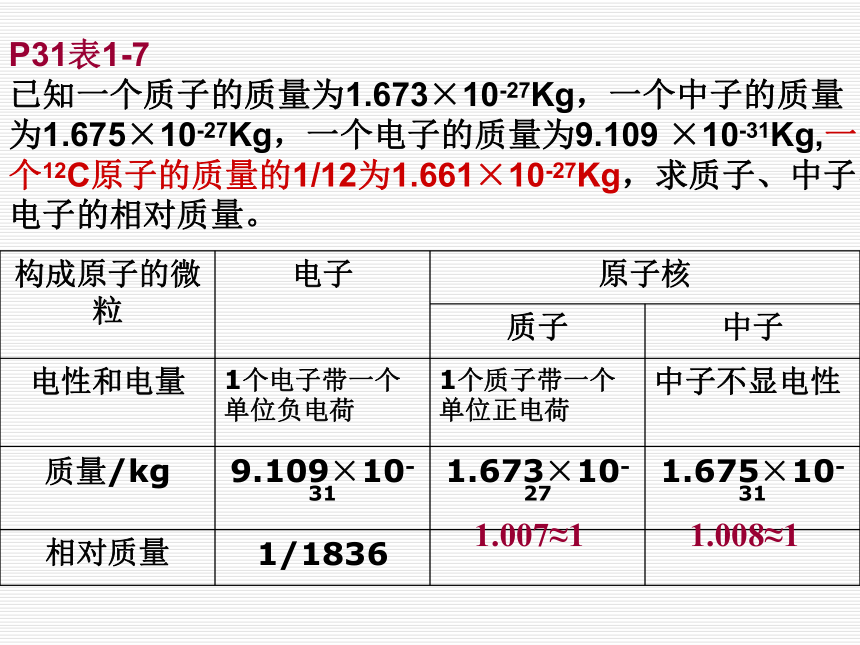
P31表1-7
已知一个质子的质量为1.673×10-27Kg,一个中子的质量为1.675×10-27Kg,一个电子的质量为9.109 ×10-31Kg,一个12C原子的质量的1/12为1.661×10-27Kg,求质子、中子、电子的相对质量。
1.007≈11.008≈1【思考】原子的质量集中在原子核上还是
原子核外呢?为什么?
● 相对于质子和中子,电子的质量很小,可以忽略不计,原子的质量主要由原子核决定
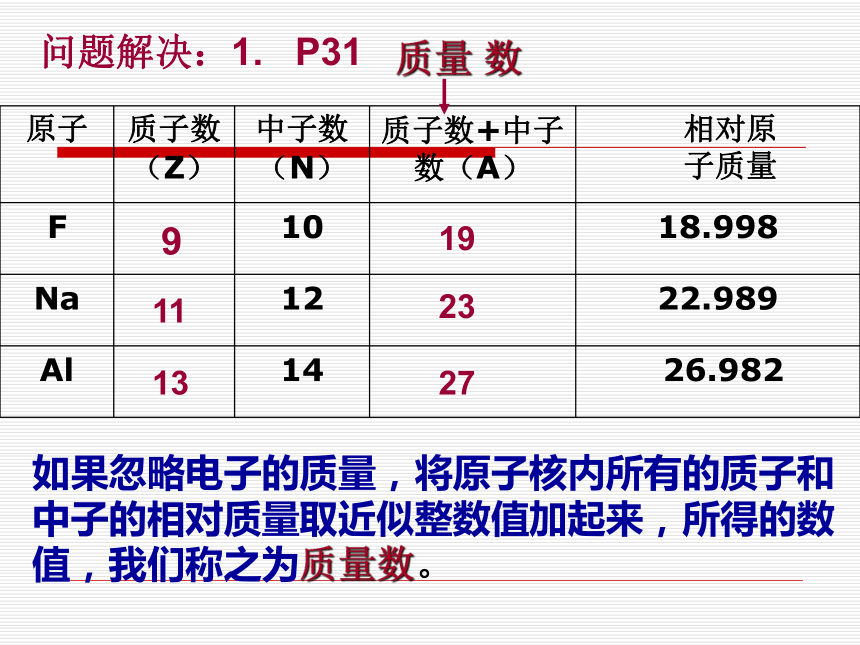
问题解决:1. P31
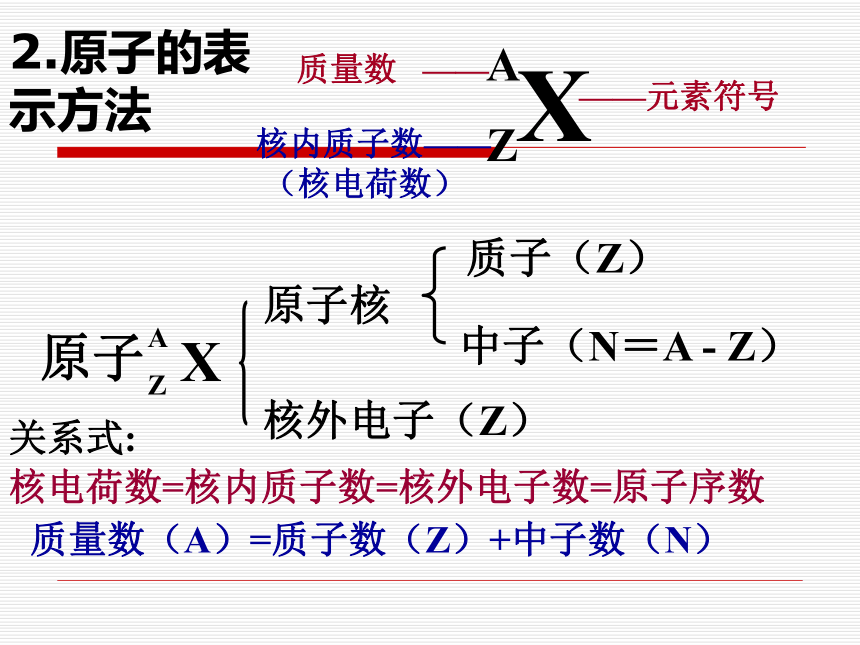
91119231327如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。【问题解决】 2.如果用X表示元素符号,Z表示原子 的质子数,A表示原子的质量数,请用zAX表示表中的原子的组成:
3.请总结出原子的质子数,中子数,电子数和质量数的之间关系?F Na Al19923112713——元素符号质量数 ——核内质子数——
(核电荷数)质量数(A)=质子数(Z)+中子数(N)2.原子的表示方法【巩固练习 】AXZCl3517H1110O188Ar13Al2713404018171835101【想一想】是不是所有的原子核都是由质子和
中子构成的呢?ab+dXca——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价
e ——代表原子个数 ea、b、c、d、e各代表什么?●想一想●请同学们认真阅读教材P32并分析比较
下列每组微粒的异同:1. 1H H H
121312. C C C6661213141.元素:具有相同质子数的同一类原子的总称。3.同位素:质子数相同而中子数不同的核素互称为同位素。2.核素:具有一定质子数和一定中子数的一种原子。二、元素、核素、同位素它们之间的特点如下:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。
②同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)
③同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。【讨论】请同学们相互讨论元素,核素,同 位
素有什么关系?
4.元素、核素和同位素的关系 在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:【巩固练习】
11H 、D、T、16O 、17O、18O有
种原子, 种元素,
; 属同位素。
62 11H 、D、T 816O、 817O、818O 888⑸用途:(1) C :612C、613C、614C
614C每隔5568年它的质量就会减少一半,考古学家根据生物体内614C的含量,就可判断其生活的年代. (2) 11H N=0 氕
12H(D) N=1 氘(重氢)
13H(T) N=2 氚(超重氢)制氢弹 O:816O 8 17O 8 18O
H2O 水 18; D2O 重水 20; T2O 超重水 22 (3)U: 92234U 92235 U 92238U
铀-235 制原子弹 2760CO是恶性肿瘤的“克星”,也可用其辐射育种,刺激增长,保鲜,防腐.1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。811.11331.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C课堂练习:补充知识点小结:三、构成离子的微粒之间的数量关系注意:原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数—核外电子数
核内质子数(Z)=核外电子数——电荷数阴离子:核电荷数(Z)=核内质子数—核外电子数
核内质子数=核外电子数—电荷数请指出Al、Al3+,Cl,Cl-中所含的质子数和电子数。+><-【巩固练习 】16181110910a-nb-m谢谢大家
光临指导
是否可以再分?如果原子可以再分,
它是有哪些更小的微粒构成的呢?
2.相对原子的质量定义为“某原子的
质量与12C原子质量的1/12的比。
12C原子指的是什么原子?原子原子核核外电子质子中子一 .原子的构成1.原子的结构请同学们根据上表比较这三种粒子的质量大小和带电荷情况?得到什么样的结论?◆三种粒子的质量都很小
◆质子和中子的质量基本相等,电子的质量最小
◆质子带正电荷,中子不带电,电子带负电
◆质子和中子带电量相等,电性相反
P31表1-7
已知一个质子的质量为1.673×10-27Kg,一个中子的质量为1.675×10-27Kg,一个电子的质量为9.109 ×10-31Kg,一个12C原子的质量的1/12为1.661×10-27Kg,求质子、中子、电子的相对质量。
1.007≈11.008≈1【思考】原子的质量集中在原子核上还是
原子核外呢?为什么?
● 相对于质子和中子,电子的质量很小,可以忽略不计,原子的质量主要由原子核决定
问题解决:1. P31
91119231327如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。【问题解决】 2.如果用X表示元素符号,Z表示原子 的质子数,A表示原子的质量数,请用zAX表示表中的原子的组成:
3.请总结出原子的质子数,中子数,电子数和质量数的之间关系?F Na Al19923112713——元素符号质量数 ——核内质子数——
(核电荷数)质量数(A)=质子数(Z)+中子数(N)2.原子的表示方法【巩固练习 】AXZCl3517H1110O188Ar13Al2713404018171835101【想一想】是不是所有的原子核都是由质子和
中子构成的呢?ab+dXca——代表质量数;
b——代表核电荷数;
c——代表离子的价态;
d——代表化合价
e ——代表原子个数 ea、b、c、d、e各代表什么?●想一想●请同学们认真阅读教材P32并分析比较
下列每组微粒的异同:1. 1H H H
121312. C C C6661213141.元素:具有相同质子数的同一类原子的总称。3.同位素:质子数相同而中子数不同的核素互称为同位素。2.核素:具有一定质子数和一定中子数的一种原子。二、元素、核素、同位素它们之间的特点如下:
①天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。
②同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)
③同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。【讨论】请同学们相互讨论元素,核素,同 位
素有什么关系?
4.元素、核素和同位素的关系 在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:【巩固练习】
11H 、D、T、16O 、17O、18O有
种原子, 种元素,
; 属同位素。
62 11H 、D、T 816O、 817O、818O 888⑸用途:(1) C :612C、613C、614C
614C每隔5568年它的质量就会减少一半,考古学家根据生物体内614C的含量,就可判断其生活的年代. (2) 11H N=0 氕
12H(D) N=1 氘(重氢)
13H(T) N=2 氚(超重氢)制氢弹 O:816O 8 17O 8 18O
H2O 水 18; D2O 重水 20; T2O 超重水 22 (3)U: 92234U 92235 U 92238U
铀-235 制原子弹 2760CO是恶性肿瘤的“克星”,也可用其辐射育种,刺激增长,保鲜,防腐.1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?( )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?( )
解:因为 S2- 的核外电子数是18,即硫原子得
到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。811.11331.据报道,上海某医院正在研究用放射性的一
种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是A、72 B、19 C、53 D、125B2.某二价阴离子,核外有18个电子,质量数为32,则其中子数为:A、12 B、14 C、16 D、18C课堂练习:补充知识点小结:三、构成离子的微粒之间的数量关系注意:原子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数—核外电子数
核内质子数(Z)=核外电子数——电荷数阴离子:核电荷数(Z)=核内质子数—核外电子数
核内质子数=核外电子数—电荷数请指出Al、Al3+,Cl,Cl-中所含的质子数和电子数。+><-【巩固练习 】16181110910a-nb-m谢谢大家
光临指导
