第一学期期中复习 化学基本概念
图片预览







文档简介
课件25张PPT。第一学期期中复习化学基本概念化学基本概念氧化还原反应 C物质的分类---溶液及胶体 A离子反应物质的量---概念及计算 C定义
共存 C
离子方程式课标要求【】【本部分近几年高考呈现率较高的知识点】 化学用语(化学方程式、化学式、微粒符号等);
2. 化学中的常用计量,尤其以物质的量为中心的判
断和简单计算
3. 以氧化还原为中心的判断与计算;
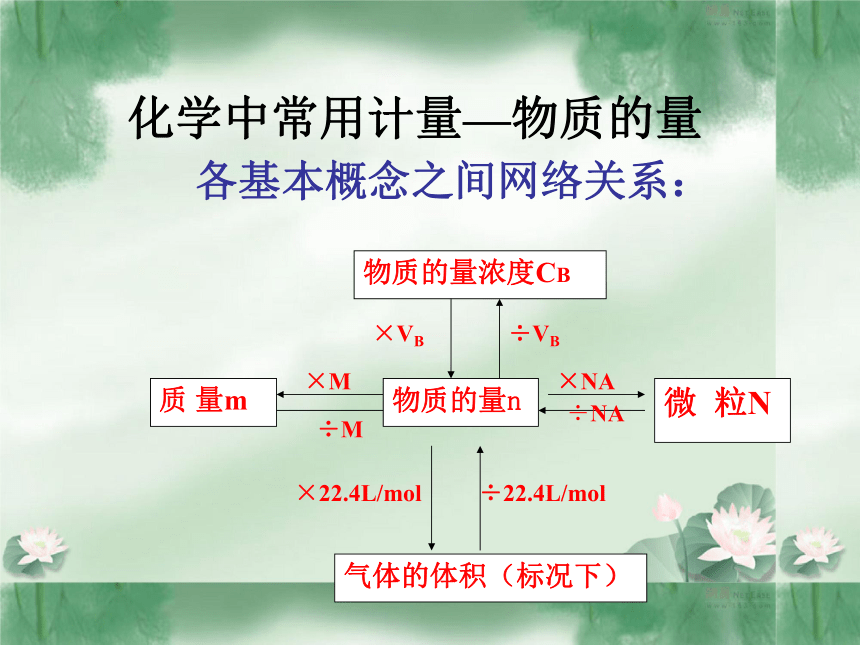
4. 离子反应方程式的正误判断与书写化学中常用计量—物质的量
物质的量n各基本概念之间网络关系:例1 . 3.4克 NH3含有____摩尔氮原子;
_____________个氢原子;
______________个电子;
在标况下的体积为______;
将其溶于水配成500mL溶液,物质的量浓度为________ 0.20.6 NA2 NA4.48L0.4mol/L 例2、在无土栽培中,需配制一定量含50mol
NH4Cl、16mol KCl和24mol K2SO4的营养液。
若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来
配制,三者的物质的量依次是(单位为mol)
A、2、64、24 B、64、2、24
C、32、50、12 D、16、50、24
B练一练 判断下列说法是否正确.
1.常温常压下,氧气和臭氧的的混合物16克中 约含有6.02×1023个氧原子.
2 .水的摩尔质量等于NA个水分子质量之和.
3.常温常压下,1molCO2的体积比22.4L大.
4.等体积等密度的CO和N2的分子数相等.
5.22.4LH2和N2的混合气所含分子数为NA .
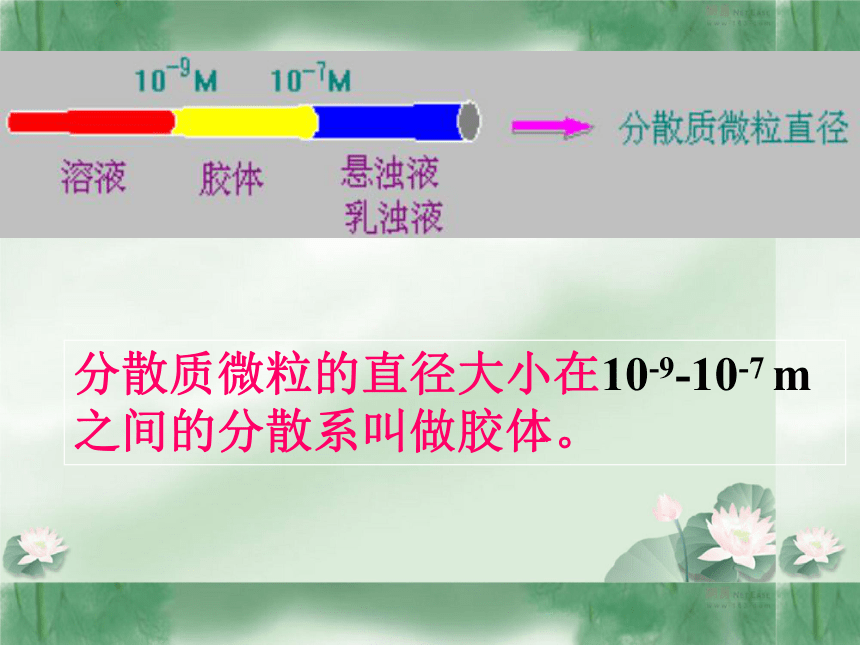
√×√√×分散质微粒的直径大小在10-9-10-7 m 之间的分散系叫做胶体。 例3、现有两瓶液体,一为氯化铁溶液,一为氢氧化铁胶体,请用简单方法鉴别。用到胶体的什么性质? 解答:各取液体于小烧杯中,并置于暗处,用聚光手电筒(或激光笔)照射,从垂直于光线的方向观察实验现象,能看到光亮通路的是氢氧化铁胶体,不能看到的为氯化铁溶液。
丁达尔效应
有电子转移的反应是氧化还原反应;
它的特征是元素的化合价发生变化。置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。氧化还 原反应化合反应置换反应分解反应氧化还原反应与化学反应基本类型的关系例4、下列反应中,属于氧化还原反应的是
A、NH4HCO3=NH3↑+CO2↑+H2O
B、Na2CO3+2HCl=2NaCl+CO2↑+H2O
C、4HCl+MnO2=MnCl2+Cl2↑+H2O
D、2Cu(NO3)2=2CuO+4NO2↑+O2↑
CD氧化还原反应的有关概念及联系 还原剂有还原性 → 价升高 → 失电子 → 被氧化
??氧化剂有氧化性 → 价降低 → 得电子 → 被还原→发生氧化反应→产生氧化产物
→发生还原反应→产生还原产物
练一练.下列变化过程中,在常温下加入还原剂就能实现的是
A、Ag+→Ag B、CuO→ Cu
C、SO2→SO3 D、CO→CO2
A(1)电解质的概念。凡在水溶液中或熔化状态下能导电的化合物叫电解质,在上述两种状态都不能导电的化合物叫非电解质。这里注意强调是化合物,象金属单质、石墨、溶液等都不在此范围。
(2)离子反应指有离子参加的化学反应。离子反应包括两大类:①复分解反应,需要满足复分解反应的发生条件;②氧化还原反应。
例5、下列反应既是离子反应,又是氧化还原反应的是
A.二氧化硫与硫化氢作用生成硫和水
B.二氧化硫与氢氧化钠溶液作用生成亚硫酸钠
C.硫化氢通入氯化铁溶液中生成硫、氯化亚铁 和盐酸
D.Zn粒与稀硫酸反应制取氢气
CD练一练、下列各组离子,能在溶液中大量共存
的是
A.Ag+,K+,I-,NO3-
B.Cu2+,H+,Br-,S2-
C.Mg2+,H+、Cl-,SO42-
D.K+,H+,Fe2+,NO3-
C解这类题的思路是:不同的离子是否能在溶液中大量共存,主要从以下几个方面考虑:
①离子相互结合成难溶(微溶)物质;
②离子相互结合成气体;
③ 离子相互结合成难电离物质;
④离子间发生氧化还原反应。离子反应方程式书写的注意事项: (1)一般离子反应多发生在溶液中,故不是溶液中进行的反应,不能用离子方程式表示。
(2) 离子方程式中,只有可溶性强电解质方可拆成离子形式,其它物质均以化学式表示。
(3)关于微溶物:生成物中有微溶物析出,写化学式;反应物里微溶物处于溶液状态时,可写成离子符号(如澄清的石灰水,可写成Ca2+ 和OH- ),反应物里微溶物处于浊液或固体时,写化学式[如:石灰乳,应用Ca(OH)2表示].
(4)以反应为依据,尊重客观事实。
例6、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
_______________________________________
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
_______________________________________
(3)若向NaHCO3溶液中加入足量的Ba(OH)2溶液,离子方程式:
_____________________________________________________2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OSO42-+Ba2+=BaSO4↓ HCO3-+OH-+Ba2+=BaCO3 ↓ +H2O练一练 、下列离子方程式正确的是
A.铜片投入AgNO3溶液中
Cu+Ag+=Cu2++Ag
B.少量氯气通入KI溶液中Cl2+I-=Cl-+I2
C.Ba(OH)2溶液中滴入稀H2SO4
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.Fe+2H+=Fe2+ +H2↑
D作业:
1:课后整理
2:课堂练习[参考答案]1、D 2、AD 3、D 4、C 5、C 6、C 7、C 8、B 9、A
10、电子的转移、还原、氧化11、实际参加反应的离子 化学反应2H++CO32-=H2O+CO2↑12、酸、碱、盐 复分解 , 气体生成、沉淀生成、难电离物质生成谢谢
共存 C
离子方程式课标要求【】【本部分近几年高考呈现率较高的知识点】 化学用语(化学方程式、化学式、微粒符号等);
2. 化学中的常用计量,尤其以物质的量为中心的判
断和简单计算
3. 以氧化还原为中心的判断与计算;
4. 离子反应方程式的正误判断与书写化学中常用计量—物质的量
物质的量n各基本概念之间网络关系:例1 . 3.4克 NH3含有____摩尔氮原子;
_____________个氢原子;
______________个电子;
在标况下的体积为______;
将其溶于水配成500mL溶液,物质的量浓度为________ 0.20.6 NA2 NA4.48L0.4mol/L 例2、在无土栽培中,需配制一定量含50mol
NH4Cl、16mol KCl和24mol K2SO4的营养液。
若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来
配制,三者的物质的量依次是(单位为mol)
A、2、64、24 B、64、2、24
C、32、50、12 D、16、50、24
B练一练 判断下列说法是否正确.
1.常温常压下,氧气和臭氧的的混合物16克中 约含有6.02×1023个氧原子.
2 .水的摩尔质量等于NA个水分子质量之和.
3.常温常压下,1molCO2的体积比22.4L大.
4.等体积等密度的CO和N2的分子数相等.
5.22.4LH2和N2的混合气所含分子数为NA .
√×√√×分散质微粒的直径大小在10-9-10-7 m 之间的分散系叫做胶体。 例3、现有两瓶液体,一为氯化铁溶液,一为氢氧化铁胶体,请用简单方法鉴别。用到胶体的什么性质? 解答:各取液体于小烧杯中,并置于暗处,用聚光手电筒(或激光笔)照射,从垂直于光线的方向观察实验现象,能看到光亮通路的是氢氧化铁胶体,不能看到的为氯化铁溶液。
丁达尔效应
有电子转移的反应是氧化还原反应;
它的特征是元素的化合价发生变化。置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。氧化还 原反应化合反应置换反应分解反应氧化还原反应与化学反应基本类型的关系例4、下列反应中,属于氧化还原反应的是
A、NH4HCO3=NH3↑+CO2↑+H2O
B、Na2CO3+2HCl=2NaCl+CO2↑+H2O
C、4HCl+MnO2=MnCl2+Cl2↑+H2O
D、2Cu(NO3)2=2CuO+4NO2↑+O2↑
CD氧化还原反应的有关概念及联系 还原剂有还原性 → 价升高 → 失电子 → 被氧化
??氧化剂有氧化性 → 价降低 → 得电子 → 被还原→发生氧化反应→产生氧化产物
→发生还原反应→产生还原产物
练一练.下列变化过程中,在常温下加入还原剂就能实现的是
A、Ag+→Ag B、CuO→ Cu
C、SO2→SO3 D、CO→CO2
A(1)电解质的概念。凡在水溶液中或熔化状态下能导电的化合物叫电解质,在上述两种状态都不能导电的化合物叫非电解质。这里注意强调是化合物,象金属单质、石墨、溶液等都不在此范围。
(2)离子反应指有离子参加的化学反应。离子反应包括两大类:①复分解反应,需要满足复分解反应的发生条件;②氧化还原反应。
例5、下列反应既是离子反应,又是氧化还原反应的是
A.二氧化硫与硫化氢作用生成硫和水
B.二氧化硫与氢氧化钠溶液作用生成亚硫酸钠
C.硫化氢通入氯化铁溶液中生成硫、氯化亚铁 和盐酸
D.Zn粒与稀硫酸反应制取氢气
CD练一练、下列各组离子,能在溶液中大量共存
的是
A.Ag+,K+,I-,NO3-
B.Cu2+,H+,Br-,S2-
C.Mg2+,H+、Cl-,SO42-
D.K+,H+,Fe2+,NO3-
C解这类题的思路是:不同的离子是否能在溶液中大量共存,主要从以下几个方面考虑:
①离子相互结合成难溶(微溶)物质;
②离子相互结合成气体;
③ 离子相互结合成难电离物质;
④离子间发生氧化还原反应。离子反应方程式书写的注意事项: (1)一般离子反应多发生在溶液中,故不是溶液中进行的反应,不能用离子方程式表示。
(2) 离子方程式中,只有可溶性强电解质方可拆成离子形式,其它物质均以化学式表示。
(3)关于微溶物:生成物中有微溶物析出,写化学式;反应物里微溶物处于溶液状态时,可写成离子符号(如澄清的石灰水,可写成Ca2+ 和OH- ),反应物里微溶物处于浊液或固体时,写化学式[如:石灰乳,应用Ca(OH)2表示].
(4)以反应为依据,尊重客观事实。
例6、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
_______________________________________
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
_______________________________________
(3)若向NaHCO3溶液中加入足量的Ba(OH)2溶液,离子方程式:
_____________________________________________________2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OSO42-+Ba2+=BaSO4↓ HCO3-+OH-+Ba2+=BaCO3 ↓ +H2O练一练 、下列离子方程式正确的是
A.铜片投入AgNO3溶液中
Cu+Ag+=Cu2++Ag
B.少量氯气通入KI溶液中Cl2+I-=Cl-+I2
C.Ba(OH)2溶液中滴入稀H2SO4
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.Fe+2H+=Fe2+ +H2↑
D作业:
1:课后整理
2:课堂练习[参考答案]1、D 2、AD 3、D 4、C 5、C 6、C 7、C 8、B 9、A
10、电子的转移、还原、氧化11、实际参加反应的离子 化学反应2H++CO32-=H2O+CO2↑12、酸、碱、盐 复分解 , 气体生成、沉淀生成、难电离物质生成谢谢
同课章节目录
