钠的化合物
图片预览




文档简介
课件14张PPT。3.2 几种重要的金属化合物 钠的重要化合物
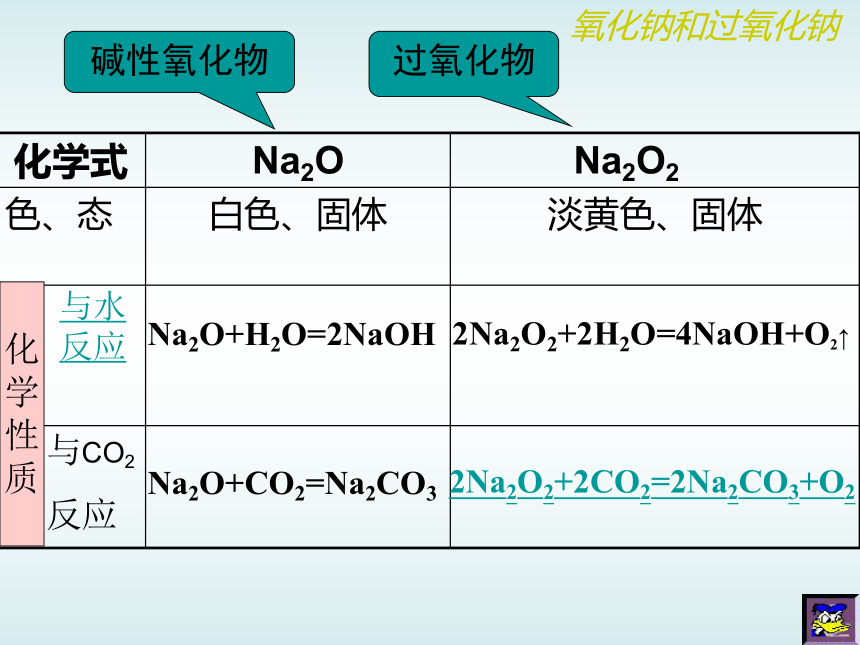
Na2O+H2O=2NaOHNa2O+CO2=Na2CO32Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2Na2O2化
学
性
质氧化钠和过氧化钠与水
反应与CO2
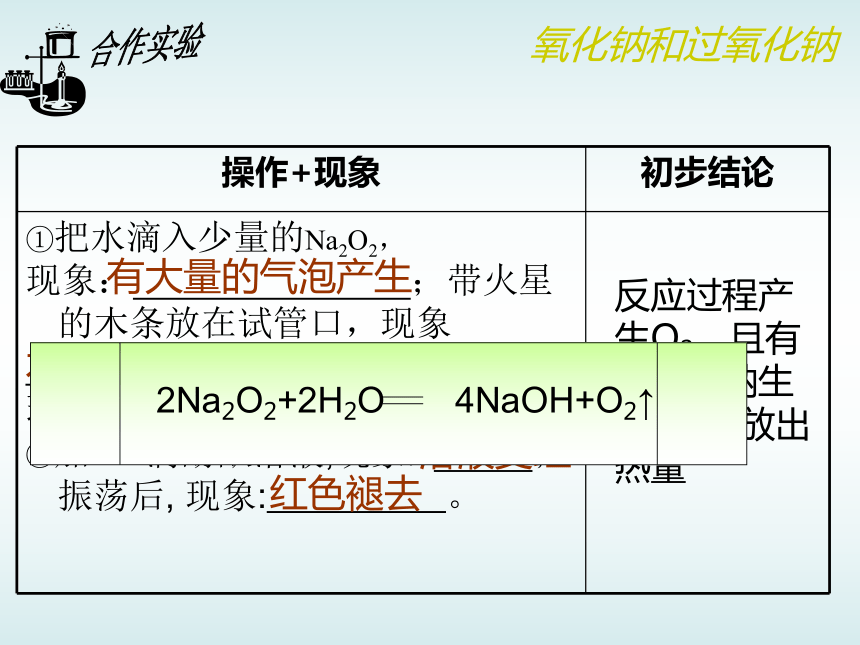
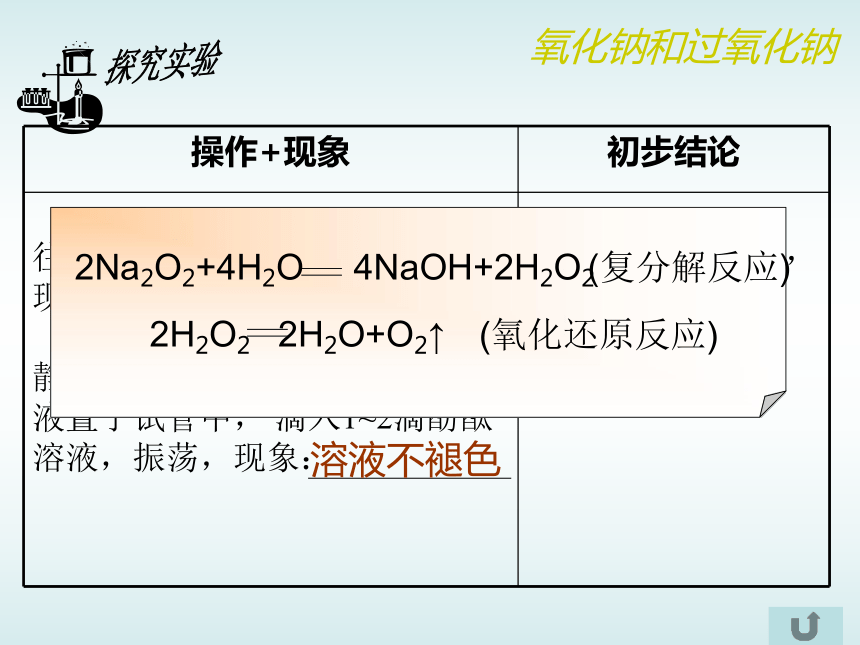
反应碱性氧化物过氧化物反应过程产生O2,且有氢氧化钠生成,同时,放出热量合作实验有大量的气泡产生木条复燃 放热溶液变红红色褪去氧化钠和过氧化钠Na2O2与H2O反应,有H2O2生成,H2O2再分解成H2O和O2有大量气泡产生溶液不褪色探究实验氧化钠和过氧化钠(复分解反应)(氧化还原反应)过氧化钠的用途之——呼吸面具氧化钠和过氧化钠过氧化钠的用途之——潜水艇氧化钠和过氧化钠碳酸钠和碳酸氢钠归纳碳酸钠比碳酸氢钠易溶于水稳定可用于玻璃、造纸、纺织等工业;可做洗涤剂等。可用于灭火机、发酵剂、医药等。不稳定溶解性热稳定性与酸反应用途碳酸钠与酸反应速率比碳酸氢钠慢 怎样鉴别碳酸钠和碳酸氢钠?学生实验碳酸钠和碳酸氢钠Na2CO3和NaHCO3在水中的溶解性
及其水溶液的酸碱性 加水结块;放热加水部分溶解;
感受不到热量变化 振荡时间长时可溶解 固体量减少溶液变红(较深)溶液变微红色 Na2CO3比NaHCO3易溶于水, 溶液碱性比NaHCO3溶液强
Na2CO3和NaHCO3的热稳定性演示实验2碳酸钠和碳酸氢钠烧杯A无变化,烧杯B中溶液变浑浊 Na2CO3和NaHCO3与酸反应学生实验碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠的用途碳酸钠和碳酸氢钠课堂小结注意重点:1、过氧化钠的性质。 2、碳酸钠和碳酸氢钠的性质比较
难点:过氧化钠的性质。 练习下列各组物质混合后,不能生成NaOH的是( )
A. Na和H2O B.Na2O2和H2O C.Ca(OH)2和Na2CO3 D.Ca(OH)2和NaClD课堂练习D.Ca(OH)2和NaCl下列离子方程式正确的是( ) A. 钠与水反应: Na+2H2O==Na++2OH-+H2↑ B.过氧化钠与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑ C.氧化钠与盐酸反应: O2-+2H+==H2O D.小苏打与稀硫酸反应:CO32-+2H+==CO2↑+H2OBB.过氧化钠与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑根据Na2O,Na2O2,Na2CO3,NaHCO3的性质,
请设计不同方案对这四种物质进行鉴定观察颜色 Na2O2
(淡黄色固体)Na2O,Na2CO3,NaHCO3
(白色固体)加稀盐酸 Na2O
(没现象) Na2CO3
(有气体产生,但不剧烈) NaHCO3
(有气体产生,反应剧烈)Na2O,Na2O2,Na2CO3,NaHCO3练习课堂练习
Na2O+H2O=2NaOHNa2O+CO2=Na2CO32Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2Na2O2化
学
性
质氧化钠和过氧化钠与水
反应与CO2
反应碱性氧化物过氧化物反应过程产生O2,且有氢氧化钠生成,同时,放出热量合作实验有大量的气泡产生木条复燃 放热溶液变红红色褪去氧化钠和过氧化钠Na2O2与H2O反应,有H2O2生成,H2O2再分解成H2O和O2有大量气泡产生溶液不褪色探究实验氧化钠和过氧化钠(复分解反应)(氧化还原反应)过氧化钠的用途之——呼吸面具氧化钠和过氧化钠过氧化钠的用途之——潜水艇氧化钠和过氧化钠碳酸钠和碳酸氢钠归纳碳酸钠比碳酸氢钠易溶于水稳定可用于玻璃、造纸、纺织等工业;可做洗涤剂等。可用于灭火机、发酵剂、医药等。不稳定溶解性热稳定性与酸反应用途碳酸钠与酸反应速率比碳酸氢钠慢 怎样鉴别碳酸钠和碳酸氢钠?学生实验碳酸钠和碳酸氢钠Na2CO3和NaHCO3在水中的溶解性
及其水溶液的酸碱性 加水结块;放热加水部分溶解;
感受不到热量变化 振荡时间长时可溶解 固体量减少溶液变红(较深)溶液变微红色 Na2CO3比NaHCO3易溶于水, 溶液碱性比NaHCO3溶液强
Na2CO3和NaHCO3的热稳定性演示实验2碳酸钠和碳酸氢钠烧杯A无变化,烧杯B中溶液变浑浊 Na2CO3和NaHCO3与酸反应学生实验碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠的用途碳酸钠和碳酸氢钠课堂小结注意重点:1、过氧化钠的性质。 2、碳酸钠和碳酸氢钠的性质比较
难点:过氧化钠的性质。 练习下列各组物质混合后,不能生成NaOH的是( )
A. Na和H2O B.Na2O2和H2O C.Ca(OH)2和Na2CO3 D.Ca(OH)2和NaClD课堂练习D.Ca(OH)2和NaCl下列离子方程式正确的是( ) A. 钠与水反应: Na+2H2O==Na++2OH-+H2↑ B.过氧化钠与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑ C.氧化钠与盐酸反应: O2-+2H+==H2O D.小苏打与稀硫酸反应:CO32-+2H+==CO2↑+H2OBB.过氧化钠与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑根据Na2O,Na2O2,Na2CO3,NaHCO3的性质,
请设计不同方案对这四种物质进行鉴定观察颜色 Na2O2
(淡黄色固体)Na2O,Na2CO3,NaHCO3
(白色固体)加稀盐酸 Na2O
(没现象) Na2CO3
(有气体产生,但不剧烈) NaHCO3
(有气体产生,反应剧烈)Na2O,Na2O2,Na2CO3,NaHCO3练习课堂练习
