氧化还原反应复习
图片预览



文档简介
课件24张PPT。氧化还原反应复习1.加入酚酞的NaOH溶液中滴入新制氯水有什么现象?溶液由红色变无色2.氰气的化学式为(CN)2,其性质和
卤素相似,称为“类卤素”。以下关于
(CN)2的叙述中不正确的是 ( )
A(CN)2化学性质活泼
B(CN)2不能和氢氧化钠反应
C(CN)2参加反应时常做氧化剂
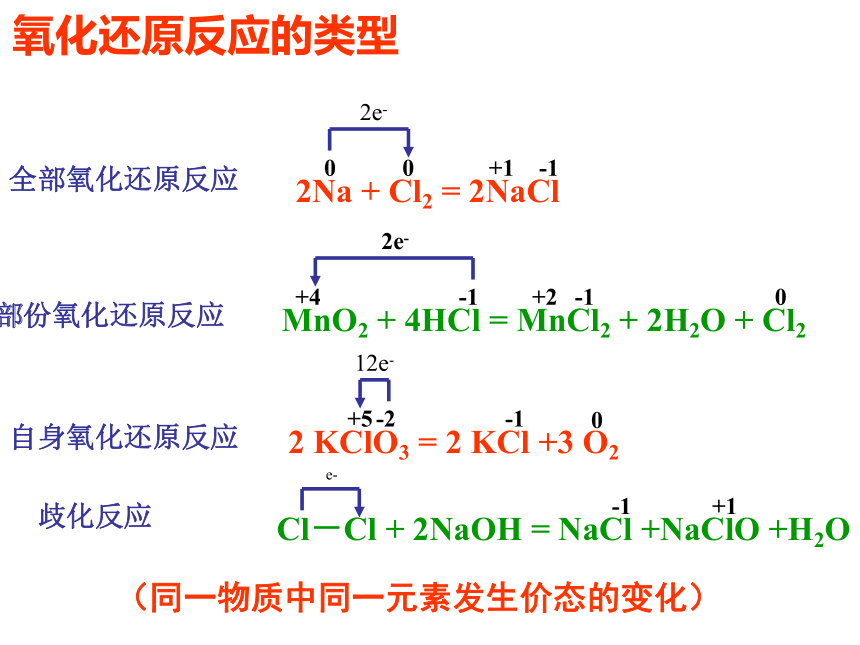
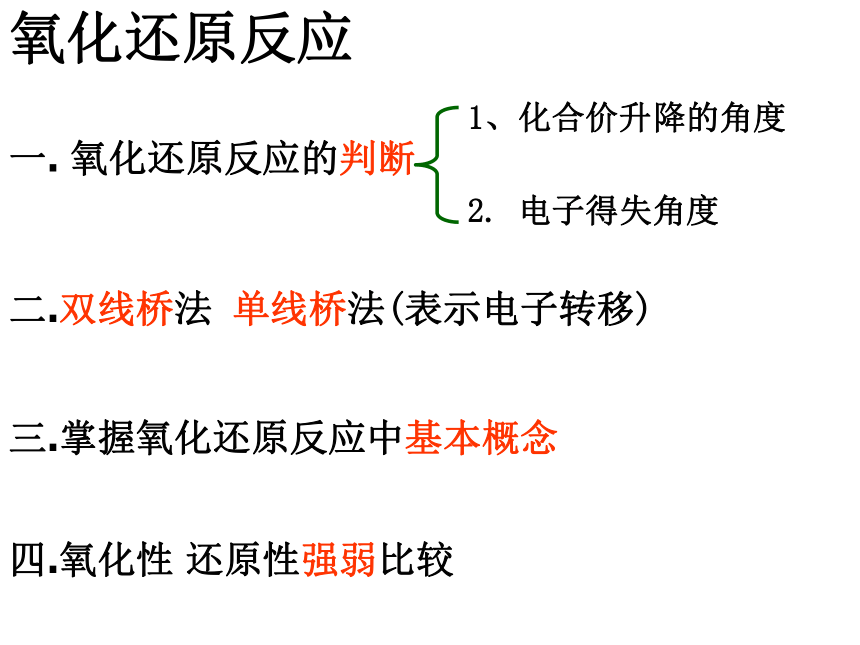
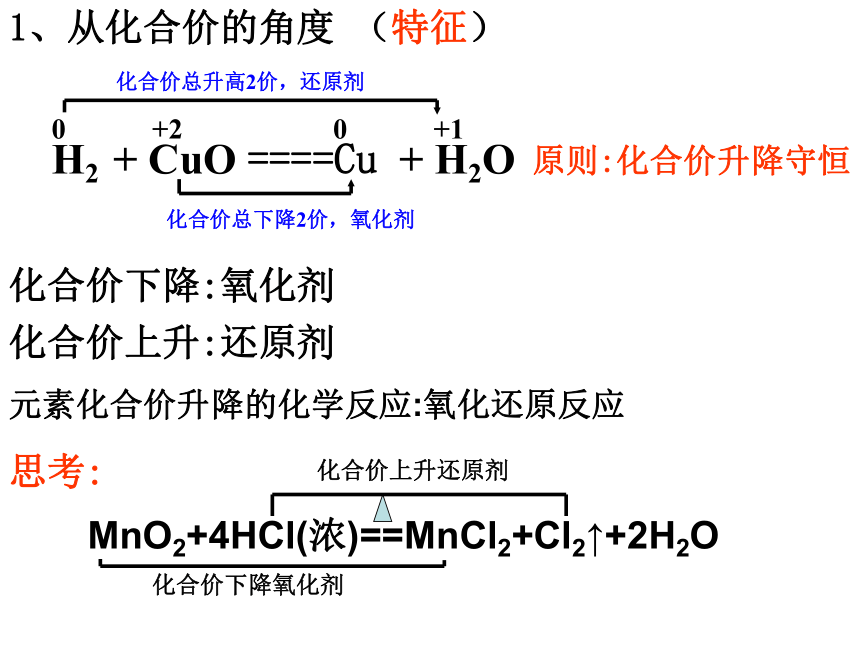
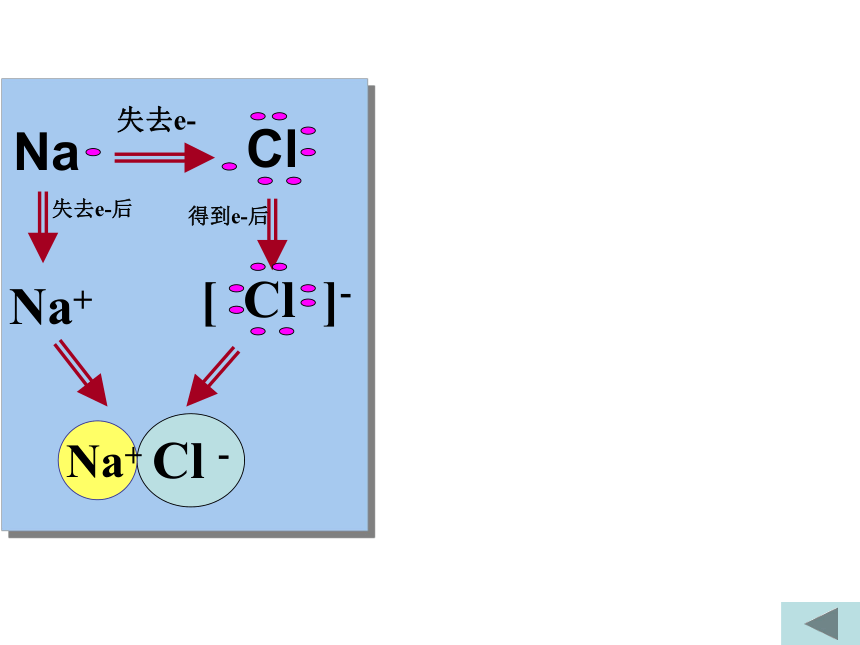
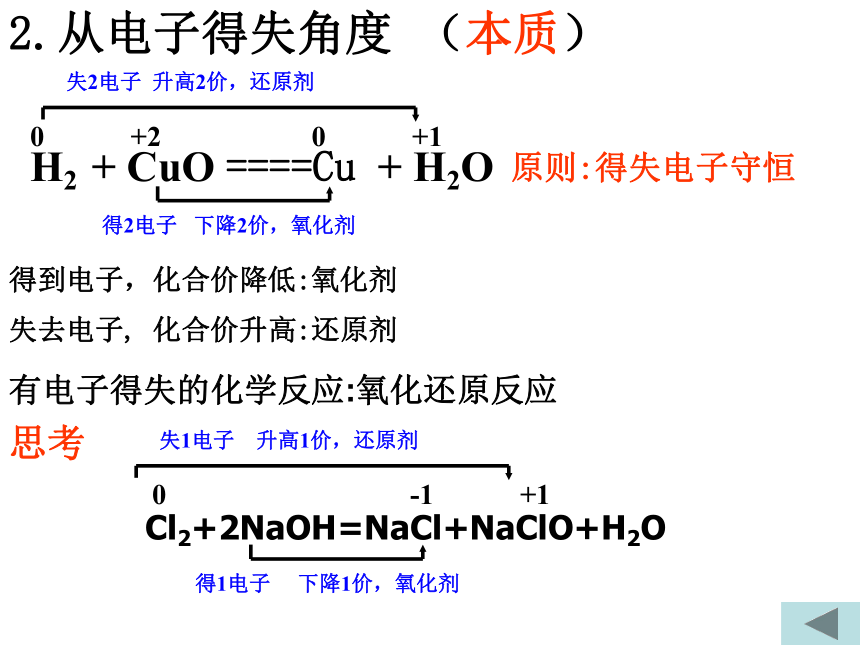
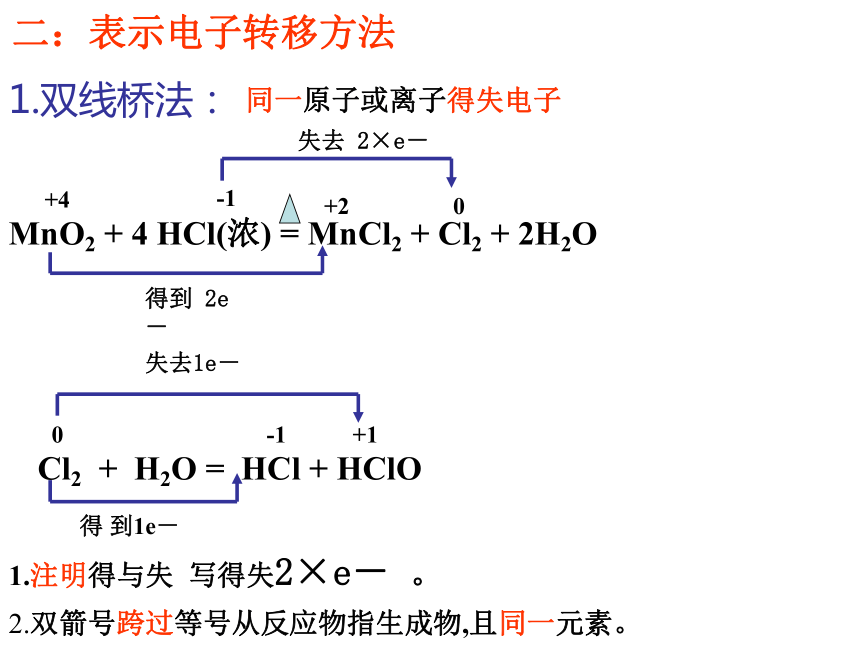
D(CN)2可以和H2反应B氧化还原反应的类型2e-2Na + Cl2 = 2NaCl0+10-1-2+5-12 KClO3 = 2 KCl +3 O212e-0MnO2 + 4HCl = MnCl2 + 2H2O + Cl2+4+2-102e-Cl-Cl + 2NaOH = NaCl +NaClO +H2O+1-1e-全部氧化还原反应部份氧化还原反应自身氧化还原反应歧化反应(同一物质中同一元素发生价态的变化)-1氧化还原反应三.掌握氧化还原反应中基本概念一. 氧化还原反应的判断二.双线桥法 单线桥法(表示电子转移)四.氧化性 还原性强弱比较1、化合价升降的角度2. 电子得失角度 1、从化合价的角度(特征)H2 + CuO ====Cu + H2O 0 +2 0 +1化合价总升高2价,还原剂化合价总下降2价,氧化剂化合价下降:氧化剂化合价上升:还原剂元素化合价升降的化学反应:氧化还原反应化合价下降氧化剂化合价上升还原剂思考:原则:化合价升降守恒失去e-失去e-后得到e-后Na+2.从电子得失角度 (本质)得到电子,化合价降低:氧化剂失去电子, 化合价升高:还原剂H2 + CuO ====Cu + H2O 0 +2 0 +1失2电子 升高2价,还原剂得2电子 下降2价,氧化剂有电子得失的化学反应:氧化还原反应原则:得失电子守恒Cl2+2NaOH=NaCl+NaClO+H2O0 -1 +1失1电子 升高1价,还原剂得1电子 下降1价,氧化剂思考二:表示电子转移方法1.双线桥法:失去 2×e-Cl2 + H2O = HCl + HClO失去1e-得 到1e-同一原子或离子得失电子得到 2e-+4+2-100+1-12.双箭号跨过等号从反应物指生成物,且同一元素。1.注明得与失 写得失2×e- 。2.单线桥法:Cl2 + H2O = HCl + HClO不同种原子或离子间得失电子1.箭号不跨过等号,失电子元素指向得电子元素。2.只标电子转移总数,不标得与失。2e-0+1-11e-小结 双线桥双箭号从反应物指向生成物且起止为同一元素。注明得与失。单线桥箭号起点为失电子元素,终点为得电子元素。不标得与失。三:氧化还原反应基本概念化合价升高还原剂+2 0 0 +1 失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂氧化反应氧化产物还原反应还原产物(还原产物)得电子(氧化产物)失电子强氧化剂+强还原剂 ==== 弱还原剂 + 弱氧化剂四、氧化性还原性强弱的比较1.氧化性:氧化剂 〉氧化产物还原性:还原剂 〉还原产物还原性:氧化性:Zn > CuCu2+ > Zn2+练习:氧化性:A2>C2> B2> D2还原性:D->B->C-> A-2.金属活动性顺序:还原性:K>Ca>Na>Mg>……氧化性:K+Cl2>Br2>I2>S还原性:F- < Cl- < Br- < I - < S2-金属还原性
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
非金属离子还原性
S2->I->Br->Cl->O2->F-
非金属氧化性
F2>O3>Cl2>Br2>I2>S金属离子的氧化性
Ag+>Cu2+>Fe2+>Al3+>K+(注:Fe3+>Cu2+)3.反应条件:氧化性:Cl2>Br2>I24.浓度:氧化性:浓硫酸 〉稀硫酸浓硝酸 〉稀硝酸5.pH值:氧化性:KMnO4(H+)〉 KMnO4五.常见的氧化剂还原剂1.氧化剂:O2、Cl2等活泼非金属单质含高价元素的化合物Na2O2 、H2O2等2.还原剂:K、Ca等活泼金属单质含低价元素的化合物C、H2等2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O练习:已知实验室常用下列三种方法制氯气KMnO4 〉 MnO2 〉 O2 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2874×36.5 设跟 17.4g 二氧化锰反应需氯化氢的质量为 x 17.4gx解: 答:被氧化的氯化氢的质量为29.2克。 考考你
的智慧,
此解对吗? 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2872×36.5 设跟 17.4g 二氧化锰反应,被氧化的氯化氢的质量为 x 17.4gx解: 答:被氧化 的氯化氢的质量为 14.6 克。 注意
只有一半
的氯化氢
被氧化被氧化 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2872×36.5 设跟 17.4g 二氧化锰反应,被氧化的氯化氢的质量为 x 17.4gx解: 答:被氧化 的氯化氢的质量为 14.6 克。若求氧化产
物的质量
呢?或反应
中有多少摩
电子转移?被氧化~2e-
卤素相似,称为“类卤素”。以下关于
(CN)2的叙述中不正确的是 ( )
A(CN)2化学性质活泼
B(CN)2不能和氢氧化钠反应
C(CN)2参加反应时常做氧化剂
D(CN)2可以和H2反应B氧化还原反应的类型2e-2Na + Cl2 = 2NaCl0+10-1-2+5-12 KClO3 = 2 KCl +3 O212e-0MnO2 + 4HCl = MnCl2 + 2H2O + Cl2+4+2-102e-Cl-Cl + 2NaOH = NaCl +NaClO +H2O+1-1e-全部氧化还原反应部份氧化还原反应自身氧化还原反应歧化反应(同一物质中同一元素发生价态的变化)-1氧化还原反应三.掌握氧化还原反应中基本概念一. 氧化还原反应的判断二.双线桥法 单线桥法(表示电子转移)四.氧化性 还原性强弱比较1、化合价升降的角度2. 电子得失角度 1、从化合价的角度(特征)H2 + CuO ====Cu + H2O 0 +2 0 +1化合价总升高2价,还原剂化合价总下降2价,氧化剂化合价下降:氧化剂化合价上升:还原剂元素化合价升降的化学反应:氧化还原反应化合价下降氧化剂化合价上升还原剂思考:原则:化合价升降守恒失去e-失去e-后得到e-后Na+2.从电子得失角度 (本质)得到电子,化合价降低:氧化剂失去电子, 化合价升高:还原剂H2 + CuO ====Cu + H2O 0 +2 0 +1失2电子 升高2价,还原剂得2电子 下降2价,氧化剂有电子得失的化学反应:氧化还原反应原则:得失电子守恒Cl2+2NaOH=NaCl+NaClO+H2O0 -1 +1失1电子 升高1价,还原剂得1电子 下降1价,氧化剂思考二:表示电子转移方法1.双线桥法:失去 2×e-Cl2 + H2O = HCl + HClO失去1e-得 到1e-同一原子或离子得失电子得到 2e-+4+2-100+1-12.双箭号跨过等号从反应物指生成物,且同一元素。1.注明得与失 写得失2×e- 。2.单线桥法:Cl2 + H2O = HCl + HClO不同种原子或离子间得失电子1.箭号不跨过等号,失电子元素指向得电子元素。2.只标电子转移总数,不标得与失。2e-0+1-11e-小结 双线桥双箭号从反应物指向生成物且起止为同一元素。注明得与失。单线桥箭号起点为失电子元素,终点为得电子元素。不标得与失。三:氧化还原反应基本概念化合价升高还原剂+2 0 0 +1 失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂氧化反应氧化产物还原反应还原产物(还原产物)得电子(氧化产物)失电子强氧化剂+强还原剂 ==== 弱还原剂 + 弱氧化剂四、氧化性还原性强弱的比较1.氧化性:氧化剂 〉氧化产物还原性:还原剂 〉还原产物还原性:氧化性:Zn > CuCu2+ > Zn2+练习:氧化性:A2>C2> B2> D2还原性:D->B->C-> A-2.金属活动性顺序:还原性:K>Ca>Na>Mg>……氧化性:K+
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
非金属离子还原性
S2->I->Br->Cl->O2->F-
非金属氧化性
F2>O3>Cl2>Br2>I2>S金属离子的氧化性
Ag+>Cu2+>Fe2+>Al3+>K+(注:Fe3+>Cu2+)3.反应条件:氧化性:Cl2>Br2>I24.浓度:氧化性:浓硫酸 〉稀硫酸浓硝酸 〉稀硝酸5.pH值:氧化性:KMnO4(H+)〉 KMnO4五.常见的氧化剂还原剂1.氧化剂:O2、Cl2等活泼非金属单质含高价元素的化合物Na2O2 、H2O2等2.还原剂:K、Ca等活泼金属单质含低价元素的化合物C、H2等2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O练习:已知实验室常用下列三种方法制氯气KMnO4 〉 MnO2 〉 O2 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2874×36.5 设跟 17.4g 二氧化锰反应需氯化氢的质量为 x 17.4gx解: 答:被氧化的氯化氢的质量为29.2克。 考考你
的智慧,
此解对吗? 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2872×36.5 设跟 17.4g 二氧化锰反应,被氧化的氯化氢的质量为 x 17.4gx解: 答:被氧化 的氯化氢的质量为 14.6 克。 注意
只有一半
的氯化氢
被氧化被氧化 思考题:实验室用二氧化锰和足量的浓盐酸
反应制取氯气。现有17.4g 二氧化锰参加反应,
求被氧化的氯化氢的质量是多少? MnO2 + 4HCl = MnCl2 + 2H2O +Cl2872×36.5 设跟 17.4g 二氧化锰反应,被氧化的氯化氢的质量为 x 17.4gx解: 答:被氧化 的氯化氢的质量为 14.6 克。若求氧化产
物的质量
呢?或反应
中有多少摩
电子转移?被氧化~2e-
