二氧化硫的性质与应用
图片预览






文档简介
课件27张PPT。同学们:每天,当你阅读报纸、收听广播或收看电视节目时,经常可以获得关于空气质量的信息。空气质量报告各项指标中,有二氧化硫的指数.为什么要有二氧化硫呢?它有什么危害呢?酸雨对环境的危害二氧化硫的性质和应用第一单元 含硫化合物的性质和应用一、二氧化硫的性质二氧化硫的物理性质思考1:SO2的物理性质体现在哪些方面?
探究1:请设计一个实验来证明SO2是否易
溶于水?气体的物理性质可从以下几个等方面去分析:
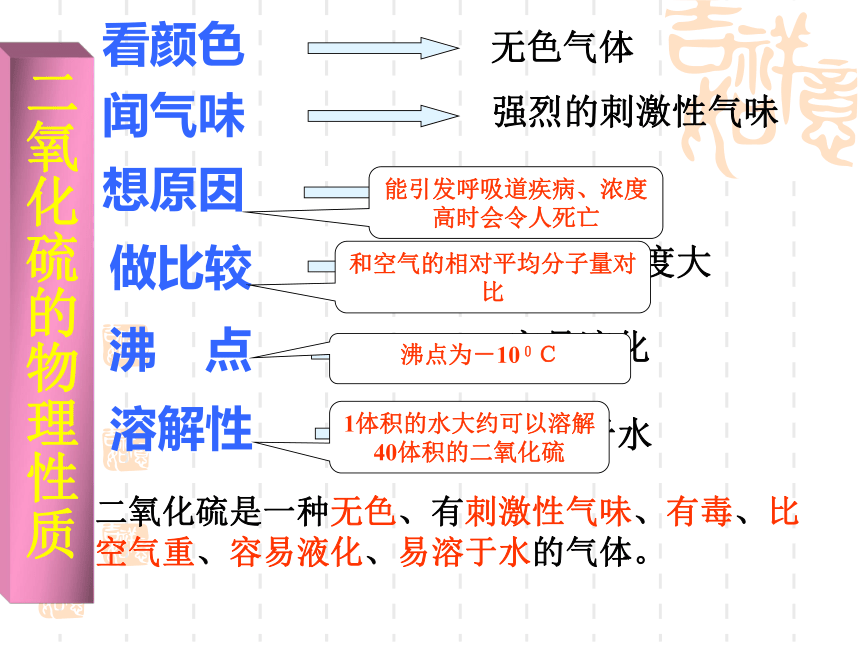
(颜色、状态、气味、毒性、密度、溶解性等)二氧化硫试管中的水面上升矿泉水瓶瘪了看颜色想原因闻气味做比较溶解性沸 点能引发呼吸道疾病、浓度高时会令人死亡和空气的相对平均分子量对比沸点为-100C1体积的水大约可以溶解40体积的二氧化硫二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。 二氧化硫的物理性质探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么?SO2与水的反应:二氧化硫的化学性质|酸性氧化物的通性 SO2 + H2O H2SO3(亚硫酸)探究3:对比实验(1)向一支盛有SO2溶液的试管滴入1-2滴品红溶液,然后振动试管,再加热溶液,观察溶液的颜色变化情况。
(2)向一支盛有氯水的试管滴入1-2滴品红溶液,然后振动试管,再加热溶液,观察溶液的颜色变化情况你能得出什么结论?原理:二氧化硫与某些有色物质直接生成不稳定的无色物质实质:化合作用程度:暂时性,加热可复原范围: 漂白某些有色物质,不能使紫色石蕊试液褪色探究结论:SO2具有漂白性二氧化硫的化学性质 |漂白性永久性暂时性 氯气中HClO将有色物质氧化成无色物质氧化还原反应非氧化还原反应 可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与有色物质直接结合生成不稳定无色物质 漂白某些有色物质,不能使紫色石蕊试液褪色问题探究1:环保部门检测收集酸雨时,pH值在一段时间会有什么变化?问题探究2: SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?问题探究3:
(1)SO2使滴有酚酞的NaOH溶液红色褪去, SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
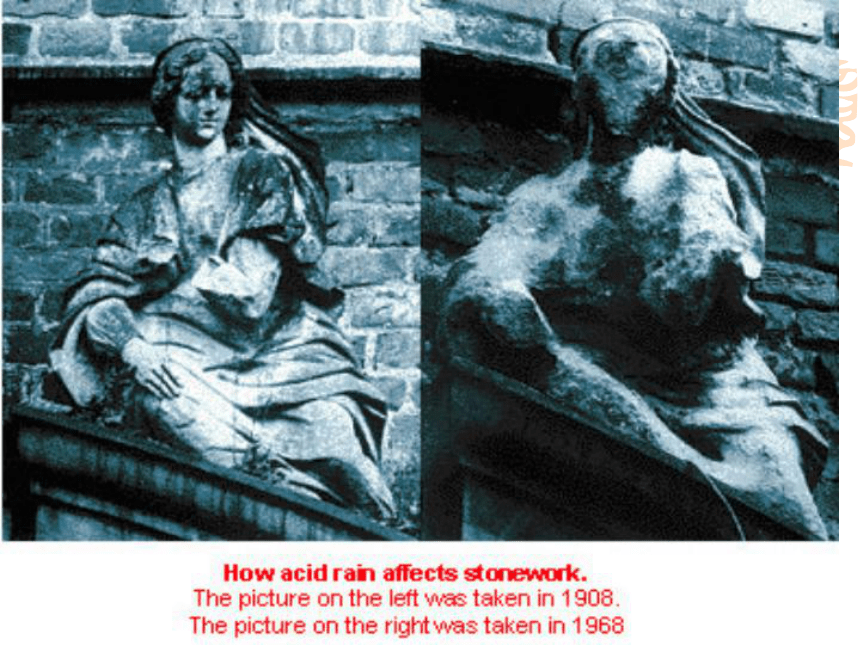
二、酸雨的形成三、酸雨的防治阅读:
防治酸雨有哪些措施?1.用新型的能源(氢能、太阳能、核能)
2.对含硫燃料进行脱硫处理
3.对释放出SO2废气进行处理回收利用
4.提高全民的环境保护意识,加强国际间合作防治酸雨的措施二氧化硫物理性质无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水化学性质课堂小结2.下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中 B D1.左图是古时用燃烧硫的方法漂白布料的图片。请同学们分析其原理 3.你认为减少酸雨产生的途径可采用的措施是______________。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;
④在已酸化的土壤中加石灰;⑤开发新能源。
探究1:请设计一个实验来证明SO2是否易
溶于水?气体的物理性质可从以下几个等方面去分析:
(颜色、状态、气味、毒性、密度、溶解性等)二氧化硫试管中的水面上升矿泉水瓶瘪了看颜色想原因闻气味做比较溶解性沸 点能引发呼吸道疾病、浓度高时会令人死亡和空气的相对平均分子量对比沸点为-100C1体积的水大约可以溶解40体积的二氧化硫二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。 二氧化硫的物理性质探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么?SO2与水的反应:二氧化硫的化学性质|酸性氧化物的通性 SO2 + H2O H2SO3(亚硫酸)探究3:对比实验(1)向一支盛有SO2溶液的试管滴入1-2滴品红溶液,然后振动试管,再加热溶液,观察溶液的颜色变化情况。
(2)向一支盛有氯水的试管滴入1-2滴品红溶液,然后振动试管,再加热溶液,观察溶液的颜色变化情况你能得出什么结论?原理:二氧化硫与某些有色物质直接生成不稳定的无色物质实质:化合作用程度:暂时性,加热可复原范围: 漂白某些有色物质,不能使紫色石蕊试液褪色探究结论:SO2具有漂白性二氧化硫的化学性质 |漂白性永久性暂时性 氯气中HClO将有色物质氧化成无色物质氧化还原反应非氧化还原反应 可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与有色物质直接结合生成不稳定无色物质 漂白某些有色物质,不能使紫色石蕊试液褪色问题探究1:环保部门检测收集酸雨时,pH值在一段时间会有什么变化?问题探究2: SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?问题探究3:
(1)SO2使滴有酚酞的NaOH溶液红色褪去, SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
二、酸雨的形成三、酸雨的防治阅读:
防治酸雨有哪些措施?1.用新型的能源(氢能、太阳能、核能)
2.对含硫燃料进行脱硫处理
3.对释放出SO2废气进行处理回收利用
4.提高全民的环境保护意识,加强国际间合作防治酸雨的措施二氧化硫物理性质无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水化学性质课堂小结2.下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味 C、通入澄清石灰水 D、通入品红溶液中 B D1.左图是古时用燃烧硫的方法漂白布料的图片。请同学们分析其原理 3.你认为减少酸雨产生的途径可采用的措施是______________。
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;
④在已酸化的土壤中加石灰;⑤开发新能源。
