氮肥的生产和使用
图片预览






文档简介
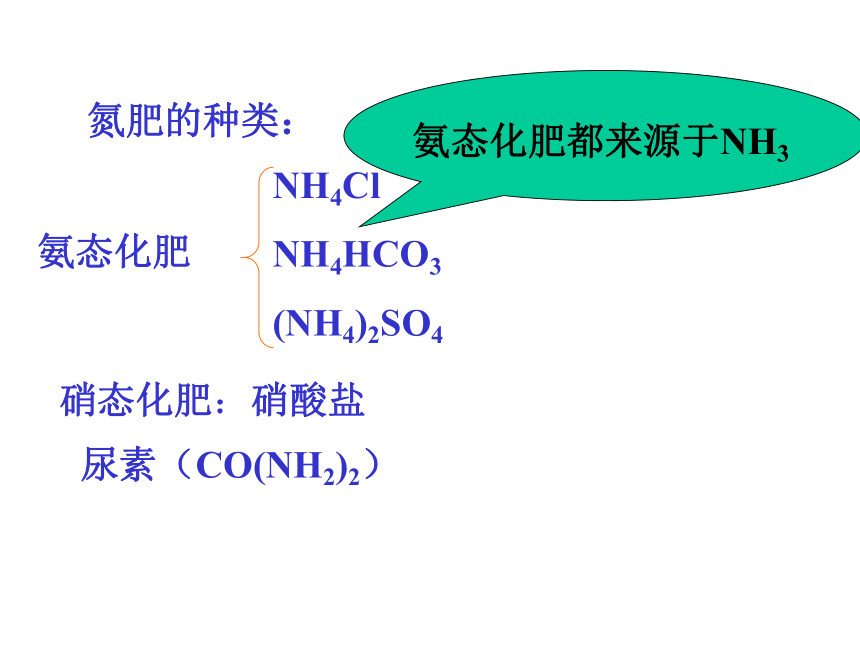
课件17张PPT。氮肥的生产和使用 消息1:湖南湘潭县农民喜获丰收!由于受粮食生产优惠政策和粮价走高的双重推动,加之化肥的合理使用,湖南省2005年晚稻预计总产量将达到97亿公斤,比2004年增加16亿公斤化 学 与 生 活氮肥的种类:硝态化肥:硝酸盐尿素(CO(NH2)2)氨的工业制法1、氨的物理性质(1) 色,有 气味的气体。无刺激性(2)密度比空气 小(3)易液化, 可用作 剂。致冷(4)极易溶于水。常温下,1体积水约能溶解 体积的氨。氨水的密度比水 ,且氨水浓度越大,其密度越 。700小小一、氨实验1
在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大----氨气的喷泉实验 演 示 实 验----氨气的喷泉实验 演 示 实 验(2)溶液为什么变为红色? (3)实验成败的关键是什么? (1)氨为什么会形成喷泉? a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。氨气溶于水溶液显碱性。 氨极易溶于水,使烧瓶内外形成较大的压差;城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?实验2
在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色的变化情况。实验现象 试纸变蓝
结论 氨水显碱性----氨气与水的反应 演 示 实 验3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+④氨水保存:①分析氨水的成份:③氨水的密度:②氨水的溶质:实验3
在一只烧杯中放两个棉花球,分别在两个棉花球上滴加几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。实验现象: 产生白烟 结论: 氨水具有挥发性,与挥发性酸发生反应 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3(3)氨跟氧气反应----催化氧化(接触氧化) 2NH3+3Cl2 == N2+6HCl (氨不足)8NH3+3Cl2 == N2+6NH4Cl (氨充足)(4) 氨与其它非金属反应 1.有A、B、C三种气体,A气体在一定条件下能与O2反应生成B;B不溶于水,但易与O2反应生成C;A、C气体皆易溶于水,所得的溶液相互反应生成盐和水,
则A是__,B是__ ,C是__。NH3NONO22、利用右图装置下列组合能形成明显喷泉
并充满烧瓶的是 3.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5% B、大于12.5%
C、小于12.5% D、无法确定C 4.标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,所得溶液的质量分数为_____,物质的量浓度是____。34.7%18.6 mol/l (1)氮肥4.用途:(3)化工原料(2)致冷剂无机:生产硝酸、铵盐和纯碱等有机:合成纤维、塑料、染料和尿素等生产硝酸原理:侯德榜制碱法:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大----氨气的喷泉实验 演 示 实 验----氨气的喷泉实验 演 示 实 验(2)溶液为什么变为红色? (3)实验成败的关键是什么? (1)氨为什么会形成喷泉? a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。氨气溶于水溶液显碱性。 氨极易溶于水,使烧瓶内外形成较大的压差;城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?实验2
在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色的变化情况。实验现象 试纸变蓝
结论 氨水显碱性----氨气与水的反应 演 示 实 验3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+④氨水保存:①分析氨水的成份:③氨水的密度:②氨水的溶质:实验3
在一只烧杯中放两个棉花球,分别在两个棉花球上滴加几滴浓氨水和浓盐酸,用表面皿盖住烧杯口,观察现象。实验现象: 产生白烟 结论: 氨水具有挥发性,与挥发性酸发生反应 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3(3)氨跟氧气反应----催化氧化(接触氧化) 2NH3+3Cl2 == N2+6HCl (氨不足)8NH3+3Cl2 == N2+6NH4Cl (氨充足)(4) 氨与其它非金属反应 1.有A、B、C三种气体,A气体在一定条件下能与O2反应生成B;B不溶于水,但易与O2反应生成C;A、C气体皆易溶于水,所得的溶液相互反应生成盐和水,
则A是__,B是__ ,C是__。NH3NONO22、利用右图装置下列组合能形成明显喷泉
并充满烧瓶的是 3.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5% B、大于12.5%
C、小于12.5% D、无法确定C 4.标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,所得溶液的质量分数为_____,物质的量浓度是____。34.7%18.6 mol/l (1)氮肥4.用途:(3)化工原料(2)致冷剂无机:生产硝酸、铵盐和纯碱等有机:合成纤维、塑料、染料和尿素等生产硝酸原理:侯德榜制碱法:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
