第三节 金属的腐蚀和保护
图片预览






文档简介
课件15张PPT。第三节 金属的腐蚀和保护高中化学(鲁教版)选修4 龙城中学 管延华
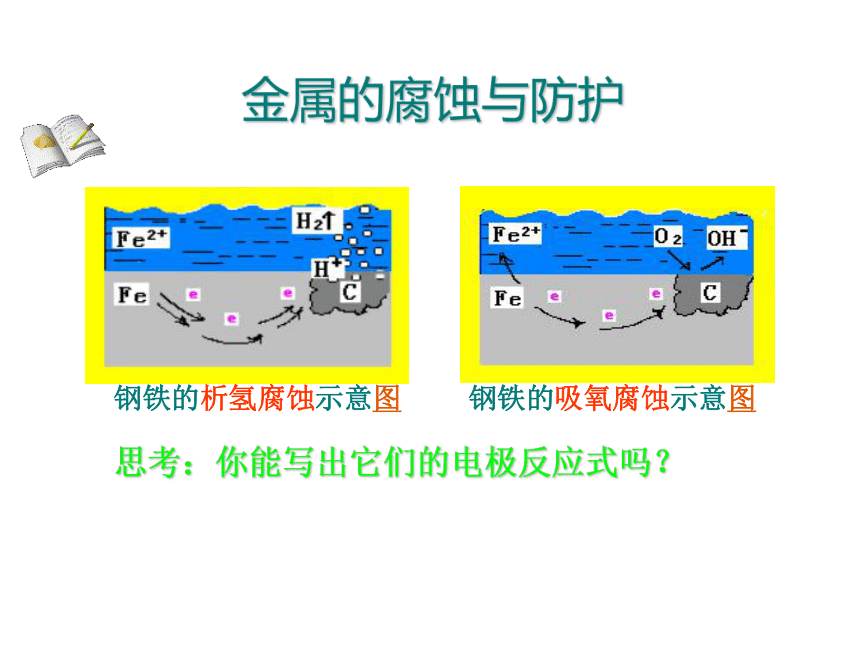
课堂板书金属的腐蚀与防护1.金属腐蚀:金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。2.金属腐蚀的类型:失e-氧化反应电化腐蚀(常见普遍)金属原子化学腐蚀3.金属腐蚀的本质:金属阳离子金属的腐蚀与防护联想.质疑 铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?金属的腐蚀与防护负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 , CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2CuCuFeFe2+2e-OH-后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3(Fe2O3 · nH2O)金属的腐蚀与防护负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 , CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3还可以将还原的电极(正极) 的电极反应写为: (Fe2O3 · nH2O)O2+4H++4e- =2H2O正极:(Cu)这两种写法反映了反应条件有什么区别?前者是在中性条件下而后者是在酸性条件下的反应金属的腐蚀与防护钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图思考:你能写出它们的电极反应式吗?金属的腐蚀与防护钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O金属的腐蚀与防护1、覆盖保护层衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆?思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr金属的腐蚀与防护思考:针对金属的电化学腐蚀,你能想出什么防止其腐蚀的办法?2、牺牲阳极的阴极保护法 原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应充当阳极,受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。金属的腐蚀与防护牺牲阳极的阴极保护法示意图思考:你还有什么方法可以防止铁闸门被腐蚀?金属的腐蚀与防护原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。3、阴极电保护法金属的腐蚀与防护1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,正极: 。 (2)若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,正极: 。中性或弱酸 吸氧Fe–2e-→Fe2+O2+2H2O+4e-→4OH-酸析氢Fe–2e-→Fe2+2H++2e-→H2↑ 金属的腐蚀与防护2.下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
。小结:防腐措施由好到坏的顺序是外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀(5) (2) (1) (3) (4)金属的腐蚀与防护下课啦!同学们,再见!
课堂板书金属的腐蚀与防护1.金属腐蚀:金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。2.金属腐蚀的类型:失e-氧化反应电化腐蚀(常见普遍)金属原子化学腐蚀3.金属腐蚀的本质:金属阳离子金属的腐蚀与防护联想.质疑 铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?金属的腐蚀与防护负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 , CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2CuCuFeFe2+2e-OH-后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3(Fe2O3 · nH2O)金属的腐蚀与防护负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 , CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3还可以将还原的电极(正极) 的电极反应写为: (Fe2O3 · nH2O)O2+4H++4e- =2H2O正极:(Cu)这两种写法反映了反应条件有什么区别?前者是在中性条件下而后者是在酸性条件下的反应金属的腐蚀与防护钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图思考:你能写出它们的电极反应式吗?金属的腐蚀与防护钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O金属的腐蚀与防护1、覆盖保护层衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆?思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr金属的腐蚀与防护思考:针对金属的电化学腐蚀,你能想出什么防止其腐蚀的办法?2、牺牲阳极的阴极保护法 原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应充当阳极,受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。金属的腐蚀与防护牺牲阳极的阴极保护法示意图思考:你还有什么方法可以防止铁闸门被腐蚀?金属的腐蚀与防护原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。3、阴极电保护法金属的腐蚀与防护1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,正极: 。 (2)若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,正极: 。中性或弱酸 吸氧Fe–2e-→Fe2+O2+2H2O+4e-→4OH-酸析氢Fe–2e-→Fe2+2H++2e-→H2↑ 金属的腐蚀与防护2.下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
。小结:防腐措施由好到坏的顺序是外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀(5) (2) (1) (3) (4)金属的腐蚀与防护下课啦!同学们,再见!
