铁和铜及其化合物的应用
图片预览










文档简介
课件54张PPT。铁和铜及其化合物的应用(1)在含有Fe3+的溶液中加入硫氰化钾(KSCN)溶液,溶液变成血红色
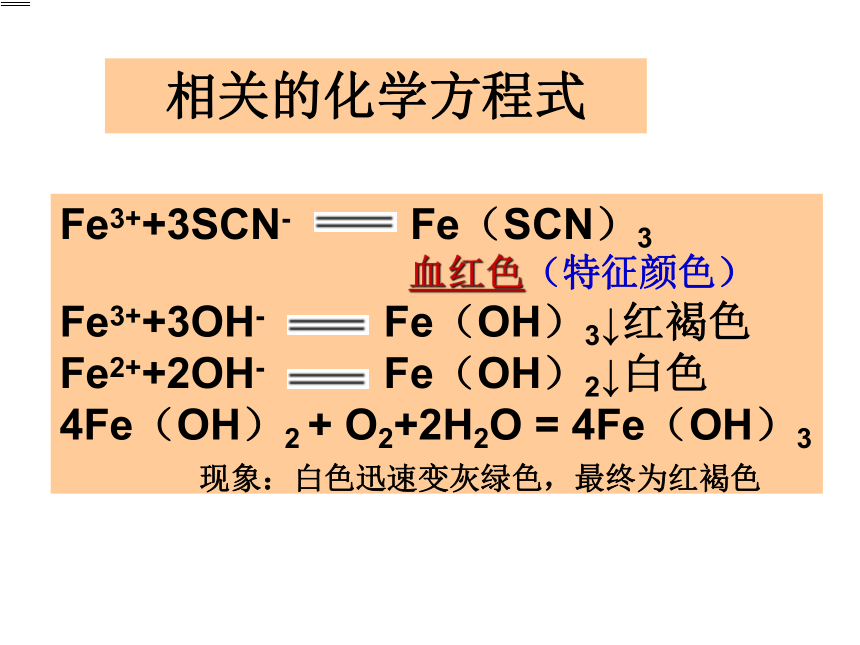
Fe3++3SCN- Fe(SCN)3请你设计实验方案:用不同的方法鉴别待检液A、B。实验室提供以下试剂:
待检液A、待检液B(FeCl3或FeCl2)0.5moL/LNaOH溶液、KSCN溶液探究实验一相关的化学方程式 Fe3++3SCN- Fe(SCN)3
血红色(特征颜色)
Fe3++3OH- Fe(OH)3↓红褐色
Fe2++2OH- Fe(OH)2↓白色
4Fe(OH)2 + O2+2H2O = 4Fe(OH)3
现象:白色迅速变灰绿色,最终为红褐色实验员小王的困惑实验目的:找出一种强氧化剂,将FeCl2转变成FeCl3,并验证这一转变 实验室提供以下试剂:
0.1mol/L FeCl3溶液(A溶液)、
0.1mol/L FeCl2溶液(B溶液)、 KSCN溶液、还原铁粉、新制氯水、淀粉KI试纸探究实验二Fe3++3SCN-
=
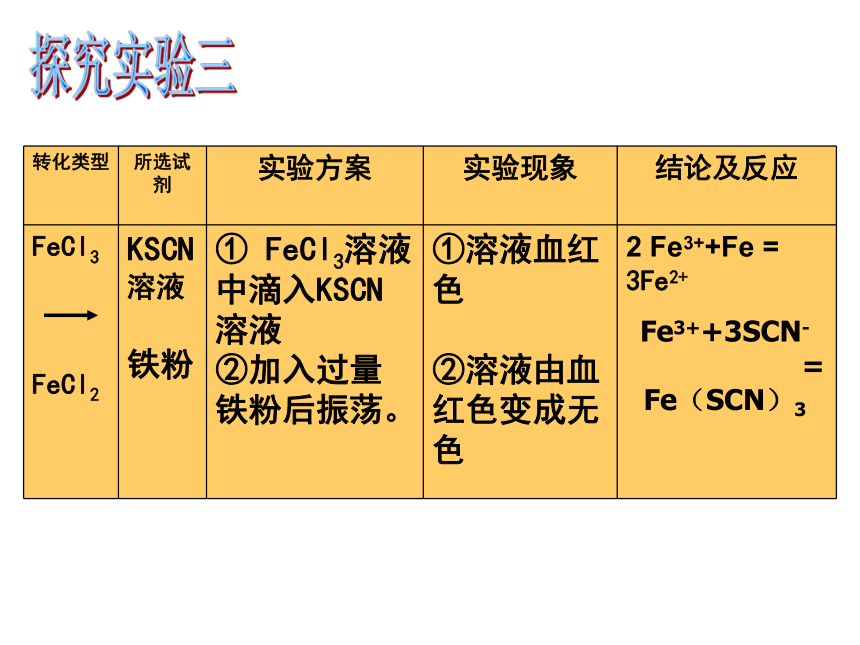
Fe(SCN)3探究实验二实验目的:找出一种还原剂,将FeCl3转变成FeCl2,并验证这一转变 实验室提供以下试剂:
0.1mol/L FeCl3溶液(A溶液)、
0.1mol/L FeCl2溶液(B溶液)、
KSCN溶液、还原铁粉、新制氯水、淀粉KI试纸探究实验三Fe3++3SCN-
=
Fe(SCN)3探究实验三电路板三、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。1.如何除去杂质,提纯下列各物质 讨论与思考足量铁粉足量Cl2或氯水足量铁粉2、苹果汁是人们喜爱的饮料,由于此饮料中含有,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )氧化性 B. 还原性 C. 碱性 D. 酸性B 讨论与思考3、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.氯水
C.硫酸锌 D.氯化铜 B 讨论与思考4、在配置Fe2+溶液时,常常需要向溶液中加入少量铁粉,
原因是 ;
离子方程式 。 讨论与思考5.某化工厂为消除所排出的废气中Cl2对环境的污染,
将含Cl2的废气通过含铁单质的FeCl2溶液中即可有效
地除去Cl2,这一处理过程可用化学方程式表示为:
。
处理过程中需要定期添加的原料是 。①2FeCl2+Cl2=2FeCl3 ② 2FeCl3+Fe=3FeCl2Fe 讨论与思考6、请将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是 。2∶3 讨论与思考小结与的鉴别一、Fe2+Fe3+与的相互转化二、三、铁及铜的化合物的应用练习:3、为什么说制备Fe(OH)2要用新制的的硫酸亚铁溶液?
原因:硫酸亚铁易被空气中的氧气氧化而影响效果。
4、怎样才能使Fe2+溶液长时间保存? 在配制溶液时,要加入铁钉或少量铁粉防止氧化,加入少量对应酸抑制水解。练习:[例5]用FeCl3溶液腐蚀印刷线路板(铜)。请写出离子方程式
,若想从废液中回收铜,应如何操作: 。将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是 。加入过量的铁粉后过滤,用磁铁吸取铁得到铜或用酸洗后水洗干燥 1、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4
③加入少量KSCN溶液( )①③ B. ③② C. ③① D. ①②③C2、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液( )A. ①③ B. ③② C. ③① D. ①②③C1、向某溶液中加入含的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )B用毛笔蘸取少量30%FeCl3溶液,在铜片上画一个十字,放置片刻后,用少量水将铜片上的溶液冲到小烧杯中。有什么现象?方程式?Cu + 2Fe3+= Cu2+ + 2Fe2+铜与Fe3+反应:活动与探究一、Fe2+与 Fe3+的鉴别观察溶液颜色与KSCN反应溶液变为血红色无明显现象与NaOH反应白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀浅绿色棕黄色 铁和铜及其
化合物的应用(2)问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色①用针筒吸取葡萄糖酸亚铁糖浆约1mL于试管1中。问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色
2、如何检验Fe3+ ?
②滴加5滴KSCN溶液,观察溶液颜色有无变化。 问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色2、如何检验Fe3+ ?
①在含Fe3+的溶液中滴加硫氰化钾KSCN)溶液,
溶液呈 _______色。
②在含Fe2+的溶液中滴加硫氰化钾溶液,
溶液呈_______色。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂?升高氧化剂常作氧化剂:H2O2、氯水;1问题二:如何实现Fe2+ Fe3+ 的转化? ③往上述溶液中逐滴加入适量双氧水或氯水,观察
溶液颜色变化,并分约一半液体于试管2中,备用。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂升高氧化剂降低还原剂常作氧化剂:H2O2、氯水;2问题二:如何实现Fe2+ Fe3+ 的转化? 、还原剂?常作还原剂:Fe粉、KI。④ 在试管2中加一药匙铁粉或一药匙KI固体,振荡
静置片刻, 观察溶液颜色变化,并与试管1对照 。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂升高氧化剂降低还原剂、还原剂?4、用简洁的语言归纳 Fe2+与 Fe3+ 相互转化的条件。问题二:如何实现Fe2+ Fe3+ 的转化? 问题三:根据Fe2+与Fe3+之间的相互转化。思考:(3)工业上铜印刷线路版是用溶液把铜溶解的,
你能解释原因吗? (2)在配制Fe2+溶液时加入少量铁粉,为什么?(1)“密封保存”,目的是?课堂小结实际应用实际应用1、在含有Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充
分反应后,固体残渣用盐酸处理有气体放出,则与
铁粉反应后的溶液中较多的离子是( )
A、Fe3+ B、Fe2+ C、Cu2+ D、H+B反馈与思考2、“葡萄糖酸亚铁与维生素C同服,可增加本品
的吸收”。推测维生素C有何性质?起何作用?
请设计实验验证你的猜想 …… 课后思考 “葡萄糖酸亚铁与维生素C同服,可增加本品
的吸收”。推测维生素C有何性质?起何作用?
请设计实验验证你的猜想 …… Fe2+ Fe3+实验方案:葡萄糖酸亚铁糖浆?Fe3+ Fe2+含Fe3+ 的溶液实验方案:专题3 从矿物到基础材料铁、铜及其化合物的应用(3)药补不如食补Fe + 2HCl = FeCl2 + H2↑Fe + CuSO4 = Cu + FeSO4知识链接溶液颜色Fe2+Fe3+浅绿色(棕)黄色与KSCN反应无明显变化溶液变血红色Fe3++3SCN- =Fe(SCN)3Fe3+特征反应氧化性还原性既有氧化性又有还原性只有氧化性Fe2+与Fe3+的比较观察与思考走进实验室:实验室有以下常用试剂:盐酸、HNO3、
稀硫酸、NaOH、NaCl、氯水、溴水、
Fe粉、Cu粉、KMnO4、双氧水1.你会选择哪些试剂?并说明
你的理由?
2.如何证明Fe3+生成了?
3.试剂添加顺序如何?Fe2+ Fe3+活动与探究:FeCl2溶液1~2mL溶液变血红色溶液变血红色溶液变血红色约1~2cm①胶头滴管不能混用;
②注意观察,记录好实验现象;
③试剂用量按照规定要求。活动与探究:血红色溶液充分振荡、静置后, 观察现象? ① 实验探究:
设计实验方案证明补铁口服液中铁的化合价?资料卡:
[主要原料]:乳酸亚铁、维生素C、白砂糖、柠檬酸、山梨酸钾、纯化水
[功效成分及含量]:每100mL含:铁 38.1mg、维生素C 223mg【生活小窍门】 “铁酱油”补血经济实用
目前,人们补铁除了食补就是服用含铁的保健品。食用铁强化酱油物美价廉,含铁酱油比不含铁酱油只贵几角或一元多。以一瓶1.5升含铁酱油为例,售价为 9.7元,七岁以下的儿童每天摄入仅15毫升铁强化酱油,就能获得36%每天所需的铁。因此,有关专家认为,铁强化酱油系最佳的大众补血剂。其产品上都贴有中国疾控中心和中国调味品协会授权使用的标识。
FeCl3的应用:制作印刷电路板制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。Fe2O3可作油漆的颜料;FeCl3、FeSO4是优良的净水剂;Fe3O4可作磁性材料,是炼铁的原料;资料卡:铁的化合物的应用FeCl3可以使血液凝固作止血剂;……1、能与Fe3+反应且能证明Fe3+具有氧化性的物质是:
①KSCN②Fe③FeCl2④NaOH( )
A.④ B. ① C. ③ D. ②2、某溶液中加入KSCN溶液无明显现象,再滴加氯水,
溶液立即变为红色,说明原溶液中一定含有( )
A.Fe3+ B. Fe2+ C. Cu2+ D. Al3+
BD课堂练习4、把铁片投入下列溶液中,铁片质量减小,且没有
气体产生,此溶液是(?? )
A、FeSO4 B、H2SO4
C、Fe2(SO4)3 D、AgNO3 ? C3、要证明某溶液中不含Fe3+而可能含有Fe2+, 进行如下实验操作时最佳顺序为( )
?加入足量氯水?加入足量KMnO4?加入少量KSCN溶液
A. ①③ B. ③② C. ③① D. ①②③
C课堂练习调查研究: 在工业生产中为除去废水中的Fe2+,常先将废水中的Fe2+氧化为Fe3+,再调节溶液的pH使Fe3+转化为红褐色的沉淀除去,这是为什么?课后作业
Fe3++3SCN- Fe(SCN)3请你设计实验方案:用不同的方法鉴别待检液A、B。实验室提供以下试剂:
待检液A、待检液B(FeCl3或FeCl2)0.5moL/LNaOH溶液、KSCN溶液探究实验一相关的化学方程式 Fe3++3SCN- Fe(SCN)3
血红色(特征颜色)
Fe3++3OH- Fe(OH)3↓红褐色
Fe2++2OH- Fe(OH)2↓白色
4Fe(OH)2 + O2+2H2O = 4Fe(OH)3
现象:白色迅速变灰绿色,最终为红褐色实验员小王的困惑实验目的:找出一种强氧化剂,将FeCl2转变成FeCl3,并验证这一转变 实验室提供以下试剂:
0.1mol/L FeCl3溶液(A溶液)、
0.1mol/L FeCl2溶液(B溶液)、 KSCN溶液、还原铁粉、新制氯水、淀粉KI试纸探究实验二Fe3++3SCN-
=
Fe(SCN)3探究实验二实验目的:找出一种还原剂,将FeCl3转变成FeCl2,并验证这一转变 实验室提供以下试剂:
0.1mol/L FeCl3溶液(A溶液)、
0.1mol/L FeCl2溶液(B溶液)、
KSCN溶液、还原铁粉、新制氯水、淀粉KI试纸探究实验三Fe3++3SCN-
=
Fe(SCN)3探究实验三电路板三、铁及铜的化合物的应用1、铁的化合物①Fe2O3作颜料②氯化铁、硫酸亚铁可作净水剂③作磁性材料④维持生命的微量元素2、铜的化合物:铜盐可杀菌,CuSO4溶液杀灭寄生虫,治疗皮肤病。1.如何除去杂质,提纯下列各物质 讨论与思考足量铁粉足量Cl2或氯水足量铁粉2、苹果汁是人们喜爱的饮料,由于此饮料中含有,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )氧化性 B. 还原性 C. 碱性 D. 酸性B 讨论与思考3、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.氯水
C.硫酸锌 D.氯化铜 B 讨论与思考4、在配置Fe2+溶液时,常常需要向溶液中加入少量铁粉,
原因是 ;
离子方程式 。 讨论与思考5.某化工厂为消除所排出的废气中Cl2对环境的污染,
将含Cl2的废气通过含铁单质的FeCl2溶液中即可有效
地除去Cl2,这一处理过程可用化学方程式表示为:
。
处理过程中需要定期添加的原料是 。①2FeCl2+Cl2=2FeCl3 ② 2FeCl3+Fe=3FeCl2Fe 讨论与思考6、请将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是 。2∶3 讨论与思考小结与的鉴别一、Fe2+Fe3+与的相互转化二、三、铁及铜的化合物的应用练习:3、为什么说制备Fe(OH)2要用新制的的硫酸亚铁溶液?
原因:硫酸亚铁易被空气中的氧气氧化而影响效果。
4、怎样才能使Fe2+溶液长时间保存? 在配制溶液时,要加入铁钉或少量铁粉防止氧化,加入少量对应酸抑制水解。练习:[例5]用FeCl3溶液腐蚀印刷线路板(铜)。请写出离子方程式
,若想从废液中回收铜,应如何操作: 。将适量的铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是 。加入过量的铁粉后过滤,用磁铁吸取铁得到铜或用酸洗后水洗干燥 1、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4
③加入少量KSCN溶液( )①③ B. ③② C. ③① D. ①②③C2、要证明某溶液中不含 练习:而可能含有,进行如下实验操作时最佳顺序为①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液( )A. ①③ B. ③② C. ③① D. ①②③C1、向某溶液中加入含的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是 ( )B用毛笔蘸取少量30%FeCl3溶液,在铜片上画一个十字,放置片刻后,用少量水将铜片上的溶液冲到小烧杯中。有什么现象?方程式?Cu + 2Fe3+= Cu2+ + 2Fe2+铜与Fe3+反应:活动与探究一、Fe2+与 Fe3+的鉴别观察溶液颜色与KSCN反应溶液变为血红色无明显现象与NaOH反应白色沉淀迅速变灰
绿色最后呈红褐色立即产生红
褐色沉淀浅绿色棕黄色 铁和铜及其
化合物的应用(2)问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色①用针筒吸取葡萄糖酸亚铁糖浆约1mL于试管1中。问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色
2、如何检验Fe3+ ?
②滴加5滴KSCN溶液,观察溶液颜色有无变化。 问题一:如何检验“葡萄糖酸亚铁糖浆”中含Fe2+ ?1、观察:含Fe2+的溶液呈_______色
含Fe3+的溶液呈_______色2、如何检验Fe3+ ?
①在含Fe3+的溶液中滴加硫氰化钾KSCN)溶液,
溶液呈 _______色。
②在含Fe2+的溶液中滴加硫氰化钾溶液,
溶液呈_______色。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂?升高氧化剂常作氧化剂:H2O2、氯水;1问题二:如何实现Fe2+ Fe3+ 的转化? ③往上述溶液中逐滴加入适量双氧水或氯水,观察
溶液颜色变化,并分约一半液体于试管2中,备用。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂升高氧化剂降低还原剂常作氧化剂:H2O2、氯水;2问题二:如何实现Fe2+ Fe3+ 的转化? 、还原剂?常作还原剂:Fe粉、KI。④ 在试管2中加一药匙铁粉或一药匙KI固体,振荡
静置片刻, 观察溶液颜色变化,并与试管1对照 。 2、你能在所提供的药品中寻找哪些物质可作常见的
氧化剂升高氧化剂降低还原剂、还原剂?4、用简洁的语言归纳 Fe2+与 Fe3+ 相互转化的条件。问题二:如何实现Fe2+ Fe3+ 的转化? 问题三:根据Fe2+与Fe3+之间的相互转化。思考:(3)工业上铜印刷线路版是用溶液把铜溶解的,
你能解释原因吗? (2)在配制Fe2+溶液时加入少量铁粉,为什么?(1)“密封保存”,目的是?课堂小结实际应用实际应用1、在含有Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充
分反应后,固体残渣用盐酸处理有气体放出,则与
铁粉反应后的溶液中较多的离子是( )
A、Fe3+ B、Fe2+ C、Cu2+ D、H+B反馈与思考2、“葡萄糖酸亚铁与维生素C同服,可增加本品
的吸收”。推测维生素C有何性质?起何作用?
请设计实验验证你的猜想 …… 课后思考 “葡萄糖酸亚铁与维生素C同服,可增加本品
的吸收”。推测维生素C有何性质?起何作用?
请设计实验验证你的猜想 …… Fe2+ Fe3+实验方案:葡萄糖酸亚铁糖浆?Fe3+ Fe2+含Fe3+ 的溶液实验方案:专题3 从矿物到基础材料铁、铜及其化合物的应用(3)药补不如食补Fe + 2HCl = FeCl2 + H2↑Fe + CuSO4 = Cu + FeSO4知识链接溶液颜色Fe2+Fe3+浅绿色(棕)黄色与KSCN反应无明显变化溶液变血红色Fe3++3SCN- =Fe(SCN)3Fe3+特征反应氧化性还原性既有氧化性又有还原性只有氧化性Fe2+与Fe3+的比较观察与思考走进实验室:实验室有以下常用试剂:盐酸、HNO3、
稀硫酸、NaOH、NaCl、氯水、溴水、
Fe粉、Cu粉、KMnO4、双氧水1.你会选择哪些试剂?并说明
你的理由?
2.如何证明Fe3+生成了?
3.试剂添加顺序如何?Fe2+ Fe3+活动与探究:FeCl2溶液1~2mL溶液变血红色溶液变血红色溶液变血红色约1~2cm①胶头滴管不能混用;
②注意观察,记录好实验现象;
③试剂用量按照规定要求。活动与探究:血红色溶液充分振荡、静置后, 观察现象? ① 实验探究:
设计实验方案证明补铁口服液中铁的化合价?资料卡:
[主要原料]:乳酸亚铁、维生素C、白砂糖、柠檬酸、山梨酸钾、纯化水
[功效成分及含量]:每100mL含:铁 38.1mg、维生素C 223mg【生活小窍门】 “铁酱油”补血经济实用
目前,人们补铁除了食补就是服用含铁的保健品。食用铁强化酱油物美价廉,含铁酱油比不含铁酱油只贵几角或一元多。以一瓶1.5升含铁酱油为例,售价为 9.7元,七岁以下的儿童每天摄入仅15毫升铁强化酱油,就能获得36%每天所需的铁。因此,有关专家认为,铁强化酱油系最佳的大众补血剂。其产品上都贴有中国疾控中心和中国调味品协会授权使用的标识。
FeCl3的应用:制作印刷电路板制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。Fe2O3可作油漆的颜料;FeCl3、FeSO4是优良的净水剂;Fe3O4可作磁性材料,是炼铁的原料;资料卡:铁的化合物的应用FeCl3可以使血液凝固作止血剂;……1、能与Fe3+反应且能证明Fe3+具有氧化性的物质是:
①KSCN②Fe③FeCl2④NaOH( )
A.④ B. ① C. ③ D. ②2、某溶液中加入KSCN溶液无明显现象,再滴加氯水,
溶液立即变为红色,说明原溶液中一定含有( )
A.Fe3+ B. Fe2+ C. Cu2+ D. Al3+
BD课堂练习4、把铁片投入下列溶液中,铁片质量减小,且没有
气体产生,此溶液是(?? )
A、FeSO4 B、H2SO4
C、Fe2(SO4)3 D、AgNO3 ? C3、要证明某溶液中不含Fe3+而可能含有Fe2+, 进行如下实验操作时最佳顺序为( )
?加入足量氯水?加入足量KMnO4?加入少量KSCN溶液
A. ①③ B. ③② C. ③① D. ①②③
C课堂练习调查研究: 在工业生产中为除去废水中的Fe2+,常先将废水中的Fe2+氧化为Fe3+,再调节溶液的pH使Fe3+转化为红褐色的沉淀除去,这是为什么?课后作业
