离子反应
图片预览






文档简介
课件18张PPT。 龙城中学 管延华
离子反应1、了解离子反应的应用:
① 定性检验;
② 定量测定;
2、理解酸碱中和滴定的原理和方法 3、掌握滴定的操作,掌握实验基本操作规范。大田一中 陈捷羡 ① 污水如果含有OH- 该如何检验?酚酞或PH试纸 污水如果含有OH-该含量如何测定?酸碱中和滴定法 实质:H++ OH-=H2O称沉淀演示:用胶头滴管往盛有一定体积未知浓度氢氧化钠溶液锥形瓶滴加已知浓度盐酸 。1、何时停止滴加HCl?
2、滴入盐酸量能不能确定?
3、一定体积的氢氧化钠该用何种仪器准确量取? 思考
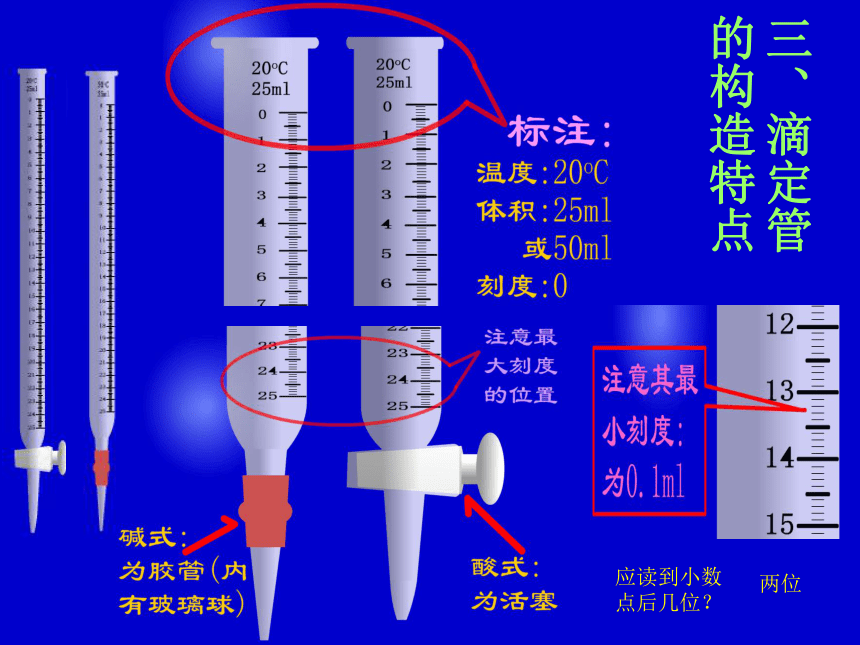
1、滴定管有几种?有什么区别?分别盛放什么溶液?滴定管上有什么标注?0刻线位置在儿?最小刻度是多少?读到小数点后几位?让我
好好想想
???三、滴定管 的构造特点应读到小数点后几位?两位酸碱中和滴定如何用0.1000mol/L的盐酸标准溶液测定未知浓度的NaOH溶液,设计实验方案分析原理:HCl +NaOH=NaCl+H2O方案: 量取一定体积的未知浓度的氢氧化钠溶液于锥形瓶中并滴入2~3滴酚酞,然后滴入已知浓度的盐酸溶液至恰好完全中和,测出消耗盐酸溶液体积,即可计算出未知氢氧化钠的浓度 [仪器]主要仪器: 铁架台 滴定管夹 滴定管 锥形瓶
烧杯等[指示剂]酚酞[过程]滴定前:查漏-洗涤-润洗-除气 泡-调夜面-记刻度V1滴定:左控塞、右转瓶、眼观色变和流速、30S不变记刻度V2
例 上述酸碱中和滴定的实验数据如下表所示,试通过计算确定NaOH的物质的量浓度。[计算]解:10.10 m L +10.00 m L +9.90 m L3== 0.1000mol/L答:测得NaOH的物质的量浓度为0.1000mol/L。10.00m L1、定性检验-离子特征反应
2、定量测定
[课堂小结]二、离子反应的应用回忆一下练一练练1:50ml的滴定管盛有溶液,液面恰好在20.0处,若把滴定管中溶液全部排出,则体积( )
A、等于30ml,B、等于20ml,
C、大于30 ml,D、小于30ml 练2:量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒,B.100mL量筒 C.50mL酸式滴定管 , D.50mL碱式滴定管
课后作业 总结一些常见离子的检验并设计实验方案,同时预习物质制备与纯化和生活中常见的离子反应 谢谢指导
离子反应1、了解离子反应的应用:
① 定性检验;
② 定量测定;
2、理解酸碱中和滴定的原理和方法 3、掌握滴定的操作,掌握实验基本操作规范。大田一中 陈捷羡 ① 污水如果含有OH- 该如何检验?酚酞或PH试纸 污水如果含有OH-该含量如何测定?酸碱中和滴定法 实质:H++ OH-=H2O称沉淀演示:用胶头滴管往盛有一定体积未知浓度氢氧化钠溶液锥形瓶滴加已知浓度盐酸 。1、何时停止滴加HCl?
2、滴入盐酸量能不能确定?
3、一定体积的氢氧化钠该用何种仪器准确量取? 思考
1、滴定管有几种?有什么区别?分别盛放什么溶液?滴定管上有什么标注?0刻线位置在儿?最小刻度是多少?读到小数点后几位?让我
好好想想
???三、滴定管 的构造特点应读到小数点后几位?两位酸碱中和滴定如何用0.1000mol/L的盐酸标准溶液测定未知浓度的NaOH溶液,设计实验方案分析原理:HCl +NaOH=NaCl+H2O方案: 量取一定体积的未知浓度的氢氧化钠溶液于锥形瓶中并滴入2~3滴酚酞,然后滴入已知浓度的盐酸溶液至恰好完全中和,测出消耗盐酸溶液体积,即可计算出未知氢氧化钠的浓度 [仪器]主要仪器: 铁架台 滴定管夹 滴定管 锥形瓶
烧杯等[指示剂]酚酞[过程]滴定前:查漏-洗涤-润洗-除气 泡-调夜面-记刻度V1滴定:左控塞、右转瓶、眼观色变和流速、30S不变记刻度V2
例 上述酸碱中和滴定的实验数据如下表所示,试通过计算确定NaOH的物质的量浓度。[计算]解:10.10 m L +10.00 m L +9.90 m L3== 0.1000mol/L答:测得NaOH的物质的量浓度为0.1000mol/L。10.00m L1、定性检验-离子特征反应
2、定量测定
[课堂小结]二、离子反应的应用回忆一下练一练练1:50ml的滴定管盛有溶液,液面恰好在20.0处,若把滴定管中溶液全部排出,则体积( )
A、等于30ml,B、等于20ml,
C、大于30 ml,D、小于30ml 练2:量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒,B.100mL量筒 C.50mL酸式滴定管 , D.50mL碱式滴定管
课后作业 总结一些常见离子的检验并设计实验方案,同时预习物质制备与纯化和生活中常见的离子反应 谢谢指导
