弱电解质的电离 盐类的水解(第二课时)
图片预览





文档简介
课件15张PPT。第2节 弱电解质的电离 盐类的水解(第二课时) 龙城中学 管延华
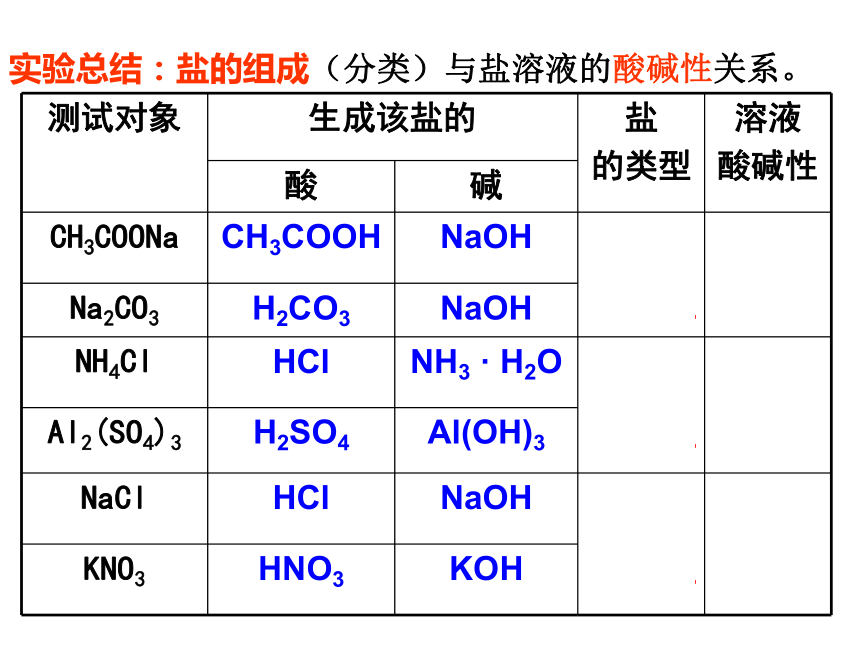
知识回顾1.水的电离影响因素有哪些?3.常温下溶液的酸碱性与pH的关系?2.溶液的酸碱性由什么决定?<7<7=7=7>7>7 【活动与探究】P82检测下列溶液的酸碱性 , 填写下表:强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
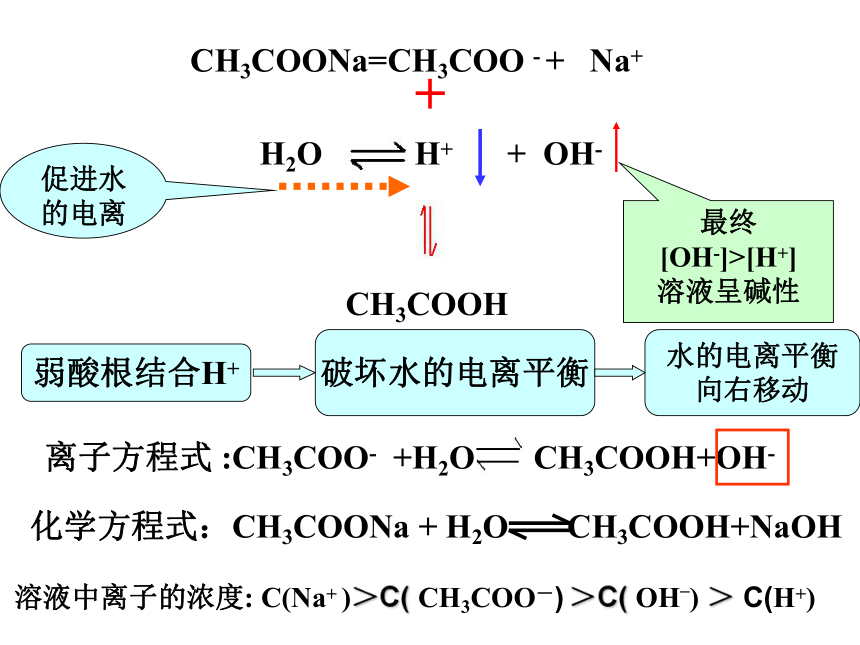
强酸盐中性实验总结:盐的组成(分类)与盐溶液的酸碱性关系。请思考1、CH3COOH是什么类型的电解质? 它在水中以什么形式存在?2、CH3COONa水溶液中存在哪些微粒?这些微粒能相互反应吗?若反应,结果怎么样?H2O H+ + OH- CH3COONa=CH3COO - + Na+
最终
[OH-]>[H+]
溶液呈碱性溶液中离子的浓度: C(Na+ )>C( CH3COO-) >C( OH_) > C(H+) NH4Cl = NH4+ + Cl-
+
H2O OH- + H+
NH3·H2O 水解离子方程式:NH4+ + H2O NH3·H2O + H+最终
[H+]>[OH-]
溶液呈酸性促进水的电离溶液中离子浓度: C(Cl-) >C(NH4+ )>C( H+ )> C(OH-)一. 盐类的水解 ⒈定义:在溶液中__电离出来的离子跟__所电离出来的__或____结合生成________的反应,叫做盐类的水解。盐水H+OH-弱电解质弱酸根离子
或弱碱阳离子⒉对概念的理解①水解条件:盐能电离出弱酸根离子或弱
碱阳离子
③水解的结果:生成弱电解质。②水解的实质:破坏了水的电离平衡, 促进
了水的电离。④水解反应与中和反应的关系:酸+碱 盐+水中和水解⑤特点:中和反应进行的程度较大,是放热反应;
水解反应进行的程度较小,是吸热反应。(酸或碱必须有一者是弱的)3. 盐类水解的规律水解水解
不水解
弱碱
阳离子弱酸
阴离子无
弱碱
弱酸
无
酸性碱性中性
无弱不水解。谁强显谁性,同强显中性。有弱才水解,—条件—结果弱酸阴离子或
弱碱阳离子二、水解平衡的影响因素1、内因:盐的本性其酸性越弱酸越难电离酸根离子与H+的
结 合 能 力 越 强酸根离子越易水解溶液碱性越强pH越大越弱越水解影响盐类水解的因素有哪些?1、已知CH3COOH的酸性强于HCN,等浓度的CH3COONa溶液 与 NaCN溶液水解程度是否相同?哪个PH大?练习:1.相同浓度的下列溶液,PH由大到小的顺序是: ①NaClO ② NaHCO3 ③CH3COONa ④NaOH
若相同PH,其浓度的大小关系呢? 2、相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。HX>HY>HZ2、填表:CH3COONa溶液中存在以下水解平衡:CH3COO-+H2O CH3COOH+OH-,改变下列条件,填写变化情况:向右增大增大向右减小减小向右减小增大向右减小减小向左向左增大增大增大减小向右减小减小2、外界条件(外因):(1)浓度:加水稀释,促进水解
(2)温度:温度升高,促进水解
(3)外加酸、碱:
加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ;
加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。
--- 浓度、温度及溶液酸碱性越热越水解越稀越水解
知识回顾1.水的电离影响因素有哪些?3.常温下溶液的酸碱性与pH的关系?2.溶液的酸碱性由什么决定?<7<7=7=7>7>7 【活动与探究】P82检测下列溶液的酸碱性 , 填写下表:强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
强酸盐中性实验总结:盐的组成(分类)与盐溶液的酸碱性关系。请思考1、CH3COOH是什么类型的电解质? 它在水中以什么形式存在?2、CH3COONa水溶液中存在哪些微粒?这些微粒能相互反应吗?若反应,结果怎么样?H2O H+ + OH- CH3COONa=CH3COO - + Na+
最终
[OH-]>[H+]
溶液呈碱性溶液中离子的浓度: C(Na+ )>C( CH3COO-) >C( OH_) > C(H+) NH4Cl = NH4+ + Cl-
+
H2O OH- + H+
NH3·H2O 水解离子方程式:NH4+ + H2O NH3·H2O + H+最终
[H+]>[OH-]
溶液呈酸性促进水的电离溶液中离子浓度: C(Cl-) >C(NH4+ )>C( H+ )> C(OH-)一. 盐类的水解 ⒈定义:在溶液中__电离出来的离子跟__所电离出来的__或____结合生成________的反应,叫做盐类的水解。盐水H+OH-弱电解质弱酸根离子
或弱碱阳离子⒉对概念的理解①水解条件:盐能电离出弱酸根离子或弱
碱阳离子
③水解的结果:生成弱电解质。②水解的实质:破坏了水的电离平衡, 促进
了水的电离。④水解反应与中和反应的关系:酸+碱 盐+水中和水解⑤特点:中和反应进行的程度较大,是放热反应;
水解反应进行的程度较小,是吸热反应。(酸或碱必须有一者是弱的)3. 盐类水解的规律水解水解
不水解
弱碱
阳离子弱酸
阴离子无
弱碱
弱酸
无
酸性碱性中性
无弱不水解。谁强显谁性,同强显中性。有弱才水解,—条件—结果弱酸阴离子或
弱碱阳离子二、水解平衡的影响因素1、内因:盐的本性其酸性越弱酸越难电离酸根离子与H+的
结 合 能 力 越 强酸根离子越易水解溶液碱性越强pH越大越弱越水解影响盐类水解的因素有哪些?1、已知CH3COOH的酸性强于HCN,等浓度的CH3COONa溶液 与 NaCN溶液水解程度是否相同?哪个PH大?练习:1.相同浓度的下列溶液,PH由大到小的顺序是: ①NaClO ② NaHCO3 ③CH3COONa ④NaOH
若相同PH,其浓度的大小关系呢? 2、相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。HX>HY>HZ2、填表:CH3COONa溶液中存在以下水解平衡:CH3COO-+H2O CH3COOH+OH-,改变下列条件,填写变化情况:向右增大增大向右减小减小向右减小增大向右减小减小向左向左增大增大增大减小向右减小减小2、外界条件(外因):(1)浓度:加水稀释,促进水解
(2)温度:温度升高,促进水解
(3)外加酸、碱:
加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ;
加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。
--- 浓度、温度及溶液酸碱性越热越水解越稀越水解
