乙酸羧酸
图片预览






文档简介
课件23张PPT。羧酸R-COOH教学目标:1.掌握乙酸的分子结构主要化学性质
2.了解乙酸的工业制法和用途
3.了解羧酸的分类和命名
4.了解乙酸和羧酸性质上的异同
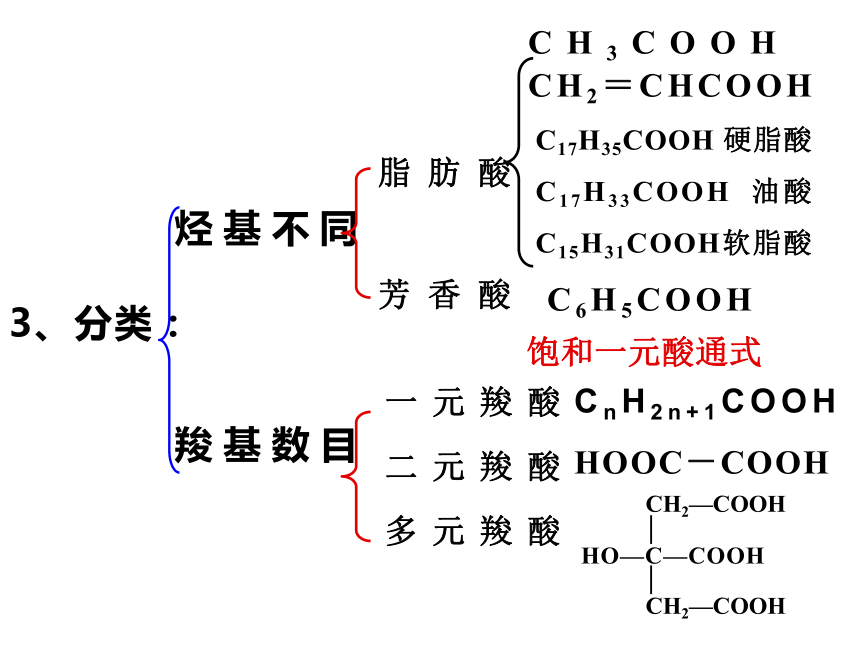
重点: 乙酸的分子结构和化学性质⑴甲酸:HCOOH (蚁酸)⑵苯甲酸:C6H5COOH (安息香酸)⑶草酸:HOOC-COOH (乙二酸)⑷羟基酸:如柠檬酸:2、自然界中的有机酸⑸乳酸:羧酸由烃基(或氢原子)与羧基相连构成的有机化合物。1、定义:3、分类:烃基不同羧基数目芳香酸脂肪酸一元羧酸二元羧酸多元羧酸CH3COOHCH2=CHCOOHC17H35COOH 硬脂酸
C17H33COOH 油酸
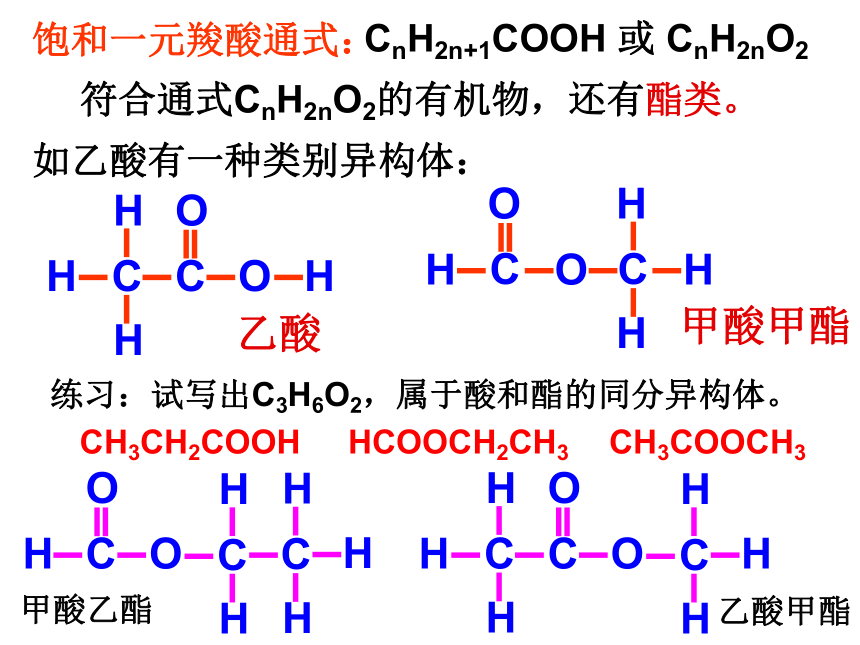
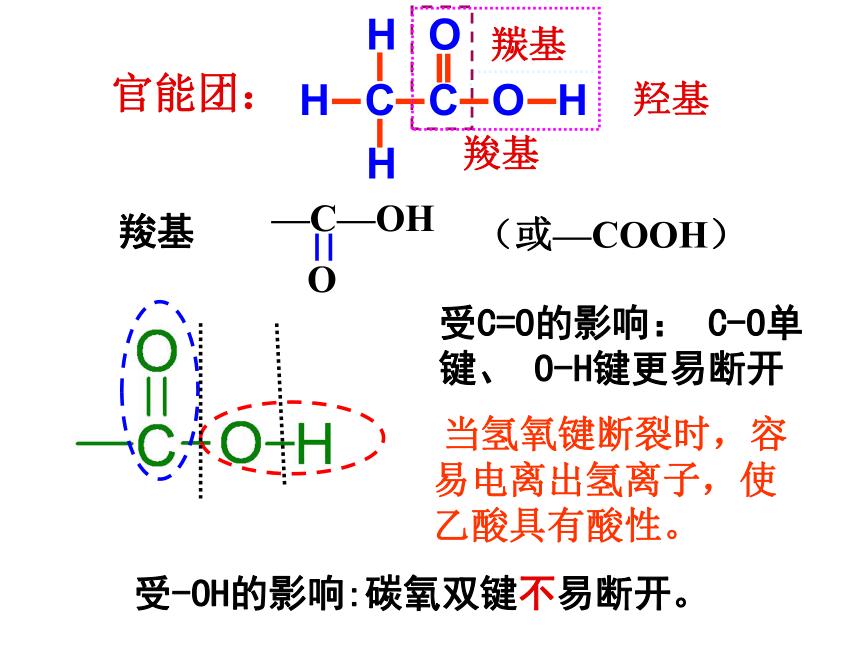
C15H31COOH软脂酸C6H5COOHHOOC-COOHCnH2n+1COOH饱和一元酸通式乙酸的物理性质:颜色状态:无色液体气味:有强烈刺激性气味沸点:117.9℃ (易挥发)熔点:16.6℃(无水乙酸又称为:冰醋酸)溶解性:易溶于水、乙醇等溶剂分子组成与结构C2H4O2CH3COOH结构简式:分子式:结构式:思考:试推测乙酸的1H-NMR谱图?强度比=3∶1CnH2n+1COOH 或 CnH2nO2饱和一元羧酸通式:符合通式CnH2nO2的有机物,还有酯类。如乙酸有一种类别异构体:乙酸甲酸甲酯练习:试写出C3H6O2,属于酸和酯的同分异构体。 HCOOCH2CH3CH3COOCH3CH3CH2COOH甲酸乙酯乙酸甲酯官能团:羟基羰基(或—COOH)羧基羧基
受C=O的影响: C-O单键、 O-H键更易断开受-OH的影响:碳氧双键不易断开。 当氢氧键断裂时,容易电离出氢离子,使乙酸具有酸性。D、与碱反应:E、与盐反应:C、与碱性氧化物反应:2CH3COOH + CaCO3 = Ca(CH3COO)2 + H2O + CO2↑2CH3COOH + Mg(OH)2 = Mg(CH3COO)2 + H2O2 CH3COOH + CuO = Cu(CH3COO)2 + H2O水垢主要成份:Mg(OH)2和CaCO3,故可用醋来除水垢。化学性质弱酸性:H2SO3>CH3COOH>H2CO3A、使酸碱指示剂变色:B、与活泼金属反应:2CH3COOH + Zn = Zn(CH3COO)2+ H2↑1. 酸的通性CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能能能不能不能能,得到CO2能,得到HCO3-醇、酚、羧酸中羟基的比较【知识归纳】C6H5ONa + CH3COOH → C6H5OH + CH3COONa思考:乙酸能否与苯酚钠反应,可以的话,写出方程式。能能C6H5OH + Na2CO3 → C6H5ONa + NaHCO3 1、化合物 跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na( )A、NaOH B、Na2CO3 C、NaHCO3 D、NaCl C【知识应用】2.确定乙酸是弱酸的依据是( )
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2B3、请写出反应产物:本质:酸脱羟基、醇脱氢。碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和Na2CO3溶液(防止暴沸)2、酯化反应乙酸乙酯酸和醇起作用,生成酯和水的反应。乙酸的酯化反应用同位素示踪法验证【知识回顾】5、得到的反应产物是否纯净?主要杂质有哪些?不纯净;乙酸、乙醇1、加药品顺序:2、加碎瓷片3、试管倾斜加热4、导管通到饱和Na2CO3溶液的液面上方——防暴沸——增大受热面积——防倒吸乙醇→浓硫酸→醋酸6、浓H2SO4的作用?8、为何用饱和的Na2CO3溶液吸收乙酸乙酯?①乙酸乙酯在无机盐溶液中溶解度减小,容易分层析出②吸收乙酸,溶解乙醇,便于闻到乙酸乙酯的香味催化剂、吸水剂7、长导管的作用?导气、冷凝2、 若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有 种。生成物中水的相对分子质量为 。201、 酯化反应属于( ).
A.中和反应 B.不可逆反应 C.离子反应 D.取代反应D【知识应用】3.下列物质中,不能与乙醇发生酯化反应的是( )
A.乙醛 B.硝酸 C.苯甲酸 D.硫酸 A4.关于乙酸的下列说法中不正确的是 ( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸D35.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
A.金属钠 B.溴水
C.碳酸钠溶液 D.紫色石蕊试液CD6.除去乙酸乙酯中含有的乙酸,最好的处理( )
A.蒸馏 B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液 D.用过量氢氧化钠溶液洗涤后分液C7.胆固醇是人体必需的生物活性物质,分子式为C25H45O,一种胆固醇酯是液晶材料,分子式为C32H49O2,合成这种胆固醇酯的酸是( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C6H5CH2COOHBC25H45O + 酸 → C32H49O2 + H2O1.由于乙酸乙酯沸点比乙酸、乙醇低,因此从反应物中不断蒸出乙酸乙酯,可提高其产率;
2.使用过量的乙醇,可提高乙酸转化为乙酸乙酯产率。
3.使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。 乙酸与乙醇的酯化反应是可逆的,实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?阅读 P83 信息提示根据化学平衡原理,提高乙酸乙醋产率措施有: 在可逆反应中,若改变化学平衡的条件,平衡会向削弱这种改变的方向移动。若此时中和掉H+离子,则H+浓度降低,平衡要削弱这种改变,所以,平衡会向右移动,即继续电离出H+。酸和醇酯化反应的类型①一元有机羧酸与一元醇。如:CH3COOCH3 + H2O乙酸甲酯②无机含氧酸与一元醇。如:C2H5O—NO2 + H2O硝酸乙酯③一元酸与二元醇或多元醇。如:二乙酸乙二酯+ 2H2O 环乙二酸乙二酯④高级脂肪酸与甘油形成油脂。如:⑤多元醇与多元羧酸分子间脱水形成环酯。如:硝化甘油硬脂酸甘油酯⑧多元羧酸与二元醇间缩聚成聚酯。如:⑥羟基酸分子间形成交酯。如:⑦羟基酸分子内脱水成环。如:聚对苯二甲酸乙二酯缩聚反应:有机物分子间脱去小分子,形成高分子聚合物的反应。酯的水解 酯化反应是可逆反应,这是因为在相同的条件下(酸性条件),酯会发生水解,得到相应的酸和醇。如:CH3COONa + HOC2H5三类重要的羧酸1、甲酸——俗称蚁酸结构特点:既有羧基又有醛基化学性质醛基羧基氧化反应酯化反应还原反应银镜反应、碱性新制Cu(OH)2与H2加成酸性P84 问题解决酸的通性与醇发生酯化反应HCOOCH2CH3 + H2O甲酸乙酯HCOOH + Na → 2 2 2 HCOONa + H2↑2、乙二酸——俗称草酸+ 2H2O② 饱和一元脂肪酸酸性随烃基碳原子数的增加而逐渐减弱。 酸性: ① 常见羧酸酸性强弱顺序:结构特点:分子内有两个羧基△乙二酸 > 甲酸 > 乙酸 > 丙酸2 HCOOH + Cu(OH)2 → Cu(HCOO)2 + 2H2O3、高级脂肪酸(1)酸性化学性质(2)酯化反应(3)油酸加成 练习2.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列关于产物的说法中,正确的是( )
A、18O只存在于乙酸乙酯中
B、18O只存在于水中
C、18O既存在于乙酸乙酯中,又存在于水中
D、生成的乙酸乙酯的相对分子质量为88A4 mol2 mol1 mol
2.了解乙酸的工业制法和用途
3.了解羧酸的分类和命名
4.了解乙酸和羧酸性质上的异同
重点: 乙酸的分子结构和化学性质⑴甲酸:HCOOH (蚁酸)⑵苯甲酸:C6H5COOH (安息香酸)⑶草酸:HOOC-COOH (乙二酸)⑷羟基酸:如柠檬酸:2、自然界中的有机酸⑸乳酸:羧酸由烃基(或氢原子)与羧基相连构成的有机化合物。1、定义:3、分类:烃基不同羧基数目芳香酸脂肪酸一元羧酸二元羧酸多元羧酸CH3COOHCH2=CHCOOHC17H35COOH 硬脂酸
C17H33COOH 油酸
C15H31COOH软脂酸C6H5COOHHOOC-COOHCnH2n+1COOH饱和一元酸通式乙酸的物理性质:颜色状态:无色液体气味:有强烈刺激性气味沸点:117.9℃ (易挥发)熔点:16.6℃(无水乙酸又称为:冰醋酸)溶解性:易溶于水、乙醇等溶剂分子组成与结构C2H4O2CH3COOH结构简式:分子式:结构式:思考:试推测乙酸的1H-NMR谱图?强度比=3∶1CnH2n+1COOH 或 CnH2nO2饱和一元羧酸通式:符合通式CnH2nO2的有机物,还有酯类。如乙酸有一种类别异构体:乙酸甲酸甲酯练习:试写出C3H6O2,属于酸和酯的同分异构体。 HCOOCH2CH3CH3COOCH3CH3CH2COOH甲酸乙酯乙酸甲酯官能团:羟基羰基(或—COOH)羧基羧基
受C=O的影响: C-O单键、 O-H键更易断开受-OH的影响:碳氧双键不易断开。 当氢氧键断裂时,容易电离出氢离子,使乙酸具有酸性。D、与碱反应:E、与盐反应:C、与碱性氧化物反应:2CH3COOH + CaCO3 = Ca(CH3COO)2 + H2O + CO2↑2CH3COOH + Mg(OH)2 = Mg(CH3COO)2 + H2O2 CH3COOH + CuO = Cu(CH3COO)2 + H2O水垢主要成份:Mg(OH)2和CaCO3,故可用醋来除水垢。化学性质弱酸性:H2SO3>CH3COOH>H2CO3A、使酸碱指示剂变色:B、与活泼金属反应:2CH3COOH + Zn = Zn(CH3COO)2+ H2↑1. 酸的通性CH3CH2OHC6H5OHCH3COOH增强中性比碳酸弱比碳酸强能能能不能不能能,得到CO2能,得到HCO3-醇、酚、羧酸中羟基的比较【知识归纳】C6H5ONa + CH3COOH → C6H5OH + CH3COONa思考:乙酸能否与苯酚钠反应,可以的话,写出方程式。能能C6H5OH + Na2CO3 → C6H5ONa + NaHCO3 1、化合物 跟足量的下列哪种物质的溶液反应可得到一钠盐C7H5O3Na( )A、NaOH B、Na2CO3 C、NaHCO3 D、NaCl C【知识应用】2.确定乙酸是弱酸的依据是( )
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2B3、请写出反应产物:本质:酸脱羟基、醇脱氢。碎瓷片
乙醇 3mL
浓硫酸 2mL
乙酸 2mL
饱和Na2CO3溶液(防止暴沸)2、酯化反应乙酸乙酯酸和醇起作用,生成酯和水的反应。乙酸的酯化反应用同位素示踪法验证【知识回顾】5、得到的反应产物是否纯净?主要杂质有哪些?不纯净;乙酸、乙醇1、加药品顺序:2、加碎瓷片3、试管倾斜加热4、导管通到饱和Na2CO3溶液的液面上方——防暴沸——增大受热面积——防倒吸乙醇→浓硫酸→醋酸6、浓H2SO4的作用?8、为何用饱和的Na2CO3溶液吸收乙酸乙酯?①乙酸乙酯在无机盐溶液中溶解度减小,容易分层析出②吸收乙酸,溶解乙醇,便于闻到乙酸乙酯的香味催化剂、吸水剂7、长导管的作用?导气、冷凝2、 若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有 种。生成物中水的相对分子质量为 。201、 酯化反应属于( ).
A.中和反应 B.不可逆反应 C.离子反应 D.取代反应D【知识应用】3.下列物质中,不能与乙醇发生酯化反应的是( )
A.乙醛 B.硝酸 C.苯甲酸 D.硫酸 A4.关于乙酸的下列说法中不正确的是 ( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸D35.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
A.金属钠 B.溴水
C.碳酸钠溶液 D.紫色石蕊试液CD6.除去乙酸乙酯中含有的乙酸,最好的处理( )
A.蒸馏 B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液 D.用过量氢氧化钠溶液洗涤后分液C7.胆固醇是人体必需的生物活性物质,分子式为C25H45O,一种胆固醇酯是液晶材料,分子式为C32H49O2,合成这种胆固醇酯的酸是( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C6H5CH2COOHBC25H45O + 酸 → C32H49O2 + H2O1.由于乙酸乙酯沸点比乙酸、乙醇低,因此从反应物中不断蒸出乙酸乙酯,可提高其产率;
2.使用过量的乙醇,可提高乙酸转化为乙酸乙酯产率。
3.使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。 乙酸与乙醇的酯化反应是可逆的,实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?阅读 P83 信息提示根据化学平衡原理,提高乙酸乙醋产率措施有: 在可逆反应中,若改变化学平衡的条件,平衡会向削弱这种改变的方向移动。若此时中和掉H+离子,则H+浓度降低,平衡要削弱这种改变,所以,平衡会向右移动,即继续电离出H+。酸和醇酯化反应的类型①一元有机羧酸与一元醇。如:CH3COOCH3 + H2O乙酸甲酯②无机含氧酸与一元醇。如:C2H5O—NO2 + H2O硝酸乙酯③一元酸与二元醇或多元醇。如:二乙酸乙二酯+ 2H2O 环乙二酸乙二酯④高级脂肪酸与甘油形成油脂。如:⑤多元醇与多元羧酸分子间脱水形成环酯。如:硝化甘油硬脂酸甘油酯⑧多元羧酸与二元醇间缩聚成聚酯。如:⑥羟基酸分子间形成交酯。如:⑦羟基酸分子内脱水成环。如:聚对苯二甲酸乙二酯缩聚反应:有机物分子间脱去小分子,形成高分子聚合物的反应。酯的水解 酯化反应是可逆反应,这是因为在相同的条件下(酸性条件),酯会发生水解,得到相应的酸和醇。如:CH3COONa + HOC2H5三类重要的羧酸1、甲酸——俗称蚁酸结构特点:既有羧基又有醛基化学性质醛基羧基氧化反应酯化反应还原反应银镜反应、碱性新制Cu(OH)2与H2加成酸性P84 问题解决酸的通性与醇发生酯化反应HCOOCH2CH3 + H2O甲酸乙酯HCOOH + Na → 2 2 2 HCOONa + H2↑2、乙二酸——俗称草酸+ 2H2O② 饱和一元脂肪酸酸性随烃基碳原子数的增加而逐渐减弱。 酸性: ① 常见羧酸酸性强弱顺序:结构特点:分子内有两个羧基△乙二酸 > 甲酸 > 乙酸 > 丙酸2 HCOOH + Cu(OH)2 → Cu(HCOO)2 + 2H2O3、高级脂肪酸(1)酸性化学性质(2)酯化反应(3)油酸加成 练习2.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列关于产物的说法中,正确的是( )
A、18O只存在于乙酸乙酯中
B、18O只存在于水中
C、18O既存在于乙酸乙酯中,又存在于水中
D、生成的乙酸乙酯的相对分子质量为88A4 mol2 mol1 mol
