2011届高考化学总复习课件系列 学案17 化学键
文档属性
| 名称 | 2011届高考化学总复习课件系列 学案17 化学键 |

|
|
| 格式 | rar | ||
| 文件大小 | 343.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-09 00:00:00 | ||
图片预览











文档简介
课件114张PPT。
学案17 化学键轻松学教材一?化学键:离子键?共价键
化学键定义:使1离子相结合或原子相结合的作用力
类型
离子键(1)定义:2带相反电荷离子之间的相互作用
(2)成键微粒:3阴?4阳离子
(3)成键实质:5静电作用(离子间的静电
吸引力与电子和电子之间?核与核之间的静
电排斥达到平衡)(4)形成条件:6活泼金属(ⅠA?ⅡA族)与7活泼非金属(ⅦA?ⅥA族)化合时,
一般形成离子键
(5)存在:所有的离子化合物中都有8离子键共价键(1)定义:原子间通过9共用电子对所形成的
相互作用
(2)成键微粒:10原子
(3)成键实质:原子间形成共用电子对,共用电子
对对核的静电11吸引与核间?电子间的静电
12排斥达到平衡
(4)形成条件:13同种或不同种非金属原子相结合
时,一般形成共价键(5)分类①14非极性共价键:两个相同非金属
原子间形成的共价键
②15极性共价键:两个不相同非金
属原子间形成的共价键
(6)存在①非金属单质(稀有气体除外)
②共价化合物
③含有复杂离子(如NH ?OH-?O ?
CO )的离子化合物
与化学反应的关系:化学反应的实质就是16旧化学键的
断裂和17新化学键形成的过程二?分子间作用力?氢键
1.
分子间作用力定义:把18分子聚集在一起的作用力,又称19范德华力
特点分子间作用力比化学键弱得多,它主要
影响物质的20熔点?21沸点?22溶解度
等物理性质
分子间作用力只存在于由共价键形成的
多数共价化合物和绝大多数气态非金
属单质分子以及稀有气体分子之间变化规律:一般来说,对于组成和结构相似的物
质,相对分子质量越大,分子间作用力23越大,
物质的熔沸点也24越高
2.氢键定义:25NH3?26H2O?27HF等分子之
间存在着一种比分子间作用力稍强
的相互作用,这种相互作用叫氢键
作用:分子间形成氢键会使物质的28熔点
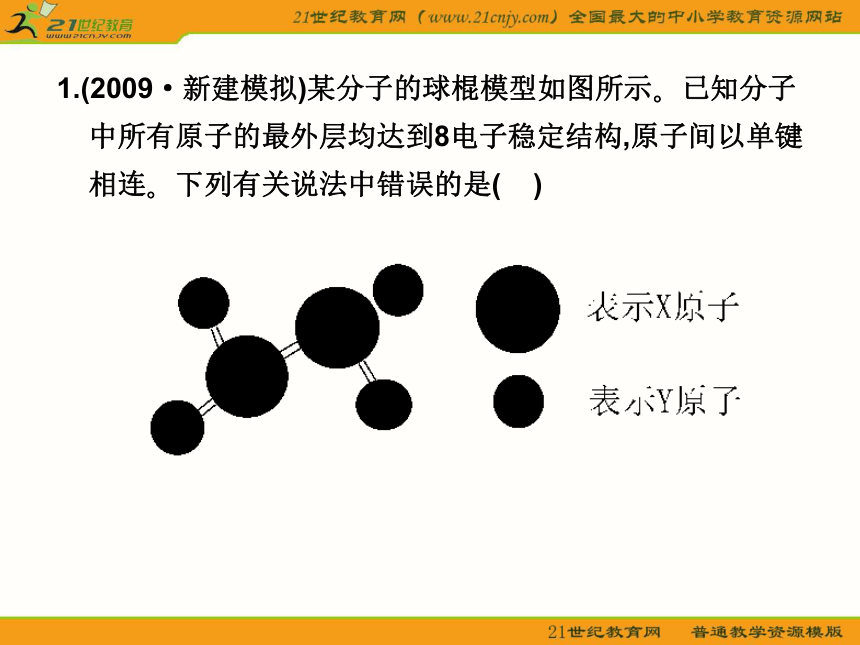
和29沸点升高体验热身 1.(2009·新建模拟)某分子的球棍模型如图所示?已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连?下列有关说法中错误的是( )A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
答案:B
解析:由该原子结构知Y原子最外层有一个或七个电子,Y原子为ⅠA族或ⅦA族元素,根据成键形式X原子最外层有五个电子或三个电子,故B错;F的半径小于N,故D正确?2.下列哪一组元素的原子间反应容易形成离子键( )A.a和c B.a和f
C.d和g D.b和g答案:BD解析:由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周期元素?a?b均为活泼的金属元素,f?g均为活泼的非金属元素,所以a与f,b与g间易形成离子键?3.现有如下各种说法:
①在水中氢?氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子?阴离子的相互吸引力
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键
⑤H2分子和Cl2分子的反应过程是H2?Cl2分子里共价键发生断裂生成H原子?Cl原子,而后H原子?Cl原子形成离子键的过程
上述各种说法正确的是( )A.①②⑤ B.都不正确 C.④ D.①
答案:B
解析:水中存在分子内H?O原子之间的相互作用,形成化学键,分子间的H?O原子的作用是分子间作用力(氢键),故①不对;离子键只有活泼金属和活泼非金属化合时才形成,故②不对;在离子化合物中,阴?阳离子间存在相互作用,不单指相互吸引,还有相互排斥,故③错误;HCl分子中不存在离子,属于共价化合物,分子中没有离子键,故④不正确;化学反应的本质是旧键断裂,新键形成的过程,但HCl中存在共价键而非离子键,故⑤不对?4.(2008·海南高考)HBr分子的电子式为( )答案:A解析:因为HBr分子为共价化合物分子,H?Br两种原子通过共用电子对成键,从而分析得出在HBr分子中不存在H+和
由此判断A正确,B?C错误;D项是HBr分子的结构式而非电子式,与题意不符?5.A?B?C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A?C同主族,B+核外有10个电子,则
(1)A?B?C元素分别是______?________?__________?
(2)A?B?C之间可形成多种化合物,其中属于离子化合物的化学式分别为
__________?__________?_______________________(任举三种)?
(3)用电子式表示B和C形成化合物的过程ONaSNa2O Na2O2 Na2S Na2SO4 Na2SO3 Na2S2O3(任选三种) 解析:B+核外有10个电子,则B为钠元素,A?C同主族且原子序数之和为35-11=24,故A为氧元素,C为硫元素?6.(2010·石家庄市质检一)
(1)元素甲是第三周期第ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A?写出A的电子式
__________________________________?
(2)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式____________________________________________?2F2+2H2O=4HF+O2 (3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是______________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式__________________________________?
(4)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式
_____________________________________________?r(Ca2+)(2)氢化物最稳定的是HF,乙元素为氟?
(3)常用于检验CO2存在的溶液是Ca(OH)2,丙为Ca,Ca2+?Cl-属于核外电子排布相同的微粒,半径大小取决于原子序数大小,原子序数越大,半径越小?
(4)第三周期中离子半径最小的元素为Al?重点探究 一?化学键
考查化学键的主要内容:化学键的分类;化学键的表示方法:电子式?结构式;化学键的强弱对物质性质的影响;化学键与化学反应?
1.要分清离子键?共价键的本质?含义及表示方法,明确化学键的意义,特别要弄清楚以下问题:
(1)由金属元素与非金属元素间形成的化学键不一定是离子键,如 AgCl?AlCl3等都是共价化合物?
(2)由阳离子和阴离子结合生成的化合物不一定是离子化合物,如H++OH-=H2O,2H++CO =CO2↑+H2O?(3)由两种共价分子结合生成的化合物也不一定不是离子化合物?如NH3+HCl=NH4Cl?
(4)有化学键被破坏的变化不见得是化学变化?如HCl溶于水,NaCl熔化等都有化学键被破坏,但都属于物理变化?
(5)用化学键强弱可解释物质的化学性质,也可解释物质的物理性质?根据不同的物质类型,有的物质发生物理变化要克服化学键?如金刚石?晶体硅熔点高低要用化学键强弱来解释?而HF?HCl?HBr?HI中的化学键强弱只能解释其化学性质,它们的物理性质与H—X键无关?2.离子键和共价键的比较【例1】下列反应过程中,同时有离子键?极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2解析:各反应中化学键断裂及形成的情况如下:A项,NH4Cl中无非极性共价键,NH3和HCl中只有极性共价键;B项,反应物中不存在离子键和非极性共价键,产物中不存在非极性共价键;C项,产物中不存在非极性键,CO2中存在极性共价键;产物Na2CO3中既存在离子键又存在极性共价键,O2中存在非极性共价键?
答案:D【方法归纳】 化学键的类型与物质的类别
(1)只含非极性共价键的物质,同种非金属元素组成的单质,如I2?N2?P4分子?金刚石?晶体硅等?
(2)只含有极性共价键的物质,一般是不同非金属元素组成的共价化合物,如HCl?NH3分子和SiO2等?
(3)既有极性共价键又有非极性共价键的物质,如H2O2?C2H2?CH3CH3?C6H6(苯)等分子?
(4)只含有离子键的物质,活泼非金属元素与活泼金属元素形成的化合物,如Na2S?CsCl?K2O?NaH晶体等?(5)既有离子键又有极性共价键的物质,如NaOH晶体等?
(6)只有共价键,没有分子间作用力的物质——金刚石?单晶硅?SiO2?SiC等晶体?
(7)无化学键的物质,如稀有气体?类比迁移 1.下列物质中含离子键的是( )
A.Cl2 B.CO2 C.NaCl D.CH4
答案:C
解析:活泼的金属与活泼的非金属元素之间容易形成离子键;非金属单质(稀有气体单质除外)?非金属氧化物?非金属氢化物中均只能存在共价键?重点探究 二?微粒电子式的书写与用电子式表示形成过程
1.电子式
(1)原子:把其最外层电子用“·”或“×”来表示,如钠原子Na·?氖原子 ?
(2)阴离子:不仅要标出最外层电子数,而且还要用“[ ]”括起来,并在右上角标出“n-”,如氯离子[ ]-?
(3)单核阳离子:与离子符号相同?(5)离子化合物
由阴?阳离子的电子式构成,但相同的离子不得合并,且带同类电荷的离子不得相邻,如(6)共价化合物
共用电子对写在成键两原子中间(一般形成共价键后,成键原子达到稳定结构),每个原子最外层电子都要标出,相同的原子不能合并?2.用电子式表示化合物的形成过程
(1)离子化合物形成过程的表示方法
左边是原子的电子式,右边是离子化合物的电子式,中间用“→”连接,左边相同的原子可以合并,右边相同的离子不能合并?例如:(2)共价化合物形成过程的表示方法
左边是原子的电子式,相同原子可以合并,右边是共价化合物的电子式,中间用“”连接?例如:特别提醒:①书写化合物的电子式,应先考虑是离子化合物还是共价化合物,然后再用相应的方法来表示?
②书写物质的电子式时要防止漏写未成键电子,如CCl4?N2等的电子式易错写为 【例2】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A?C同周期,B?C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10电子分子?试回答下列问题:
(1)写出五种元素的名称:
A_____,B______,C_______,D________,E_________?
(2)用电子式表示离子化合物A2B的形成过程:
____________________________________________?钠氧硫氮氢(3)写出下列物质的电子式:
D元素形成的单质__________________;
E与B形成的化合物______________________________;
A?B?E形成的化合物____________________________;
D与E形成的共价化合物___________________________?解析:首先根据原子结构推出各种元素,再根据不同物质的电子式书写方法来书写电子式,并根据用电子式表示离子化合物的形成过程的方法表示A2B的形成过程,要注意用电子式表示离子化合物时,阴离子用[ ]括起来,并在右上角标出所带电荷数,简单阳离子的电子式为其本身?因为A?B离子的电子层数相同,在电子总数为30的A2B型离子化合物中,每个离子的电子数均为10,故可推知A是Na,B是O?又因为4个原子核?10个电子形成的分子中,每个原子平均不到3个电子,所以只好从原子序数1~18的元素中寻找,Li已有3个电子,可知一定含有氢原子,分子中只有4个原子核共10个电子,一定是NH3?原子序数D>E,故D为N,E为H?C与A(Na)同周期,与B(O)同主族,则C为硫?
【方法归纳】 解答问题时要看清题目要求是用电子式表示化合物还是表示化合物的形成过程;用电子式表示的是离子化合物还是共价化合物?类比迁移 2.下列电子式正确的是( )答案:B难点探究 分子中8电子稳定结构判别法
1.元素原子序数≤5的原子不能形成8电子稳定结构?
2.非金属元素原子若所成键数(或所带负电荷数)等于其最低负价(即8-族序数),则该原子为8电子稳定结构?如:在判断某分子中某原子是否达到8电子稳定结构时,可先试写其结构式,看该原子是否达到8电子的价键要求即可?
①COCl2:其结构式可写为 ,各原子均符合8电子价键要求,它们均为8电子结构?②SF6:其结构式可写为 ,S为+6价,不符合8电子价键要求,它不是8电子
结构? ③BF3:B的原子序数≤5,它不能形成8电子结构?④XeF2:其结构式为F—Xe—F,Xe为+2价,不符合8电子的0价要求,它不是8电子结构?⑤NO2:在保证O为-2价的前提下无论怎样写,(O===N===O)均不能使N原子为-3价,N原子不是8电子稳定结构?类比迁移 3.下列共价化合物中所有原子都满足最外层8电子结构的是( )
A.六氟化氙(XeF6)
B.次氯酸(HClO)
C.氯化硫(S2Cl2)
D.白磷(P4)
答案:C解析:选项A中Xe为稀有气体原子,最外层已达8电子结构,与F结合后肯定不再是8电子结构;选项B中HClO中氢无法达到8电子结构;选项C中S2Cl2的结构式为Cl—S—S—Cl,各原子最外层均可达8电子结构;分析白磷的结构——正四面体,可知所有磷原子最外层都达8电子结构,但白磷属于单质,不符合条件?实验探究 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合?如NH 就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的?据此,回答下列问题:
(1)下列粒子中可能存在配位键的是__________?
A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:
_______________________________________________BD (3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:
甲: ?乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂?化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2做还原剂)?①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
___________________________________________;
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:________________________
____________________________________________? 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)走出误区 ●电子式的书写常出现的错误有:漏写中心原子的未成键电子?共用电子对的排列?离子化合物中相同离子合并等?解答此类问题,关键是要在平时的学习和复习过程中善于总结,勤于积累,归纳出常见的出错形式,建立错题本?
●常将“根”与“基”的电子式混淆,如铵离子
氢氧根离子 .作为“基”的原子团,只按原中性原子间成键形式表示出即可?如羟基
,“基”不带电荷?●形成的共价化合物中每个原子不一定都满足8电子的稳定结构?如SF6其结构式可写成
,S为+6价,不符合8电子价键要求?BF3中B不能形成8电子结构,XeF2其结构为F—Xe—F,Xe为+2价,不符合8电子结构?因材施教 1.判断多原子分子极性的方法
如果分子的空间结构不完全对称,其正?负电荷重心就不会重合,其分子属于极性分子?例如:三原子分子HOCl(习惯写成HClO)?HCN为直线形;H2O?SO2是V形?四原子分子NH3是三角锥形(是N原子的孤对电子排斥三个N—H键的原因);五原子的CHCl3是四面体(不是正四面体)等,都是极性分子?2.记住相似相溶原理:由极性分子组成的溶质易溶于由极性分子组成的溶剂中,反之亦然?经综合考虑,全面分析,才能一步一步得出题目的正确答案来?
问题:你能依据以上信息,并结合有关材料来探究一些分子的结构吗?
在极性分子中,正电荷重心同负电荷重心间的距离称偶极矩,通常用d表示?极性分子的极性强弱同偶极矩和正(或负)电荷重心的电荷量(q)有关,一般用偶极矩(μ)来衡量?分子的偶极矩定义为偶极长和偶极上一端电荷电荷量的乘积?即μ=d·q?试回答以下问题:(1)HCl?CS2?H2S?SO2 四种分子中,μ=0的是__________;
(2)对硝基氯苯?邻硝基氯苯?间硝基氯苯,三种分子的偶极矩由大到小的排列顺序是
_________________________________________;
(3)实验测得:μ(PF3)=1.03 deb?μ(BCl3)=0 deb?由此可知,PF3分子是__________构型,BCl3分子是__________构型;CS2 邻硝基氯苯>间硝基氯苯>对硝基氯苯 三角锥形平面三角形4)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的四个角上?已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0?试画出两种异构体的构型图,并比较在水中的溶解度?
构型图:淡黄色_____________,棕黄色______________;在水中溶解度较大的是___________________________?棕黄色者在水中溶解度较大一些解析:(1)由题关于μ的定义可得,当μ=0时,即为非极性分子,因此四种分子中,空间结构对称的非极性分子只有CS2?S===C===S为直线形对称结构,正电荷重心与负电荷重心重叠,d=0,因此,μ=0?
(2)由题可得:越对称,偶极矩越小?因此,邻硝基氯苯>间硝基氯苯>对硝基氯苯?
(3)由两个偶极矩可得:PF3为极性分子,AB3型的极性分子空间结构为三角锥形,而BCl3为非极性分子,AB3型的非极性分子构型应为平面三角形?(4)由于Pt(NH3)2Cl2为平面四边形结构,因此,淡黄色 μ=0的空间对称结构的非极性分子,结构为 ,而棕黄色μ>0的为极性分子,结构为 ?从相似相溶原理可得:棕黄色者在水中溶解度较大一些?备用选题 1.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.可能不形成化学键
答案:C
解析:最外层只有1个电子的元素可能为ⅠA族元素,与卤素结合形成的化学键可能为共价键HX(X代表F?Cl?Br?I),也可能为离子化合物NaX等?2.下列电子式中,正确的是( )答案:BC3.下列用电子式表示的化合物的形成过程正确的是( )答案:C4.下列化合物中既存在离子键,又存在极性键的是( )
A.H2O
B.NH4Cl
C.NaOH
D.Na2O2
答案:BC解析:水中只有H—O键,是极性键,没有离子键,排除选项A?氯化铵中铵根离子和氯离子间是离子键,氮和三个氢原子以极性键结合,选项B对?氢氧化钠中钠离子与氢氧根间是离子键,氢?氧之间以极性键结合,选项C对?过氧化钠中钠离子和过氧根离子之间为离子键,过氧根离子内部是非极性共价键,故D不对?5.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到8个电子的结构?则一个三硫化四磷分子中含有的共价键个数是( )
A.7个
B.9个
C.19个
D.不能确定
答案:B解析:三硫化四磷分子式为P4S3,由题意知,各原子最外层都达8e-,且无不饱和键,则每个P原子应形成3个共价键,每个S原子应形成2个共价键,总数是 ?6.短周期元素A?B?C?D,0.5 mol A元素的离子得到6.02×1023个电子后被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍?请填写下列空格:
(1)A?B?C?D四种元素的符号是A_________,B________,C________,D_________?MgAlClC(2)C?D两元素组成的物质,分子内含有__________键(填“极性”或“非极性”)?
(3)A?B?C三种元素的离子半径由大到小的顺序为________________________(用离子符号表示)?极性 Cl->Mg2+>Al3+ 解析:0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A元素形成的离子为A2+,氧化物形式为AO,根据AO与盐酸反应的量的关系:
,所以A元素原子的质量数为40-16=24,因为A元素原子核内质子数和中子数相等,所以A为Mg,由题意依次推知B为Al,C为Cl,D为C?高效作业 一?选择题
1.下列关于化学键的说法中正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
答案:B解析:A错,稀有气体构成的单原子分子中不含共价键;B项正确,如铵盐NH4Cl?NH4NO3等是由非金属元素组成的离子化合物;C错,例如H2O2?Na2O2等物质中O—O键均为非极性键;D错,如H2O2多原子分子中也含有非极性键?2.下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
答案:B
解析:不活泼金属与非金属之间也能形成共价键,故D不正确;共价键存在于单质?离子化合物和共价化合物中,故A?C不正确?如果化合物中只有共价键,则其一定是共价化合物,B正确?3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.酒精溶于水
D.HCl气体溶于水
答案:D
解析:碘升华与溴蒸气吸附均破坏的是分子间作用力,属物理变化?酒精是非电解质,溶于水后仍为酒精分子,不破坏共价键?4.下列叙述中正确的是( )
A.NH3?CO?CO2都是极性分子
B.CH4?CCl4都是含有极性键的非极性分子
C.HF?HCl?HBr?HI的稳定性依次增强
D.CS2?H2O?C2H2都是直线型分子
答案:B
解析:A项中CO2为直线型结构且正负电荷重心重合,故为非极性分子;C项中的稳定性是依次减弱的;D项中的H2O分子为V形结构?5.下列各数值表示有关元素的原子序数,各原子组能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与8
答案:C
解析:A:由各元素的原子序数可以确定不能形成化合物,B:C?S两种元素的原子可以以共价键结合形成CS2,C:Na?Cl两种元素的原子可以以离子键结合形成NaCl,D:Si?O两种元素的原子可以以共价键结合形成 SiO2?根据离子键的形成条件选C?6.下列关于化学键的叙述,不正确的是( )
A.离子化合物可能含非极性键
B.离子化合物可能含极性键
C.共价化合物中可能含有非极性键
D.共价化合物中可能含离子键
答案:D
解析:离子化合物中可能含有非极性共价键(如 Na2O2),也可能含有极性共价键(如NaOH?NH4Cl等);共价化合物可能含有非极性共价键(如C2H2?H2O2等),但一定不含离子键?7.只在化合物中才能存在的化学键是( )
A.离子键
B.共价键
C.极性键
D.非极性键
答案:AC
解析:非金属单质中存在非极性共价键,属于共价键?8.由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20?则有关X的下列说法正确的是( )
A.X中阳离子和阴离子个数不一定相等
B.X中一定有离子键,一定不含共价键
C.若X只含两种元素,则两种元素可在同一周期也可在同一主族
D.X中阳离子的半径一定大于阴离子的半径
答案:A解析:符合题干要求的粒子有:KH?NH4F?NaOH?MgO等,由此可判断A正确,B?D错误;C项,可在同主族(如KH),不可能在同周期?
答案:C10.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的值)
B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体
C.NH5的电子式为
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案:A
解析:因为它所有的原子最外层都符合相应稀有气体原子的最外层电子结构,即2个或8个,假设A正确的话,对N原子来说,最外层应是10个电子,不符合题意?其他选项均符合题意?11.(2009·江苏六校联考)由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题?新型小分子团水,具有饮用量少?渗透力强?生物利用率高?在人体内储存时间长?排放量少的特点?一次饮用125 mL小分子团水,可维持人体6小时正常需水量?下列关于小分子团水的说法正确的是( )
A.水分子的化学性质改变
B.水分子中氢氧键缩短
C.水分子间的作用力减小
D.水分子间结构?物理性质改变答案:D
解析:水的化学性质?化学键不可能改变,改变的是水分子间结构;使水更易被人体吸收,水分子间的作用力是不会改变的,水分子间作用力是范德华力?12.(2009·安徽蚌埠质检)下列物质中所有原子均满足最外层8电子结构的化合物是( )
A.PCl5 B.P4
C.CCl4 D.NH3
答案:C
解析:判断原子满足最外层8电子结构的方法为:最外层电子数+所成价键数=8,故A项,D项错误;P4为单质,而非化合物,故B项错误?二?非选择题
13.(2009·丹东一模)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3?请回答下列问题:
(1)Na3N的电子式是______________________,该化合物由__________键形成?
(2)Na3N与盐酸反应生成__________种盐,其电子式分别是
_____________________________________________?离子 2 (3)Na3N与水的反应属于__________(填基本反应类型)反应?
(4)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”或“<”)?
复分解 < 14.(2009·汕头模拟)A?B?C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A?C同主族,B+核外有10个电子,则
(1)A?B?C元素分别是__________?__________?__________?
(2)A?B?C之间可形成多种化合物,其中属于离子化合物的化学式分别为__________?__________?__________(任举三种)?ONaS答案(2)Na2O ,Na2O2 ,Na2S, Na2SO4 ,Na2SO3 ,
Na2S2O3,(任选三种) ,(3)用电子式表示B和C形成化合物的过程
___________________________________________?15.(2009·烟台质检)下面是元素周期表的一部分,各元素在周期表中的位置如下,据此回答下列问题:(1)上述元素中,能形成两性氢氧化物的元素为________(填元素符号,下同);上述非金属元素中,氢化物的稳定性最强的元素为__________?
(2)下列各组元素中最容易形成离子键的是__________,最容易形成共价键的是__________?
A.c和h B.b和k C.h和k D.e和k
(3)下列由a~k元素形成的各分子中所有原子都满足最外层为8电子结构的是______?
A.ga3 B.ak C.hk3 D.ek4AlFBCCD(4)请用化学方程式解释下列现象:
①玻璃容器不能盛放j的氢化物的水溶液:
____________________________________________;
②b的氧化物的水溶液不能贮存在d制品中:
____________________________________________?
(5)请设计一个实验方案,比较b?c单质还原性的强弱:
____________________________________________
____________________________________________?SiO2+4HF=SiF4↑+2H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Mg与Na分别与冷水反应,Na反应剧烈,Mg反应很缓慢,给
加有镁条的水加热,反应才明显?说明钠的还原性强16.现有下列三组元素,它们的原子序数分别是
①3和9 ②10和13 ③6和8
其中能组成XY2型的共价化合物分子的是__________,电子式是______________________________,能形成XY型离子化合物的是________,电子式是________________?③ ① 解析:由题中条件知①为Li和F,②为Ne和Al,③为C和O,能组成XY2型的共价化合物分子的是③,电子式是∶
,能形成XY型离子化合物的是①,电子式是17.A?B?C?D?E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子?它们之间可发生如下变化:A+B=C+D,B+E=2D,且D与大多数酸性氧化物及碱性氧化物均能反应:
①写出A的电子式:_______________________;写出E的电
子式:_________________________________;②写出B?C?D?E的化学式:B__________,C__________,
D_____________,E______________;
③用电子式表示D的形成过程:
__________________________________________
___________________________________________?OH-NH3H2OH3O+解析:因为D与大多数酸性氧化物及碱性氧化物均反应,可推断D是H2O,有10个电子?10个电子的常见粒子有NH+4?H2O?OH-?F-?O2-?NH3?CH4等?A由5个原子核组成,且与B反应生成C和H2O,所以可判断A是NH ,B是OH-,C是NH3?由反应方程式B+E=2D可推断E是H3O+?
学案17 化学键轻松学教材一?化学键:离子键?共价键
化学键定义:使1离子相结合或原子相结合的作用力
类型
离子键(1)定义:2带相反电荷离子之间的相互作用
(2)成键微粒:3阴?4阳离子
(3)成键实质:5静电作用(离子间的静电
吸引力与电子和电子之间?核与核之间的静
电排斥达到平衡)(4)形成条件:6活泼金属(ⅠA?ⅡA族)与7活泼非金属(ⅦA?ⅥA族)化合时,
一般形成离子键
(5)存在:所有的离子化合物中都有8离子键共价键(1)定义:原子间通过9共用电子对所形成的
相互作用
(2)成键微粒:10原子
(3)成键实质:原子间形成共用电子对,共用电子
对对核的静电11吸引与核间?电子间的静电
12排斥达到平衡
(4)形成条件:13同种或不同种非金属原子相结合
时,一般形成共价键(5)分类①14非极性共价键:两个相同非金属
原子间形成的共价键
②15极性共价键:两个不相同非金
属原子间形成的共价键
(6)存在①非金属单质(稀有气体除外)
②共价化合物
③含有复杂离子(如NH ?OH-?O ?
CO )的离子化合物
与化学反应的关系:化学反应的实质就是16旧化学键的
断裂和17新化学键形成的过程二?分子间作用力?氢键
1.
分子间作用力定义:把18分子聚集在一起的作用力,又称19范德华力
特点分子间作用力比化学键弱得多,它主要
影响物质的20熔点?21沸点?22溶解度
等物理性质
分子间作用力只存在于由共价键形成的
多数共价化合物和绝大多数气态非金
属单质分子以及稀有气体分子之间变化规律:一般来说,对于组成和结构相似的物
质,相对分子质量越大,分子间作用力23越大,
物质的熔沸点也24越高
2.氢键定义:25NH3?26H2O?27HF等分子之
间存在着一种比分子间作用力稍强
的相互作用,这种相互作用叫氢键
作用:分子间形成氢键会使物质的28熔点
和29沸点升高体验热身 1.(2009·新建模拟)某分子的球棍模型如图所示?已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连?下列有关说法中错误的是( )A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
答案:B
解析:由该原子结构知Y原子最外层有一个或七个电子,Y原子为ⅠA族或ⅦA族元素,根据成键形式X原子最外层有五个电子或三个电子,故B错;F的半径小于N,故D正确?2.下列哪一组元素的原子间反应容易形成离子键( )A.a和c B.a和f
C.d和g D.b和g答案:BD解析:由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周期元素?a?b均为活泼的金属元素,f?g均为活泼的非金属元素,所以a与f,b与g间易形成离子键?3.现有如下各种说法:
①在水中氢?氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子?阴离子的相互吸引力
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键
⑤H2分子和Cl2分子的反应过程是H2?Cl2分子里共价键发生断裂生成H原子?Cl原子,而后H原子?Cl原子形成离子键的过程
上述各种说法正确的是( )A.①②⑤ B.都不正确 C.④ D.①
答案:B
解析:水中存在分子内H?O原子之间的相互作用,形成化学键,分子间的H?O原子的作用是分子间作用力(氢键),故①不对;离子键只有活泼金属和活泼非金属化合时才形成,故②不对;在离子化合物中,阴?阳离子间存在相互作用,不单指相互吸引,还有相互排斥,故③错误;HCl分子中不存在离子,属于共价化合物,分子中没有离子键,故④不正确;化学反应的本质是旧键断裂,新键形成的过程,但HCl中存在共价键而非离子键,故⑤不对?4.(2008·海南高考)HBr分子的电子式为( )答案:A解析:因为HBr分子为共价化合物分子,H?Br两种原子通过共用电子对成键,从而分析得出在HBr分子中不存在H+和
由此判断A正确,B?C错误;D项是HBr分子的结构式而非电子式,与题意不符?5.A?B?C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A?C同主族,B+核外有10个电子,则
(1)A?B?C元素分别是______?________?__________?
(2)A?B?C之间可形成多种化合物,其中属于离子化合物的化学式分别为
__________?__________?_______________________(任举三种)?
(3)用电子式表示B和C形成化合物的过程ONaSNa2O Na2O2 Na2S Na2SO4 Na2SO3 Na2S2O3(任选三种) 解析:B+核外有10个电子,则B为钠元素,A?C同主族且原子序数之和为35-11=24,故A为氧元素,C为硫元素?6.(2010·石家庄市质检一)
(1)元素甲是第三周期第ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A?写出A的电子式
__________________________________?
(2)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式____________________________________________?2F2+2H2O=4HF+O2 (3)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是______________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式__________________________________?
(4)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式
_____________________________________________?r(Ca2+)
(3)常用于检验CO2存在的溶液是Ca(OH)2,丙为Ca,Ca2+?Cl-属于核外电子排布相同的微粒,半径大小取决于原子序数大小,原子序数越大,半径越小?
(4)第三周期中离子半径最小的元素为Al?重点探究 一?化学键
考查化学键的主要内容:化学键的分类;化学键的表示方法:电子式?结构式;化学键的强弱对物质性质的影响;化学键与化学反应?
1.要分清离子键?共价键的本质?含义及表示方法,明确化学键的意义,特别要弄清楚以下问题:
(1)由金属元素与非金属元素间形成的化学键不一定是离子键,如 AgCl?AlCl3等都是共价化合物?
(2)由阳离子和阴离子结合生成的化合物不一定是离子化合物,如H++OH-=H2O,2H++CO =CO2↑+H2O?(3)由两种共价分子结合生成的化合物也不一定不是离子化合物?如NH3+HCl=NH4Cl?
(4)有化学键被破坏的变化不见得是化学变化?如HCl溶于水,NaCl熔化等都有化学键被破坏,但都属于物理变化?
(5)用化学键强弱可解释物质的化学性质,也可解释物质的物理性质?根据不同的物质类型,有的物质发生物理变化要克服化学键?如金刚石?晶体硅熔点高低要用化学键强弱来解释?而HF?HCl?HBr?HI中的化学键强弱只能解释其化学性质,它们的物理性质与H—X键无关?2.离子键和共价键的比较【例1】下列反应过程中,同时有离子键?极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2解析:各反应中化学键断裂及形成的情况如下:A项,NH4Cl中无非极性共价键,NH3和HCl中只有极性共价键;B项,反应物中不存在离子键和非极性共价键,产物中不存在非极性共价键;C项,产物中不存在非极性键,CO2中存在极性共价键;产物Na2CO3中既存在离子键又存在极性共价键,O2中存在非极性共价键?
答案:D【方法归纳】 化学键的类型与物质的类别
(1)只含非极性共价键的物质,同种非金属元素组成的单质,如I2?N2?P4分子?金刚石?晶体硅等?
(2)只含有极性共价键的物质,一般是不同非金属元素组成的共价化合物,如HCl?NH3分子和SiO2等?
(3)既有极性共价键又有非极性共价键的物质,如H2O2?C2H2?CH3CH3?C6H6(苯)等分子?
(4)只含有离子键的物质,活泼非金属元素与活泼金属元素形成的化合物,如Na2S?CsCl?K2O?NaH晶体等?(5)既有离子键又有极性共价键的物质,如NaOH晶体等?
(6)只有共价键,没有分子间作用力的物质——金刚石?单晶硅?SiO2?SiC等晶体?
(7)无化学键的物质,如稀有气体?类比迁移 1.下列物质中含离子键的是( )
A.Cl2 B.CO2 C.NaCl D.CH4
答案:C
解析:活泼的金属与活泼的非金属元素之间容易形成离子键;非金属单质(稀有气体单质除外)?非金属氧化物?非金属氢化物中均只能存在共价键?重点探究 二?微粒电子式的书写与用电子式表示形成过程
1.电子式
(1)原子:把其最外层电子用“·”或“×”来表示,如钠原子Na·?氖原子 ?
(2)阴离子:不仅要标出最外层电子数,而且还要用“[ ]”括起来,并在右上角标出“n-”,如氯离子[ ]-?
(3)单核阳离子:与离子符号相同?(5)离子化合物
由阴?阳离子的电子式构成,但相同的离子不得合并,且带同类电荷的离子不得相邻,如(6)共价化合物
共用电子对写在成键两原子中间(一般形成共价键后,成键原子达到稳定结构),每个原子最外层电子都要标出,相同的原子不能合并?2.用电子式表示化合物的形成过程
(1)离子化合物形成过程的表示方法
左边是原子的电子式,右边是离子化合物的电子式,中间用“→”连接,左边相同的原子可以合并,右边相同的离子不能合并?例如:(2)共价化合物形成过程的表示方法
左边是原子的电子式,相同原子可以合并,右边是共价化合物的电子式,中间用“”连接?例如:特别提醒:①书写化合物的电子式,应先考虑是离子化合物还是共价化合物,然后再用相应的方法来表示?
②书写物质的电子式时要防止漏写未成键电子,如CCl4?N2等的电子式易错写为 【例2】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A?C同周期,B?C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10电子分子?试回答下列问题:
(1)写出五种元素的名称:
A_____,B______,C_______,D________,E_________?
(2)用电子式表示离子化合物A2B的形成过程:
____________________________________________?钠氧硫氮氢(3)写出下列物质的电子式:
D元素形成的单质__________________;
E与B形成的化合物______________________________;
A?B?E形成的化合物____________________________;
D与E形成的共价化合物___________________________?解析:首先根据原子结构推出各种元素,再根据不同物质的电子式书写方法来书写电子式,并根据用电子式表示离子化合物的形成过程的方法表示A2B的形成过程,要注意用电子式表示离子化合物时,阴离子用[ ]括起来,并在右上角标出所带电荷数,简单阳离子的电子式为其本身?因为A?B离子的电子层数相同,在电子总数为30的A2B型离子化合物中,每个离子的电子数均为10,故可推知A是Na,B是O?又因为4个原子核?10个电子形成的分子中,每个原子平均不到3个电子,所以只好从原子序数1~18的元素中寻找,Li已有3个电子,可知一定含有氢原子,分子中只有4个原子核共10个电子,一定是NH3?原子序数D>E,故D为N,E为H?C与A(Na)同周期,与B(O)同主族,则C为硫?
【方法归纳】 解答问题时要看清题目要求是用电子式表示化合物还是表示化合物的形成过程;用电子式表示的是离子化合物还是共价化合物?类比迁移 2.下列电子式正确的是( )答案:B难点探究 分子中8电子稳定结构判别法
1.元素原子序数≤5的原子不能形成8电子稳定结构?
2.非金属元素原子若所成键数(或所带负电荷数)等于其最低负价(即8-族序数),则该原子为8电子稳定结构?如:在判断某分子中某原子是否达到8电子稳定结构时,可先试写其结构式,看该原子是否达到8电子的价键要求即可?
①COCl2:其结构式可写为 ,各原子均符合8电子价键要求,它们均为8电子结构?②SF6:其结构式可写为 ,S为+6价,不符合8电子价键要求,它不是8电子
结构? ③BF3:B的原子序数≤5,它不能形成8电子结构?④XeF2:其结构式为F—Xe—F,Xe为+2价,不符合8电子的0价要求,它不是8电子结构?⑤NO2:在保证O为-2价的前提下无论怎样写,(O===N===O)均不能使N原子为-3价,N原子不是8电子稳定结构?类比迁移 3.下列共价化合物中所有原子都满足最外层8电子结构的是( )
A.六氟化氙(XeF6)
B.次氯酸(HClO)
C.氯化硫(S2Cl2)
D.白磷(P4)
答案:C解析:选项A中Xe为稀有气体原子,最外层已达8电子结构,与F结合后肯定不再是8电子结构;选项B中HClO中氢无法达到8电子结构;选项C中S2Cl2的结构式为Cl—S—S—Cl,各原子最外层均可达8电子结构;分析白磷的结构——正四面体,可知所有磷原子最外层都达8电子结构,但白磷属于单质,不符合条件?实验探究 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合?如NH 就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的?据此,回答下列问题:
(1)下列粒子中可能存在配位键的是__________?
A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:
_______________________________________________BD (3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:
甲: ?乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂?化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2做还原剂)?①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
___________________________________________;
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:________________________
____________________________________________? 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)走出误区 ●电子式的书写常出现的错误有:漏写中心原子的未成键电子?共用电子对的排列?离子化合物中相同离子合并等?解答此类问题,关键是要在平时的学习和复习过程中善于总结,勤于积累,归纳出常见的出错形式,建立错题本?
●常将“根”与“基”的电子式混淆,如铵离子
氢氧根离子 .作为“基”的原子团,只按原中性原子间成键形式表示出即可?如羟基
,“基”不带电荷?●形成的共价化合物中每个原子不一定都满足8电子的稳定结构?如SF6其结构式可写成
,S为+6价,不符合8电子价键要求?BF3中B不能形成8电子结构,XeF2其结构为F—Xe—F,Xe为+2价,不符合8电子结构?因材施教 1.判断多原子分子极性的方法
如果分子的空间结构不完全对称,其正?负电荷重心就不会重合,其分子属于极性分子?例如:三原子分子HOCl(习惯写成HClO)?HCN为直线形;H2O?SO2是V形?四原子分子NH3是三角锥形(是N原子的孤对电子排斥三个N—H键的原因);五原子的CHCl3是四面体(不是正四面体)等,都是极性分子?2.记住相似相溶原理:由极性分子组成的溶质易溶于由极性分子组成的溶剂中,反之亦然?经综合考虑,全面分析,才能一步一步得出题目的正确答案来?
问题:你能依据以上信息,并结合有关材料来探究一些分子的结构吗?
在极性分子中,正电荷重心同负电荷重心间的距离称偶极矩,通常用d表示?极性分子的极性强弱同偶极矩和正(或负)电荷重心的电荷量(q)有关,一般用偶极矩(μ)来衡量?分子的偶极矩定义为偶极长和偶极上一端电荷电荷量的乘积?即μ=d·q?试回答以下问题:(1)HCl?CS2?H2S?SO2 四种分子中,μ=0的是__________;
(2)对硝基氯苯?邻硝基氯苯?间硝基氯苯,三种分子的偶极矩由大到小的排列顺序是
_________________________________________;
(3)实验测得:μ(PF3)=1.03 deb?μ(BCl3)=0 deb?由此可知,PF3分子是__________构型,BCl3分子是__________构型;CS2 邻硝基氯苯>间硝基氯苯>对硝基氯苯 三角锥形平面三角形4)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的四个角上?已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0?试画出两种异构体的构型图,并比较在水中的溶解度?
构型图:淡黄色_____________,棕黄色______________;在水中溶解度较大的是___________________________?棕黄色者在水中溶解度较大一些解析:(1)由题关于μ的定义可得,当μ=0时,即为非极性分子,因此四种分子中,空间结构对称的非极性分子只有CS2?S===C===S为直线形对称结构,正电荷重心与负电荷重心重叠,d=0,因此,μ=0?
(2)由题可得:越对称,偶极矩越小?因此,邻硝基氯苯>间硝基氯苯>对硝基氯苯?
(3)由两个偶极矩可得:PF3为极性分子,AB3型的极性分子空间结构为三角锥形,而BCl3为非极性分子,AB3型的非极性分子构型应为平面三角形?(4)由于Pt(NH3)2Cl2为平面四边形结构,因此,淡黄色 μ=0的空间对称结构的非极性分子,结构为 ,而棕黄色μ>0的为极性分子,结构为 ?从相似相溶原理可得:棕黄色者在水中溶解度较大一些?备用选题 1.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键,也可能是共价键
D.可能不形成化学键
答案:C
解析:最外层只有1个电子的元素可能为ⅠA族元素,与卤素结合形成的化学键可能为共价键HX(X代表F?Cl?Br?I),也可能为离子化合物NaX等?2.下列电子式中,正确的是( )答案:BC3.下列用电子式表示的化合物的形成过程正确的是( )答案:C4.下列化合物中既存在离子键,又存在极性键的是( )
A.H2O
B.NH4Cl
C.NaOH
D.Na2O2
答案:BC解析:水中只有H—O键,是极性键,没有离子键,排除选项A?氯化铵中铵根离子和氯离子间是离子键,氮和三个氢原子以极性键结合,选项B对?氢氧化钠中钠离子与氢氧根间是离子键,氢?氧之间以极性键结合,选项C对?过氧化钠中钠离子和过氧根离子之间为离子键,过氧根离子内部是非极性共价键,故D不对?5.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到8个电子的结构?则一个三硫化四磷分子中含有的共价键个数是( )
A.7个
B.9个
C.19个
D.不能确定
答案:B解析:三硫化四磷分子式为P4S3,由题意知,各原子最外层都达8e-,且无不饱和键,则每个P原子应形成3个共价键,每个S原子应形成2个共价键,总数是 ?6.短周期元素A?B?C?D,0.5 mol A元素的离子得到6.02×1023个电子后被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍?请填写下列空格:
(1)A?B?C?D四种元素的符号是A_________,B________,C________,D_________?MgAlClC(2)C?D两元素组成的物质,分子内含有__________键(填“极性”或“非极性”)?
(3)A?B?C三种元素的离子半径由大到小的顺序为________________________(用离子符号表示)?极性 Cl->Mg2+>Al3+ 解析:0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A元素形成的离子为A2+,氧化物形式为AO,根据AO与盐酸反应的量的关系:
,所以A元素原子的质量数为40-16=24,因为A元素原子核内质子数和中子数相等,所以A为Mg,由题意依次推知B为Al,C为Cl,D为C?高效作业 一?选择题
1.下列关于化学键的说法中正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
答案:B解析:A错,稀有气体构成的单原子分子中不含共价键;B项正确,如铵盐NH4Cl?NH4NO3等是由非金属元素组成的离子化合物;C错,例如H2O2?Na2O2等物质中O—O键均为非极性键;D错,如H2O2多原子分子中也含有非极性键?2.下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
答案:B
解析:不活泼金属与非金属之间也能形成共价键,故D不正确;共价键存在于单质?离子化合物和共价化合物中,故A?C不正确?如果化合物中只有共价键,则其一定是共价化合物,B正确?3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.酒精溶于水
D.HCl气体溶于水
答案:D
解析:碘升华与溴蒸气吸附均破坏的是分子间作用力,属物理变化?酒精是非电解质,溶于水后仍为酒精分子,不破坏共价键?4.下列叙述中正确的是( )
A.NH3?CO?CO2都是极性分子
B.CH4?CCl4都是含有极性键的非极性分子
C.HF?HCl?HBr?HI的稳定性依次增强
D.CS2?H2O?C2H2都是直线型分子
答案:B
解析:A项中CO2为直线型结构且正负电荷重心重合,故为非极性分子;C项中的稳定性是依次减弱的;D项中的H2O分子为V形结构?5.下列各数值表示有关元素的原子序数,各原子组能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与8
答案:C
解析:A:由各元素的原子序数可以确定不能形成化合物,B:C?S两种元素的原子可以以共价键结合形成CS2,C:Na?Cl两种元素的原子可以以离子键结合形成NaCl,D:Si?O两种元素的原子可以以共价键结合形成 SiO2?根据离子键的形成条件选C?6.下列关于化学键的叙述,不正确的是( )
A.离子化合物可能含非极性键
B.离子化合物可能含极性键
C.共价化合物中可能含有非极性键
D.共价化合物中可能含离子键
答案:D
解析:离子化合物中可能含有非极性共价键(如 Na2O2),也可能含有极性共价键(如NaOH?NH4Cl等);共价化合物可能含有非极性共价键(如C2H2?H2O2等),但一定不含离子键?7.只在化合物中才能存在的化学键是( )
A.离子键
B.共价键
C.极性键
D.非极性键
答案:AC
解析:非金属单质中存在非极性共价键,属于共价键?8.由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20?则有关X的下列说法正确的是( )
A.X中阳离子和阴离子个数不一定相等
B.X中一定有离子键,一定不含共价键
C.若X只含两种元素,则两种元素可在同一周期也可在同一主族
D.X中阳离子的半径一定大于阴离子的半径
答案:A解析:符合题干要求的粒子有:KH?NH4F?NaOH?MgO等,由此可判断A正确,B?D错误;C项,可在同主族(如KH),不可能在同周期?
答案:C10.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的值)
B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体
C.NH5的电子式为
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑答案:A
解析:因为它所有的原子最外层都符合相应稀有气体原子的最外层电子结构,即2个或8个,假设A正确的话,对N原子来说,最外层应是10个电子,不符合题意?其他选项均符合题意?11.(2009·江苏六校联考)由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题?新型小分子团水,具有饮用量少?渗透力强?生物利用率高?在人体内储存时间长?排放量少的特点?一次饮用125 mL小分子团水,可维持人体6小时正常需水量?下列关于小分子团水的说法正确的是( )
A.水分子的化学性质改变
B.水分子中氢氧键缩短
C.水分子间的作用力减小
D.水分子间结构?物理性质改变答案:D
解析:水的化学性质?化学键不可能改变,改变的是水分子间结构;使水更易被人体吸收,水分子间的作用力是不会改变的,水分子间作用力是范德华力?12.(2009·安徽蚌埠质检)下列物质中所有原子均满足最外层8电子结构的化合物是( )
A.PCl5 B.P4
C.CCl4 D.NH3
答案:C
解析:判断原子满足最外层8电子结构的方法为:最外层电子数+所成价键数=8,故A项,D项错误;P4为单质,而非化合物,故B项错误?二?非选择题
13.(2009·丹东一模)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3?请回答下列问题:
(1)Na3N的电子式是______________________,该化合物由__________键形成?
(2)Na3N与盐酸反应生成__________种盐,其电子式分别是
_____________________________________________?离子 2 (3)Na3N与水的反应属于__________(填基本反应类型)反应?
(4)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”或“<”)?
复分解 < 14.(2009·汕头模拟)A?B?C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A?C同主族,B+核外有10个电子,则
(1)A?B?C元素分别是__________?__________?__________?
(2)A?B?C之间可形成多种化合物,其中属于离子化合物的化学式分别为__________?__________?__________(任举三种)?ONaS答案(2)Na2O ,Na2O2 ,Na2S, Na2SO4 ,Na2SO3 ,
Na2S2O3,(任选三种) ,(3)用电子式表示B和C形成化合物的过程
___________________________________________?15.(2009·烟台质检)下面是元素周期表的一部分,各元素在周期表中的位置如下,据此回答下列问题:(1)上述元素中,能形成两性氢氧化物的元素为________(填元素符号,下同);上述非金属元素中,氢化物的稳定性最强的元素为__________?
(2)下列各组元素中最容易形成离子键的是__________,最容易形成共价键的是__________?
A.c和h B.b和k C.h和k D.e和k
(3)下列由a~k元素形成的各分子中所有原子都满足最外层为8电子结构的是______?
A.ga3 B.ak C.hk3 D.ek4AlFBCCD(4)请用化学方程式解释下列现象:
①玻璃容器不能盛放j的氢化物的水溶液:
____________________________________________;
②b的氧化物的水溶液不能贮存在d制品中:
____________________________________________?
(5)请设计一个实验方案,比较b?c单质还原性的强弱:
____________________________________________
____________________________________________?SiO2+4HF=SiF4↑+2H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Mg与Na分别与冷水反应,Na反应剧烈,Mg反应很缓慢,给
加有镁条的水加热,反应才明显?说明钠的还原性强16.现有下列三组元素,它们的原子序数分别是
①3和9 ②10和13 ③6和8
其中能组成XY2型的共价化合物分子的是__________,电子式是______________________________,能形成XY型离子化合物的是________,电子式是________________?③ ① 解析:由题中条件知①为Li和F,②为Ne和Al,③为C和O,能组成XY2型的共价化合物分子的是③,电子式是∶
,能形成XY型离子化合物的是①,电子式是17.A?B?C?D?E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子?它们之间可发生如下变化:A+B=C+D,B+E=2D,且D与大多数酸性氧化物及碱性氧化物均能反应:
①写出A的电子式:_______________________;写出E的电
子式:_________________________________;②写出B?C?D?E的化学式:B__________,C__________,
D_____________,E______________;
③用电子式表示D的形成过程:
__________________________________________
___________________________________________?OH-NH3H2OH3O+解析:因为D与大多数酸性氧化物及碱性氧化物均反应,可推断D是H2O,有10个电子?10个电子的常见粒子有NH+4?H2O?OH-?F-?O2-?NH3?CH4等?A由5个原子核组成,且与B反应生成C和H2O,所以可判断A是NH ,B是OH-,C是NH3?由反应方程式B+E=2D可推断E是H3O+?
同课章节目录
