2011届高考化学总复习课件系列 学案42 原子结构与性质
文档属性
| 名称 | 2011届高考化学总复习课件系列 学案42 原子结构与性质 |  | |
| 格式 | rar | ||
| 文件大小 | 288.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-09 13:17:00 | ||
图片预览











文档简介
课件112张PPT。第十七章 原子结构与性质 GAOKAOJINXINGSHI 轻松学教材
qing song xue jiao cai一、原子结构与核外电子排布
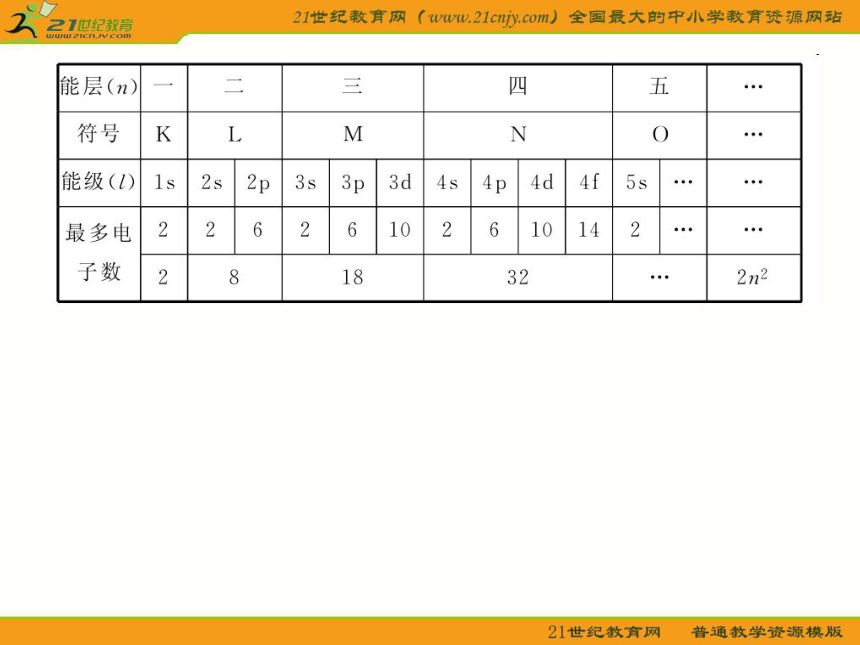
1.能层与能级
多电子原子的核外电子的能量是不同的,
按电子的能量差异将其分成不同的能层(n);
各能层最多容纳的电子数为2n2。
对于同一能层里能量不同的电子,
将其分成不同的能级(l);同一能层里,
能级的能量按s、p、d、f的顺序升高,
即E(s)<E(p)<E(d)<E(f)。
各能层所包含的能级类型及各能层、
能级最多容纳的电子数见下表:2.构造原理
绝大多数元素的原子核外电子的排布遵循如下图
所示的排布顺序,
人们把它称为构造原理。说明:(1)从图中可以看出,不同能层的能级有交错现象,
如E(3d)>E(4s)>、E(4d)>E(5s)、E(5d)>E(6s)、
E(6d)?>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。(2)构造原理是书写基态原子电子排布式的依据,
也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。3.基态原子核外电子排布式书写应遵循的规律
基态原子核外电子排布式的书写要考虑能量最低原理、
泡利不相容原理、洪特规则等多方面因素。“能量相同的原子轨道在全满
(如p6,d10)、半满(如p3,d5)和全空(p0,d0)状态时,
体系的能量最低”,这一点违反了洪特规则,
可看成是洪特规则的特例。
如:24Cr的电子排布式:
1s22s22p63s23p63d54s1(3d5、4s1均为半充满状态);
29Cu的电子排布式:
1s22s22p63s23p63d104s1(3d10为全充满状态,4s1为半充满状态)。注意:
(1)电子在跃迁时,
从较高能量的激发态跃迁到较低能量的激发态乃至基态时,
将释放能量,相反则吸收能量。
(2)电子跃迁的应用:因为每种原子的原子光谱是特定的,
所以用电子的跃迁可以判断元素的存在,
如应用焰色反应来判断元素的种类就是电子跃迁的应用。4.电子云和原子轨道
原子核外电子运动的特点是运动空间极小、极高速运动。
所以要用电子云来描述核外电子运动特征。
1s、2s、3s、4s相比较,
原子轨道半径大小顺序是1s<2s<3s<4s。2px、3px、4px
相比较,
原子轨道半径大小顺序是2px<3px<4px。
下面是部分原子轨道图:二、原子结构与元素周期律
1.原子结构与元素周期表
(1)核外电子排布与周期的划分:
一个能级组最多容纳的电子数等于一个周期所包含的元素种数,
因此元素周期表中7个周期分别对应着7个能级组,
前6个周期对应的元素种数分别为2、8、8、18、18、32。
周期的划分与主量子数n有关:最外层电子的主量子数为n时,
该元素属第n周期。(2)核外电子排布与族的划分:族的划分与原子的价电子数和价电子排布有关。
(3)元素周期表区的划分
s区元素:ⅠA和ⅡA族;p区元素:ⅢA~ⅦA和0族;
d区元素:ⅢB~Ⅷ族;ds区元素:
包括ⅠB和ⅡB族;f区元素:
包括镧系元素和锕系元素。
2.原子半径、电离能、电负性等元素性质的周期性变化
(1)原子半径:影响原子半径大小的因素有电子的能层数、
核电荷数。同周期元素(稀有气体元素除外)
从左到右原子半径逐渐减小,
同主族元素从上到下原子半径逐渐增大。(2)电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能(用I1表示),一价气态基态正离子再失去一个电子所需消耗的最低能量叫做第二电离能(用I2表示),依此类推,可得到I3、I4……同一种元素的逐级电离能的大小关系为I1<I2<I3<I4<……即一个原子的逐级电离能是逐渐增大的。这是因为随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多。每个周期的第一个元素第一电离能最小,
最后一个元素的第一电离能最大;
同族元素从上到下第一电离能变小。(3)电负性
原子的电负性用以量度原子对成键电子吸引能力的相对大
小,所以电负性表示的是原子吸引成键电子能力的相对强
弱。同周期元素从左向右随着原子序数的递增,原子的电
负性逐渐增大;同一主族元素从上到下,电负性逐渐减小
电负性的大小也可以作为判断元素金属性和非金属性强弱
的尺度。金属的电负性一般小于1.8,非金属的电负性一般
大于1.8电负性的应用:(1)判断金属元素和非金属元素:
电负性小于2的多为金属元素,而大于2的元素多为非金属元素。
(2)判断化合物中元素化合价的正负:
化合物中电负性小的元素显正化合价,
而电负性大的显负化合价,如HF中,电负性F>H,
F元素和H元素的化合价分别为-1价和+1价。
(3)判断化学键的类型:
电负性差值大的元素原子间形成的化学键主要是离子键,
而电负性差值小的元素原子间形成的化学键主要是共价键。
体验热身
ti yan re shen1.下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多答案:A解析:3p2表示在3p轨道上有2个电子;
同一原子中1s、2s、3s电子的能量依次升高;
同一原子中2p、3p、4p能级的轨道数相同。2.下图为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的价电子排布式为nsnnpn+1,
该元素原子的核外最外层电子的成对电子为
_______________________________对。⑨11s22s22p63s23p63d64s2(4)元素④的氢化物的分子构型为 ,
中心原子的杂化形式为 杂化。
(5)第三周期8种元素单质熔点高低的顺序如下图,
三角锥形 2其中序号“8”代表 (填元素符号);
其中电负性最大的是 (填图中的序号)。三角锥形 Si2sp3 解析:(2)⑨号元素是Fe元素,其电子排布式为
1s22s22p63s23p63d64s2。
(3)由nsnnpn+1可知n=2,则该元素是N,
其最外层成对电子只有1对。
(4)元素④是氮元素,其氢化物的分子构型是三角锥形。
(5)第三周期熔点最高的单质应是Si;电负性最大的是Cl,
即图中的2。3.A、B、C分别代表3种不同的短周期元素。
A元素的原子最外层电子排布为ns1;
B元素原子的M电子层中有2个未成对电子;
C元素原子的L电子层的p能级中有4个电子。
(1)若A元素的原子最外层电子排布为1s1,
B的最高化合价为+6价,
则B原子的价电子排布式为 ,
按原子轨道的重叠方式,
A与B形成的化合物中的共价键属于 键。3s23p4 σ(2)若B的最高化合价为+4价,B的原子结构 。
示意图为 ,
B与C形成的晶体中微粒间的作用力是 ,
其熔点比干冰的熔点高的原因是 答案: 共价键 二氧化硅为原子晶体,微粒间的作用力是共价键;
二氧化碳为分子晶体,微粒间的作用力是范德华力(3)若A元素的原子最外层电子排布为3s1,
B的最高化合价为+4价,
元素A在周期表中的位置是_______________,
A、B、C三种元素的第一电离能由大到小的顺序是
(用元素符号表示)。第三周期ⅠA族O>Si>Na解析:(1)由题意知A为H元素,B为S元素,
B原子的价电子排布式为3s23p4,
H原子和S原子形成的化学键为σ键。
(2)若B的最高价为+4价,
则B应为Si元素,
原子结构示意图为
C元素为O元素,Si和O形成的晶体是原子晶体,
微粒间作用力是共价键,比干冰中的分子间作用力要强得多。(3)若A的最外层电子排布为3s1,则A为Na元素,B为Si元素,
A、B、C的第一电离能大小顺序为O>Si>Na。
重点探究
zhong dian tan jiu表示原子结构的化学用语1.原子结构示意图
(1)含义:表示原子核外电子分层排布和核电荷数。 (2)举例:硫的原子结构示意图: 2.电子式
(1)含义:表示原子的最外层电子数。
(2)举例:氮原子的电子式
3.电子排布式
(1)含义:用数字在能级符合右上角标明该能级上排布的电子数。
(2)举例:氯原子的电子排布式:1s22s22p63s23p5或[Ne]3s23p54.电子排布图
(1)含义:每个方框代表一个原子轨道,
每个箭头代表一个电子。(2)举例:氟原子的电子排布图: 命题聚焦
ming ti ju jiao聚焦1 原子结构及核外电子排布式【例1】 A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,
次外层有2个电子,其元素符号为 ;N解析:(1)A元素基态原子的电子排布图由题意可写成:
可见该元素原子核外有7个电子,为氮元素,其元素符号为N。(2)B元素的负一价离子和C元素的正一价离子 的电子层结构都与氩相同,
B的元素符号为 ,
C的元素符号为 ;ClK解析: B-、C+的电子层结构都与Ar相同,
即核外都有18个电子,
则B为17号元素Cl,C为19号元素K。(3)D元素的正三价离子的3d亚层为半充满,
D的元素符号为 ,
其基态原子的电子排布式;
__________________________解析: D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。Fe1s22s22p63s23p63d64s2(或[Ar]3d64s2)(4)E元素的基态原子的M层全充满,N层没有成对电子,
只有一个未成对电子,E的元素符号为 ,
其基态原子的电子排布式为
___________________________________。Cu解析: 根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,
该元素为29号元素Cu。1s22s22p63s23p63d104s1(或[Ar]3d104s1)聚焦2 元素周期表及位、构、性三者的关系【例2】 下图为元素周期表前三周期的一部分:
1)X的氢化物的沸点与W的氢化物的沸点比较:
> (填化学式),
原因是 。NH3PH3NH3可形成氢键,使NH3熔、沸点明显升高 (2)选出X的基态原子的电子排布图 ,
另一电子排布图不能作为基态原子的电子排布图
是因为它不符合 (填序号)。
A.能量最低原理
B.泡利原理
C.洪特规则② C (3)以上五种元素中,
(填元素符号)元素第一电离能最大。Ne (4)由以上某种元素与氢元素组成的三角锥形分子E和
由以上某种元素组成的直线形分子G反应,
生成两种直线形分子L和M
(组成E、G、L、M分子的元素原子序数均小于10),
反应如下图所示,
则下列判断错误的是 。
是最活泼的非金属单质B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键答案: CD解析:根据元素周期表的结构可知X为N,
Z为F,R为Ne,W为P,Y为S。
(1)X、W的氢化物为NH3和PH3,因NH3可以形成氢键,
故NH3的沸点、熔点显著升高,故沸点NH3>PH3。
(2)当电子排布在同一能级的不同轨道时,
总是优先单独占据一个轨道,
且自旋方向相同,因此N元素的基态原子的排布图为:
(3)原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定,失去电子所需能量越高,在所给五种元素中,Ne元素最外层已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多,即第一电离能最大。
(4)根据题给图示可知E为NH3,G为F2,L为HF,M为N2,NH3中N原子的杂化轨道类型为sp3杂化,在N2中N原子间以1个σ键和2个π键形成三键,故键能高,化学性质不活泼,故C、D错误。聚焦3 元素周期律(电离能、电负性等)及其应用【例3】 电离能是指气态原子或气态离子失去电子所需要的能量。从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依此类推。现有5种元素A、B、C、D、E,其中有三种金属元素,一种稀有气体元素,其I1~I3分别如下表。根据表中数据判断其中的金属元素有 ,
稀有气体元素有 ,
最活泼的金属元素是 ,
显+2价的金属元素是 。BCD EBD解析:第一电离能越小,说明该元素原子越易失去电子,
金属性越强;第一电离能越大,
说明该元素原子越不易失去电子,非金属性越强。
表中B、C、D三种元素的第一电离能相对比较小,
应该属于金属元素;E元素的第一电离能最大,
应该属于稀有气体元素;B元素的第一电离能最小,
应该是所列的元素中最活泼的金属元素;
D元素的第二电离能最小,且第三电离能最大,
说明D元素的原子很容易失去2个电子,
应该是显+2价的金属元素。聚焦4 以新科技为素材考查原子结构方面的知识【例4】 据报道:“来自美国劳伦斯Livermore
国家实验室和俄罗斯杜布纳联合核能协会的科学家宣布,
他们发现了最新的超重元素——第118号元素。
依照来自国家实验室的陈述,
在2006年2月和2005年6月通过JINR U400回旋加速器,
研究员观测到第118号元素的衰变过程。
这项成果被发表在2006年10月号的《物理评论》上。”
根据以上信息解答下列问题:(1)118号元素原子的结构示意图是 ,
价电子排布是 。7s27p6 (2)118号元素位于元素周期表的第 周期、
族。七0 (3)下列是关于118号元素性质的叙述,
其中正确的是 。
①单质在常温常压下是固体
②该元素的发现使“不完全周期”变为“完全周期”
③单质性质活泼,属于双原子分子② (4)制备118号元素的方法是用钙离子轰击锎(Cf)原子,
使两者的原子核结合,产生118号元素的原子,
那么锎元素的原子序数是 。
(5)实验室中制得的118号元素寿命很短,
立刻衰变为116号元素,在1 ms之后,
它立即衰变成第114号元素,
当它衰变为114号元素时,产生的其他原子是 。98氦原子(2个)解析:根据构造原理和能层能级的知识可得出
该元素的原子结构示意图,
以及价电子排布,
根据得出的原子结构可知该元素属于第七周期的最后一种元素,
即属于稀有气体元素,紧排在氡之下,
所以118号元素性质不活泼,
在常温常压下是气体;
118号元素的发现使第七周期划上了一个句号,所以不久的将来,第七周期跟第六周期一样应该是属于“长周期”。题目告诉的已知信息是118号元素由钙离子与锎原子的原子核结合而成,所以锎元素的原子核中质子数等于118减去钙原子的质子数,即118-20=98,故锎元素的原子序数为98。重核衰变时一般释放出α粒子,该粒子就是氦原子,即He。 高效作业
gao xiao zuo ye1.下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子
与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子
与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有一个电子的X原子
与3p轨道上只有一个电子的Y原子
D.最外层都只有一个电子的X、Y原子答案:C解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,
两者性质不相似。B项X原子为Mg,
而N层上有2个电子的有多种元素,
如第四周期中Ca、Fe等都符合,化学性质不一定相似。
C项为同主族的元素,化学性质一定相似。
D项最外层只有1个电子的ⅠA族元素原子可以,
过渡元素原子中也有很多最外层只有1个电子的,
故性质不一定相似。2.下列电子排布图中,
能正确表示该元素原子的最低能量状态的是( )答案:D解析:A、B两项不符合洪特规则;
C项,原子处于激发态,不是能量最低状态;
D项能够表示该元素原子的最低能量状态。3.主族元素原子失去最外层电子形成阳离子,
主族元素的原子得到电子填充在最外层形成阴离子。
下列各原子或离子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6 B.O2-:1s22s22p4
C.Cl-:1s22s22p63s23p6 D.Ar:1s22s22p63s23p6答案:B解析:氧离子(O2-)的核外电子排布式为1s22s22p6,
B选项是氧原子(O)的电子排布式。4.具有下列电子层结构的原子和离子,
其对应的元素一定属于同一周期的是( )
A.两原子的原子核外全部都是s电子
B.最外层电子排布为2s22p6的原子和最外层电子排布为
2s22p6的离子
C.原子核外M层上的s、p能级都充满电子,而d能级上没
有电子的两种原子
D.两原子N层上都有1个s电子,一个原子有d电子,另一个
原子无d电子答案:D解析:氢原子和锂原子都只有s电子,但不在同一周期,A错;2s22p6的离子如果是阳离子的话,对应的元素就和2s22p6的原子对应的元素不在同一周期,B错;虽然M层上的s、p能级都充满电子,且d能级没有电子,但5s上可能有电子或没有电子,C错。5.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应D解析:X的第一电离能(I1)显著小于I2、I3等,可知X最外层只有一个电子,故常见化合价为+1价,且与Cl元素形成XCl,A、C两项正确;Y元素的I1、I2、I3相差不悬殊,而与I4相差明显,故Y最外层有3个电子,为ⅢA族元素,当n=3时,Y为Al,与冷水不反应,故B正确,而D错误。6.下表列出前20号元素中的某些元素性质的一些数据:试回答下列问题:
(1)以上10种元素中,第一电离能最小的是 (填编号)。
(2)上述⑤⑥⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是 (写分子式)。
元素⑨和⑩形成的化合物的化学式为 ,它是一种重要的结构材料,推测它应是属于 晶体。元素①原子的价电子排布式是 。②PCl3、原子3s23p4 CCl4 Si3N4(3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由大到小的顺序是_________________________(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是 (填名称),可以验证你的结论的是下列中的 (填序号)。A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界的存在形式HCl>H2S>PH3>SiH4氮元素C、E解析:由题意知,10种元素是前20号元素,根据表中数据,我们不难推出①S,②K,③O,④Al,⑤C,⑥P,⑦Cl,⑧Na,⑨N,⑩Si。(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能逐渐增大;同一主族中,从上向下,元素的第一电离能逐渐减小;故在10种元素中,第一电离能最小的是②K。(2)C、P、Cl中的某两种元素形成的化合物中,PCl3或CCl4分子中的每一个原子都满足8e-稳定结构;元素⑨和⑩形成的化合物Si3N4属于原子晶体;S元素原子的价电子排布式是3s23p4。(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E验证。7.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:(1)X、Y的元素符号依次为 、 ;SC (2)XZ2与YZ2分子的空间构型分别是 和 ,
相同条件下两者在水中的溶解度较大的是
(写分子式),
理由是_______________________________________ V形 直线形SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(3)Q的元素符号是 ,它属于第 周期,
它的核外电子排布式为_______________________
在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
。Cr 四1s22s22p63s23p63d54s1 F—H…F、F—H…O、O—H…F、O—H…O+6解析:本题考查物质结构与性质中电子排布、分子空间结构、物质性质和氢键等知识。
X元素原子核外的M层中只有两对成对电子,可知其第三层为最外层,且有6个电子,则为硫元素;Y的L层有4个电子,为碳元素;地壳中含量最高的元素为氧元素,Z为氧元素;Q核电荷数=16+8=24,为铬元素;电负性最大的是F元素,所以E为氟元素。(1)X、Y元素符号分别为S、C。(2)SO2、CO2分子中前者有孤电子对,后者没有,所以前者为V形,后者为直线形,根据“相似相溶”原理,可知SO2的溶解度较大。(3)Q为Cr,由电子层结构可知,其最高化合价为+6价。(4)氢键是电负性大、半径较小的原子(如F、O、N)与氢原子之间的一种作用,用“…”表示氢键。8.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:(1)A和D的氢化物中,沸点较低的是 (填化学式);
A和D的电负性较大的是 (填元素符号);
B和C的第一电离能较小的是 (填元素符号);
构成C单质晶体的微粒以 键相结合。
(2)写出B、C的最高价氧化物对应的水化物相互反应的离子方程式:___________________________ HClFNa金属OH-+Al(OH)3===AlO+2H2O解析:因“A、D原子中某p能级均排有5个电子”,则可知A、D均为ⅦA族元素,分别为F、Cl。“B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水”,故B为钠、C为铝。E原子序数最大又与其他元素既不在同周期也不在同主族,则只能是钙。(1)根据元素的种类和元素周期律可解答各小问。(2)B、C的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者相互反应的离子方程式为:OH-+Al(OH)3===AlO+2H2O。9.下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。(1)请写出上图中d单质对应元素原子的电子排布式________________________________ 1s22s22p63s23p63d104s1 (2)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含 个
σ键和 个π键。32(3)a与b的元素形成的10电子中性分子X的空间构型为
_______
将X溶于水后的溶液滴入到AgNO3溶液中至过量,
得到络离子的化学式为 ,
其中X与Ag+之间以 键结合。三角锥形 [Ag(NH3)2]+配位(4)如图是上述六种元素中的一种元素形成的含氧酸的结构:
请简要说明该物质易溶于水的两个原因PZ_______________
_______________________________________
HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子形成氢键 解析:由图可知,六种单质依次为H2、N2、Na、Cu、Si、C。(2)单质a、f对应的元素以原子个数比1∶1形成的分子为乙炔,其中的碳碳叁键中含有一个σ键,两个π键,所以乙炔分子中共有3个σ键和2个π键。(3)要注意写络离子的化学式,不能写成整个络合物的化学式。10.请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式是
_________________________________________________ 51s22s22p63s23p63d104s24p1(或[Ar]
3d104s24p1)11.已知A、B、C、D和E 5种分子含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子核外电子排布式是 。
(2)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的分子式是 ,该反应的化学方程式为
________________
(3)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是 。1s22s22p63s23p6H2O22H2O2MnO22H2O+O2↑CH4O(答CH3OH也可)12.A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;NClK(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为
_______________________________________
(4)E元素的基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为________________________________ Fe1s22s22p63s23p63d64s2(或[Ar]3d64s2)Cu1s22s22p63s23p63d104s1(或[Ar]3d104s1)13.现有部分短周期元素的性质或原子结构如下表:(1)写出元素X的离子结构示意图: 。写出元素
Z的气态氢化物的电子式: (用元素符号表示)。(2)写出Y元素的最高价氧化物对应水化物的电离方程式:
_________________________________ (3)元素T与氯元素相比,非金属性较强的是 (用
元素符号表示),下列表述中能证明这一事实的是_______
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入NaCl水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态Fc 14.下图是元素周期表的一部分:
(1)a~h中第一电离能最大的元素名称为 。氖(2)a、b、c、d、e的单质的熔点由高到低的顺序为(用元素符号填写) 。
(3)实验证明,c、g组成的化合物在气态时实际的化学式为c2g6,它是具有配位键的化合物。分子中原子间成键的关系如下所示,请在你认为是配位键的斜线上加上箭头。C>Si>Al>Mg>Na答案: (3)(4)试根据下表列出的几种常见化学键的键能计算每摩尔e完全燃烧放出的热量: 。990 kJ15.据中国质量新闻网报道,日前从科技部获悉,我国成功研发出的铯原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。请你回答下列问题:(1)下列关于铯元素性质的叙述中正确的是 。
A.铯原子是非放射性元素中原子半径最大的原子
B.铯原子是非放射性元素中最容易失去电子的原子
C.铯是非放射性元素中电离能最大的元素
D.铯是非放射性元素中电负性最大的元素AB (2)下列表格中是与铯元素同主族的一种元素的各级电离能;根据以上表格中的数据分析,请你推测铯属于 族,常见化合价是 价,作出这种判断的理由是: 。 ⅠA +1 从电离能数据可以看出,
I1?I2,而I2~I7则没有如此突兀的变化
(3)下列对于铯及其化合 质的预测中正确的是 。 A.金属铯的熔点很高 B.金属铯能够在空气中燃烧,但产物只有氧化铯 C.氧化铯不溶于水 D.碳酸铯极易溶于水 D 解析:(1)同主族、周周期的元素性质变化如下表所示: (2)I1与I2之间存在突兀性的变化,所以其化合物为+1,属于第ⅠA族,即碱金属。 (3)碱金属元素中金属单质的熔沸点较低,在空气中燃烧产物不可能只有氧化物;碱金属的氯化物、碳酸盐均易溶于水。 16.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能为同周期主族元素第三高;F的基态原子核外成对电子数是单个电子数的3倍;G的基态原子中电子占据两种形状的原子轨道,且两轨道中的电子总数相同。 回答下列问题: (1)写出下列元素的符号:D ,G 。 SMg(2)D的前一元素第一电离能高于D的原因是 。 D的前一元素是P,P的3p能级为半充满状态的3p3,是稳定结构,而S元素的3p能级为3p4,是不稳定状态,故P的第一电离能高于S (3)由A、B、C形成的ABC分子中,含有 个σ键, 个π键。 2 2 (4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 (写化学式),原因是
______________________________________ MgSO4的晶格能大于K2SO4的晶格能 MgSO4
qing song xue jiao cai一、原子结构与核外电子排布
1.能层与能级
多电子原子的核外电子的能量是不同的,
按电子的能量差异将其分成不同的能层(n);
各能层最多容纳的电子数为2n2。
对于同一能层里能量不同的电子,
将其分成不同的能级(l);同一能层里,
能级的能量按s、p、d、f的顺序升高,
即E(s)<E(p)<E(d)<E(f)。
各能层所包含的能级类型及各能层、
能级最多容纳的电子数见下表:2.构造原理
绝大多数元素的原子核外电子的排布遵循如下图
所示的排布顺序,
人们把它称为构造原理。说明:(1)从图中可以看出,不同能层的能级有交错现象,
如E(3d)>E(4s)>、E(4d)>E(5s)、E(5d)>E(6s)、
E(6d)?>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。(2)构造原理是书写基态原子电子排布式的依据,
也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。3.基态原子核外电子排布式书写应遵循的规律
基态原子核外电子排布式的书写要考虑能量最低原理、
泡利不相容原理、洪特规则等多方面因素。“能量相同的原子轨道在全满
(如p6,d10)、半满(如p3,d5)和全空(p0,d0)状态时,
体系的能量最低”,这一点违反了洪特规则,
可看成是洪特规则的特例。
如:24Cr的电子排布式:
1s22s22p63s23p63d54s1(3d5、4s1均为半充满状态);
29Cu的电子排布式:
1s22s22p63s23p63d104s1(3d10为全充满状态,4s1为半充满状态)。注意:
(1)电子在跃迁时,
从较高能量的激发态跃迁到较低能量的激发态乃至基态时,
将释放能量,相反则吸收能量。
(2)电子跃迁的应用:因为每种原子的原子光谱是特定的,
所以用电子的跃迁可以判断元素的存在,
如应用焰色反应来判断元素的种类就是电子跃迁的应用。4.电子云和原子轨道
原子核外电子运动的特点是运动空间极小、极高速运动。
所以要用电子云来描述核外电子运动特征。
1s、2s、3s、4s相比较,
原子轨道半径大小顺序是1s<2s<3s<4s。2px、3px、4px
相比较,
原子轨道半径大小顺序是2px<3px<4px。
下面是部分原子轨道图:二、原子结构与元素周期律
1.原子结构与元素周期表
(1)核外电子排布与周期的划分:
一个能级组最多容纳的电子数等于一个周期所包含的元素种数,
因此元素周期表中7个周期分别对应着7个能级组,
前6个周期对应的元素种数分别为2、8、8、18、18、32。
周期的划分与主量子数n有关:最外层电子的主量子数为n时,
该元素属第n周期。(2)核外电子排布与族的划分:族的划分与原子的价电子数和价电子排布有关。
(3)元素周期表区的划分
s区元素:ⅠA和ⅡA族;p区元素:ⅢA~ⅦA和0族;
d区元素:ⅢB~Ⅷ族;ds区元素:
包括ⅠB和ⅡB族;f区元素:
包括镧系元素和锕系元素。
2.原子半径、电离能、电负性等元素性质的周期性变化
(1)原子半径:影响原子半径大小的因素有电子的能层数、
核电荷数。同周期元素(稀有气体元素除外)
从左到右原子半径逐渐减小,
同主族元素从上到下原子半径逐渐增大。(2)电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能(用I1表示),一价气态基态正离子再失去一个电子所需消耗的最低能量叫做第二电离能(用I2表示),依此类推,可得到I3、I4……同一种元素的逐级电离能的大小关系为I1<I2<I3<I4<……即一个原子的逐级电离能是逐渐增大的。这是因为随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多。每个周期的第一个元素第一电离能最小,
最后一个元素的第一电离能最大;
同族元素从上到下第一电离能变小。(3)电负性
原子的电负性用以量度原子对成键电子吸引能力的相对大
小,所以电负性表示的是原子吸引成键电子能力的相对强
弱。同周期元素从左向右随着原子序数的递增,原子的电
负性逐渐增大;同一主族元素从上到下,电负性逐渐减小
电负性的大小也可以作为判断元素金属性和非金属性强弱
的尺度。金属的电负性一般小于1.8,非金属的电负性一般
大于1.8电负性的应用:(1)判断金属元素和非金属元素:
电负性小于2的多为金属元素,而大于2的元素多为非金属元素。
(2)判断化合物中元素化合价的正负:
化合物中电负性小的元素显正化合价,
而电负性大的显负化合价,如HF中,电负性F>H,
F元素和H元素的化合价分别为-1价和+1价。
(3)判断化学键的类型:
电负性差值大的元素原子间形成的化学键主要是离子键,
而电负性差值小的元素原子间形成的化学键主要是共价键。
体验热身
ti yan re shen1.下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多答案:A解析:3p2表示在3p轨道上有2个电子;
同一原子中1s、2s、3s电子的能量依次升高;
同一原子中2p、3p、4p能级的轨道数相同。2.下图为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的价电子排布式为nsnnpn+1,
该元素原子的核外最外层电子的成对电子为
_______________________________对。⑨11s22s22p63s23p63d64s2(4)元素④的氢化物的分子构型为 ,
中心原子的杂化形式为 杂化。
(5)第三周期8种元素单质熔点高低的顺序如下图,
三角锥形 2其中序号“8”代表 (填元素符号);
其中电负性最大的是 (填图中的序号)。三角锥形 Si2sp3 解析:(2)⑨号元素是Fe元素,其电子排布式为
1s22s22p63s23p63d64s2。
(3)由nsnnpn+1可知n=2,则该元素是N,
其最外层成对电子只有1对。
(4)元素④是氮元素,其氢化物的分子构型是三角锥形。
(5)第三周期熔点最高的单质应是Si;电负性最大的是Cl,
即图中的2。3.A、B、C分别代表3种不同的短周期元素。
A元素的原子最外层电子排布为ns1;
B元素原子的M电子层中有2个未成对电子;
C元素原子的L电子层的p能级中有4个电子。
(1)若A元素的原子最外层电子排布为1s1,
B的最高化合价为+6价,
则B原子的价电子排布式为 ,
按原子轨道的重叠方式,
A与B形成的化合物中的共价键属于 键。3s23p4 σ(2)若B的最高化合价为+4价,B的原子结构 。
示意图为 ,
B与C形成的晶体中微粒间的作用力是 ,
其熔点比干冰的熔点高的原因是 答案: 共价键 二氧化硅为原子晶体,微粒间的作用力是共价键;
二氧化碳为分子晶体,微粒间的作用力是范德华力(3)若A元素的原子最外层电子排布为3s1,
B的最高化合价为+4价,
元素A在周期表中的位置是_______________,
A、B、C三种元素的第一电离能由大到小的顺序是
(用元素符号表示)。第三周期ⅠA族O>Si>Na解析:(1)由题意知A为H元素,B为S元素,
B原子的价电子排布式为3s23p4,
H原子和S原子形成的化学键为σ键。
(2)若B的最高价为+4价,
则B应为Si元素,
原子结构示意图为
C元素为O元素,Si和O形成的晶体是原子晶体,
微粒间作用力是共价键,比干冰中的分子间作用力要强得多。(3)若A的最外层电子排布为3s1,则A为Na元素,B为Si元素,
A、B、C的第一电离能大小顺序为O>Si>Na。
重点探究
zhong dian tan jiu表示原子结构的化学用语1.原子结构示意图
(1)含义:表示原子核外电子分层排布和核电荷数。 (2)举例:硫的原子结构示意图: 2.电子式
(1)含义:表示原子的最外层电子数。
(2)举例:氮原子的电子式
3.电子排布式
(1)含义:用数字在能级符合右上角标明该能级上排布的电子数。
(2)举例:氯原子的电子排布式:1s22s22p63s23p5或[Ne]3s23p54.电子排布图
(1)含义:每个方框代表一个原子轨道,
每个箭头代表一个电子。(2)举例:氟原子的电子排布图: 命题聚焦
ming ti ju jiao聚焦1 原子结构及核外电子排布式【例1】 A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,
次外层有2个电子,其元素符号为 ;N解析:(1)A元素基态原子的电子排布图由题意可写成:
可见该元素原子核外有7个电子,为氮元素,其元素符号为N。(2)B元素的负一价离子和C元素的正一价离子 的电子层结构都与氩相同,
B的元素符号为 ,
C的元素符号为 ;ClK解析: B-、C+的电子层结构都与Ar相同,
即核外都有18个电子,
则B为17号元素Cl,C为19号元素K。(3)D元素的正三价离子的3d亚层为半充满,
D的元素符号为 ,
其基态原子的电子排布式;
__________________________解析: D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。Fe1s22s22p63s23p63d64s2(或[Ar]3d64s2)(4)E元素的基态原子的M层全充满,N层没有成对电子,
只有一个未成对电子,E的元素符号为 ,
其基态原子的电子排布式为
___________________________________。Cu解析: 根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,
该元素为29号元素Cu。1s22s22p63s23p63d104s1(或[Ar]3d104s1)聚焦2 元素周期表及位、构、性三者的关系【例2】 下图为元素周期表前三周期的一部分:
1)X的氢化物的沸点与W的氢化物的沸点比较:
> (填化学式),
原因是 。NH3PH3NH3可形成氢键,使NH3熔、沸点明显升高 (2)选出X的基态原子的电子排布图 ,
另一电子排布图不能作为基态原子的电子排布图
是因为它不符合 (填序号)。
A.能量最低原理
B.泡利原理
C.洪特规则② C (3)以上五种元素中,
(填元素符号)元素第一电离能最大。Ne (4)由以上某种元素与氢元素组成的三角锥形分子E和
由以上某种元素组成的直线形分子G反应,
生成两种直线形分子L和M
(组成E、G、L、M分子的元素原子序数均小于10),
反应如下图所示,
则下列判断错误的是 。
是最活泼的非金属单质B.L是极性分子
C.E的中心原子杂化轨道类型为sp2杂化
D.M的化学性质比同主族相邻元素单质的化学性质活泼
E.M分子中有1个σ键,2个π键答案: CD解析:根据元素周期表的结构可知X为N,
Z为F,R为Ne,W为P,Y为S。
(1)X、W的氢化物为NH3和PH3,因NH3可以形成氢键,
故NH3的沸点、熔点显著升高,故沸点NH3>PH3。
(2)当电子排布在同一能级的不同轨道时,
总是优先单独占据一个轨道,
且自旋方向相同,因此N元素的基态原子的排布图为:
(3)原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定,失去电子所需能量越高,在所给五种元素中,Ne元素最外层已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多,即第一电离能最大。
(4)根据题给图示可知E为NH3,G为F2,L为HF,M为N2,NH3中N原子的杂化轨道类型为sp3杂化,在N2中N原子间以1个σ键和2个π键形成三键,故键能高,化学性质不活泼,故C、D错误。聚焦3 元素周期律(电离能、电负性等)及其应用【例3】 电离能是指气态原子或气态离子失去电子所需要的能量。从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依此类推。现有5种元素A、B、C、D、E,其中有三种金属元素,一种稀有气体元素,其I1~I3分别如下表。根据表中数据判断其中的金属元素有 ,
稀有气体元素有 ,
最活泼的金属元素是 ,
显+2价的金属元素是 。BCD EBD解析:第一电离能越小,说明该元素原子越易失去电子,
金属性越强;第一电离能越大,
说明该元素原子越不易失去电子,非金属性越强。
表中B、C、D三种元素的第一电离能相对比较小,
应该属于金属元素;E元素的第一电离能最大,
应该属于稀有气体元素;B元素的第一电离能最小,
应该是所列的元素中最活泼的金属元素;
D元素的第二电离能最小,且第三电离能最大,
说明D元素的原子很容易失去2个电子,
应该是显+2价的金属元素。聚焦4 以新科技为素材考查原子结构方面的知识【例4】 据报道:“来自美国劳伦斯Livermore
国家实验室和俄罗斯杜布纳联合核能协会的科学家宣布,
他们发现了最新的超重元素——第118号元素。
依照来自国家实验室的陈述,
在2006年2月和2005年6月通过JINR U400回旋加速器,
研究员观测到第118号元素的衰变过程。
这项成果被发表在2006年10月号的《物理评论》上。”
根据以上信息解答下列问题:(1)118号元素原子的结构示意图是 ,
价电子排布是 。7s27p6 (2)118号元素位于元素周期表的第 周期、
族。七0 (3)下列是关于118号元素性质的叙述,
其中正确的是 。
①单质在常温常压下是固体
②该元素的发现使“不完全周期”变为“完全周期”
③单质性质活泼,属于双原子分子② (4)制备118号元素的方法是用钙离子轰击锎(Cf)原子,
使两者的原子核结合,产生118号元素的原子,
那么锎元素的原子序数是 。
(5)实验室中制得的118号元素寿命很短,
立刻衰变为116号元素,在1 ms之后,
它立即衰变成第114号元素,
当它衰变为114号元素时,产生的其他原子是 。98氦原子(2个)解析:根据构造原理和能层能级的知识可得出
该元素的原子结构示意图,
以及价电子排布,
根据得出的原子结构可知该元素属于第七周期的最后一种元素,
即属于稀有气体元素,紧排在氡之下,
所以118号元素性质不活泼,
在常温常压下是气体;
118号元素的发现使第七周期划上了一个句号,所以不久的将来,第七周期跟第六周期一样应该是属于“长周期”。题目告诉的已知信息是118号元素由钙离子与锎原子的原子核结合而成,所以锎元素的原子核中质子数等于118减去钙原子的质子数,即118-20=98,故锎元素的原子序数为98。重核衰变时一般释放出α粒子,该粒子就是氦原子,即He。 高效作业
gao xiao zuo ye1.下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子
与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子
与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有一个电子的X原子
与3p轨道上只有一个电子的Y原子
D.最外层都只有一个电子的X、Y原子答案:C解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,
两者性质不相似。B项X原子为Mg,
而N层上有2个电子的有多种元素,
如第四周期中Ca、Fe等都符合,化学性质不一定相似。
C项为同主族的元素,化学性质一定相似。
D项最外层只有1个电子的ⅠA族元素原子可以,
过渡元素原子中也有很多最外层只有1个电子的,
故性质不一定相似。2.下列电子排布图中,
能正确表示该元素原子的最低能量状态的是( )答案:D解析:A、B两项不符合洪特规则;
C项,原子处于激发态,不是能量最低状态;
D项能够表示该元素原子的最低能量状态。3.主族元素原子失去最外层电子形成阳离子,
主族元素的原子得到电子填充在最外层形成阴离子。
下列各原子或离子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6 B.O2-:1s22s22p4
C.Cl-:1s22s22p63s23p6 D.Ar:1s22s22p63s23p6答案:B解析:氧离子(O2-)的核外电子排布式为1s22s22p6,
B选项是氧原子(O)的电子排布式。4.具有下列电子层结构的原子和离子,
其对应的元素一定属于同一周期的是( )
A.两原子的原子核外全部都是s电子
B.最外层电子排布为2s22p6的原子和最外层电子排布为
2s22p6的离子
C.原子核外M层上的s、p能级都充满电子,而d能级上没
有电子的两种原子
D.两原子N层上都有1个s电子,一个原子有d电子,另一个
原子无d电子答案:D解析:氢原子和锂原子都只有s电子,但不在同一周期,A错;2s22p6的离子如果是阳离子的话,对应的元素就和2s22p6的原子对应的元素不在同一周期,B错;虽然M层上的s、p能级都充满电子,且d能级没有电子,但5s上可能有电子或没有电子,C错。5.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应D解析:X的第一电离能(I1)显著小于I2、I3等,可知X最外层只有一个电子,故常见化合价为+1价,且与Cl元素形成XCl,A、C两项正确;Y元素的I1、I2、I3相差不悬殊,而与I4相差明显,故Y最外层有3个电子,为ⅢA族元素,当n=3时,Y为Al,与冷水不反应,故B正确,而D错误。6.下表列出前20号元素中的某些元素性质的一些数据:试回答下列问题:
(1)以上10种元素中,第一电离能最小的是 (填编号)。
(2)上述⑤⑥⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是 (写分子式)。
元素⑨和⑩形成的化合物的化学式为 ,它是一种重要的结构材料,推测它应是属于 晶体。元素①原子的价电子排布式是 。②PCl3、原子3s23p4 CCl4 Si3N4(3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由大到小的顺序是_________________________(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是 (填名称),可以验证你的结论的是下列中的 (填序号)。A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界的存在形式HCl>H2S>PH3>SiH4氮元素C、E解析:由题意知,10种元素是前20号元素,根据表中数据,我们不难推出①S,②K,③O,④Al,⑤C,⑥P,⑦Cl,⑧Na,⑨N,⑩Si。(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能逐渐增大;同一主族中,从上向下,元素的第一电离能逐渐减小;故在10种元素中,第一电离能最小的是②K。(2)C、P、Cl中的某两种元素形成的化合物中,PCl3或CCl4分子中的每一个原子都满足8e-稳定结构;元素⑨和⑩形成的化合物Si3N4属于原子晶体;S元素原子的价电子排布式是3s23p4。(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E验证。7.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:(1)X、Y的元素符号依次为 、 ;SC (2)XZ2与YZ2分子的空间构型分别是 和 ,
相同条件下两者在水中的溶解度较大的是
(写分子式),
理由是_______________________________________ V形 直线形SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(3)Q的元素符号是 ,它属于第 周期,
它的核外电子排布式为_______________________
在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
。Cr 四1s22s22p63s23p63d54s1 F—H…F、F—H…O、O—H…F、O—H…O+6解析:本题考查物质结构与性质中电子排布、分子空间结构、物质性质和氢键等知识。
X元素原子核外的M层中只有两对成对电子,可知其第三层为最外层,且有6个电子,则为硫元素;Y的L层有4个电子,为碳元素;地壳中含量最高的元素为氧元素,Z为氧元素;Q核电荷数=16+8=24,为铬元素;电负性最大的是F元素,所以E为氟元素。(1)X、Y元素符号分别为S、C。(2)SO2、CO2分子中前者有孤电子对,后者没有,所以前者为V形,后者为直线形,根据“相似相溶”原理,可知SO2的溶解度较大。(3)Q为Cr,由电子层结构可知,其最高化合价为+6价。(4)氢键是电负性大、半径较小的原子(如F、O、N)与氢原子之间的一种作用,用“…”表示氢键。8.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:(1)A和D的氢化物中,沸点较低的是 (填化学式);
A和D的电负性较大的是 (填元素符号);
B和C的第一电离能较小的是 (填元素符号);
构成C单质晶体的微粒以 键相结合。
(2)写出B、C的最高价氧化物对应的水化物相互反应的离子方程式:___________________________ HClFNa金属OH-+Al(OH)3===AlO+2H2O解析:因“A、D原子中某p能级均排有5个电子”,则可知A、D均为ⅦA族元素,分别为F、Cl。“B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水”,故B为钠、C为铝。E原子序数最大又与其他元素既不在同周期也不在同主族,则只能是钙。(1)根据元素的种类和元素周期律可解答各小问。(2)B、C的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者相互反应的离子方程式为:OH-+Al(OH)3===AlO+2H2O。9.下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。(1)请写出上图中d单质对应元素原子的电子排布式________________________________ 1s22s22p63s23p63d104s1 (2)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含 个
σ键和 个π键。32(3)a与b的元素形成的10电子中性分子X的空间构型为
_______
将X溶于水后的溶液滴入到AgNO3溶液中至过量,
得到络离子的化学式为 ,
其中X与Ag+之间以 键结合。三角锥形 [Ag(NH3)2]+配位(4)如图是上述六种元素中的一种元素形成的含氧酸的结构:
请简要说明该物质易溶于水的两个原因PZ_______________
_______________________________________
HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子形成氢键 解析:由图可知,六种单质依次为H2、N2、Na、Cu、Si、C。(2)单质a、f对应的元素以原子个数比1∶1形成的分子为乙炔,其中的碳碳叁键中含有一个σ键,两个π键,所以乙炔分子中共有3个σ键和2个π键。(3)要注意写络离子的化学式,不能写成整个络合物的化学式。10.请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式是
_________________________________________________ 51s22s22p63s23p63d104s24p1(或[Ar]
3d104s24p1)11.已知A、B、C、D和E 5种分子含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子核外电子排布式是 。
(2)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的分子式是 ,该反应的化学方程式为
________________
(3)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是 。1s22s22p63s23p6H2O22H2O2MnO22H2O+O2↑CH4O(答CH3OH也可)12.A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;NClK(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为
_______________________________________
(4)E元素的基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为________________________________ Fe1s22s22p63s23p63d64s2(或[Ar]3d64s2)Cu1s22s22p63s23p63d104s1(或[Ar]3d104s1)13.现有部分短周期元素的性质或原子结构如下表:(1)写出元素X的离子结构示意图: 。写出元素
Z的气态氢化物的电子式: (用元素符号表示)。(2)写出Y元素的最高价氧化物对应水化物的电离方程式:
_________________________________ (3)元素T与氯元素相比,非金属性较强的是 (用
元素符号表示),下列表述中能证明这一事实的是_______
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入NaCl水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态Fc 14.下图是元素周期表的一部分:
(1)a~h中第一电离能最大的元素名称为 。氖(2)a、b、c、d、e的单质的熔点由高到低的顺序为(用元素符号填写) 。
(3)实验证明,c、g组成的化合物在气态时实际的化学式为c2g6,它是具有配位键的化合物。分子中原子间成键的关系如下所示,请在你认为是配位键的斜线上加上箭头。C>Si>Al>Mg>Na答案: (3)(4)试根据下表列出的几种常见化学键的键能计算每摩尔e完全燃烧放出的热量: 。990 kJ15.据中国质量新闻网报道,日前从科技部获悉,我国成功研发出的铯原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。请你回答下列问题:(1)下列关于铯元素性质的叙述中正确的是 。
A.铯原子是非放射性元素中原子半径最大的原子
B.铯原子是非放射性元素中最容易失去电子的原子
C.铯是非放射性元素中电离能最大的元素
D.铯是非放射性元素中电负性最大的元素AB (2)下列表格中是与铯元素同主族的一种元素的各级电离能;根据以上表格中的数据分析,请你推测铯属于 族,常见化合价是 价,作出这种判断的理由是: 。 ⅠA +1 从电离能数据可以看出,
I1?I2,而I2~I7则没有如此突兀的变化
(3)下列对于铯及其化合 质的预测中正确的是 。 A.金属铯的熔点很高 B.金属铯能够在空气中燃烧,但产物只有氧化铯 C.氧化铯不溶于水 D.碳酸铯极易溶于水 D 解析:(1)同主族、周周期的元素性质变化如下表所示: (2)I1与I2之间存在突兀性的变化,所以其化合物为+1,属于第ⅠA族,即碱金属。 (3)碱金属元素中金属单质的熔沸点较低,在空气中燃烧产物不可能只有氧化物;碱金属的氯化物、碳酸盐均易溶于水。 16.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能为同周期主族元素第三高;F的基态原子核外成对电子数是单个电子数的3倍;G的基态原子中电子占据两种形状的原子轨道,且两轨道中的电子总数相同。 回答下列问题: (1)写出下列元素的符号:D ,G 。 SMg(2)D的前一元素第一电离能高于D的原因是 。 D的前一元素是P,P的3p能级为半充满状态的3p3,是稳定结构,而S元素的3p能级为3p4,是不稳定状态,故P的第一电离能高于S (3)由A、B、C形成的ABC分子中,含有 个σ键, 个π键。 2 2 (4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 (写化学式),原因是
______________________________________ MgSO4的晶格能大于K2SO4的晶格能 MgSO4
同课章节目录
