2011届高考化学总复习课件系列 学案44 晶体结构与性质
文档属性
| 名称 | 2011届高考化学总复习课件系列 学案44 晶体结构与性质 |  | |
| 格式 | rar | ||
| 文件大小 | 707.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-09 13:16:00 | ||
图片预览







文档简介
课件111张PPT。第十九章 晶体结构与性质
学案44 晶体结构与性质
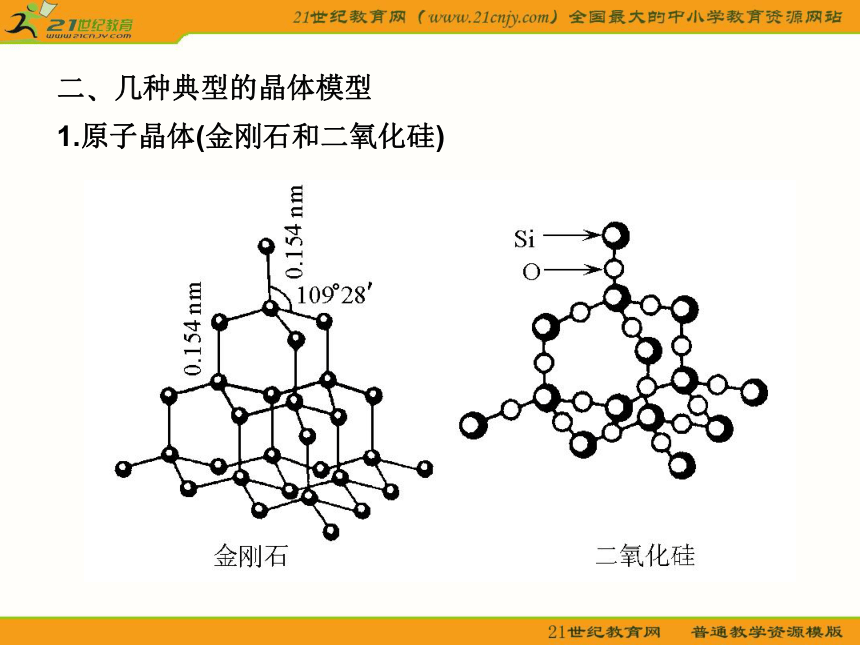
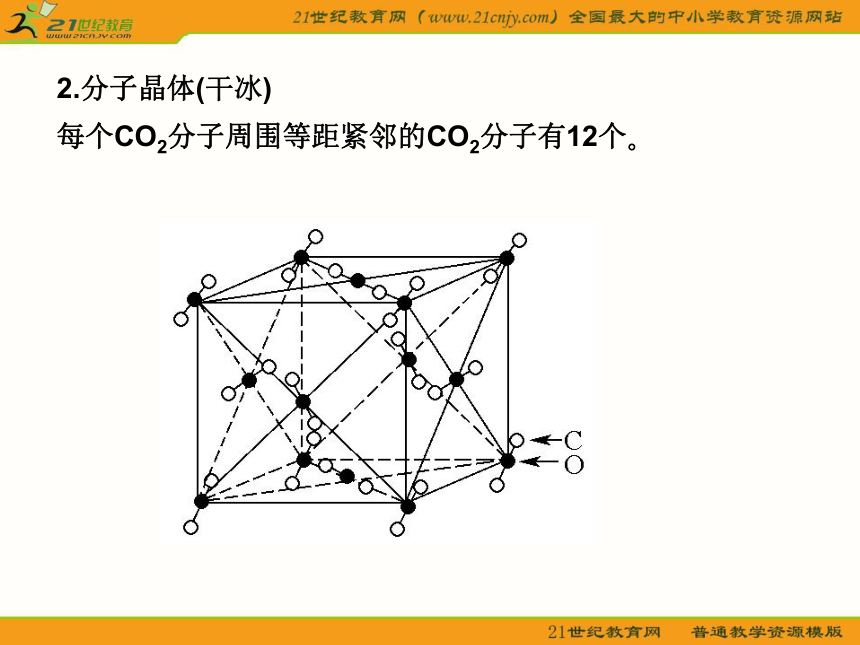
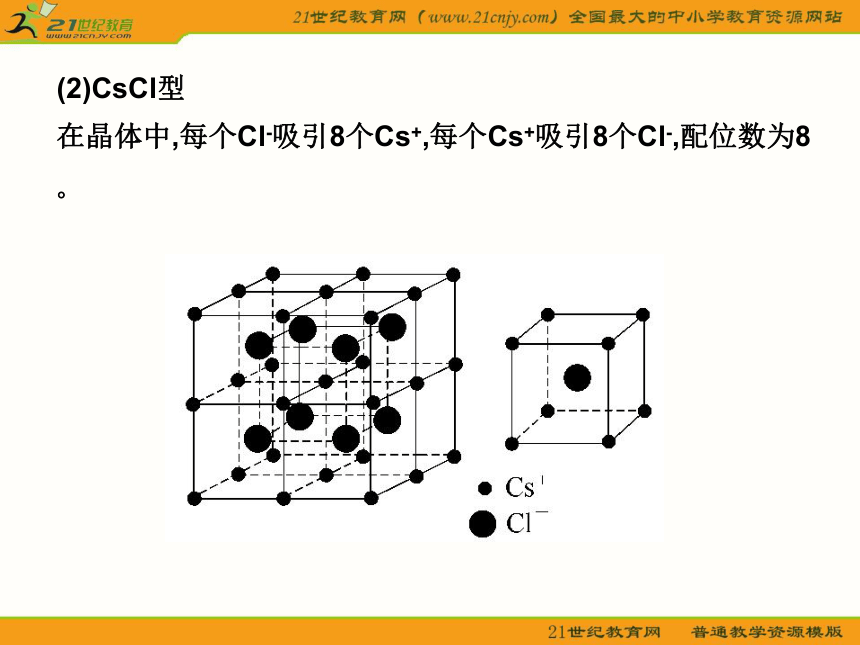
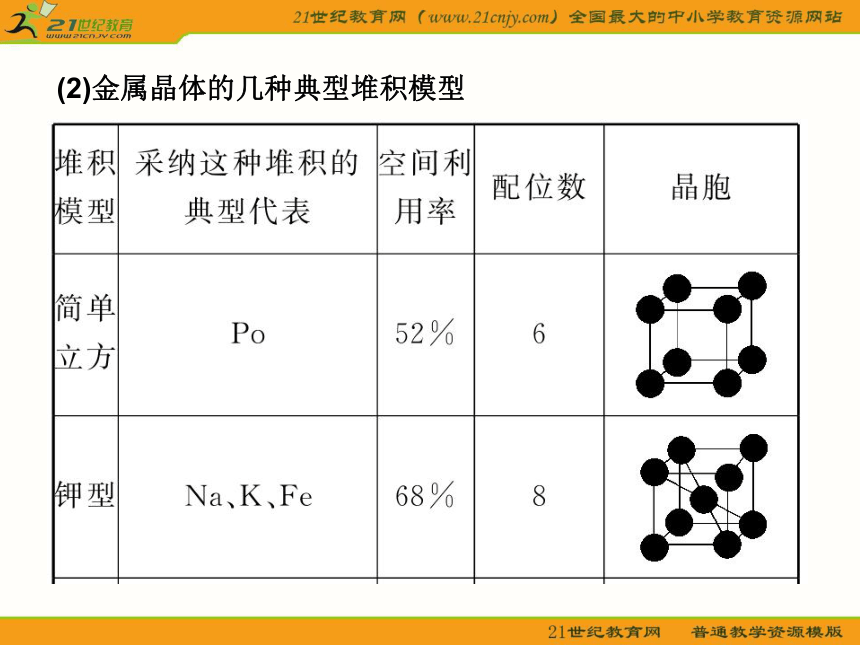
轻松学教材 一?晶体的常识 1.晶体与非晶体 (1)晶体 结构特征:原子在三维空间里呈周期性有序排列? 性质特征:有自范性?固定熔点?对称性?各向异性? (2)非晶体 结构特征:原子无序排列? 性质特征:没有自范性?固定熔点?对称性?各向异性? 2.晶胞 晶胞是描述晶体结构的基本单元?晶胞在晶体中的排列呈“无隙并置”? 二?几种典型的晶体模型 1.原子晶体(金刚石和二氧化硅) 金刚石键角为109°28′,每个最小的环上有6个碳原子?SiO2(正四面体,O—Si键角)为109°28′,每个最小的环上有12个原子,其中有6个Si和6个O? 2.分子晶体(干冰) 每个CO2分子周围等距紧邻的CO2分子有12个? 3.离子晶体 (1)NaCl型 在晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,配位数为6?每个晶胞含4个Na+和4个Cl-? (2)CsCl型 在晶体中,每个Cl-吸引8个Cs+,每个Cs+吸引8个Cl-,配位数为8? (3)晶格能 ①定义:气态离子形成1 mol离子晶体释放的能量,单位kJ·mol-1,通常取正值? ②影响因素 a.离子所带电荷:离子所带电荷越多,晶格能越大? b.离子的半径:离子的半径越小,晶格能越大? ③与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大? 4.金属晶体 (1)金属键——电子气理论 金属阳离子与自由电子间的相互作用? (2)金属晶体的几种典型堆积模型三?晶体的基本类型和性质比较 体验热身 1.下列有关晶体的叙述,错误的是( ) A.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 B.白磷晶体中,结构微粒之间通过共价键结合 C.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 D.分子晶体的熔点最低 答案:BD 解析:离子晶体是通过离子键将阴?阳离子结合在一起的,所以熔化时,离子键被破坏;而分子晶体是通过范德华力将分子结合在一起的,所以熔化时,分子内部的化学键未发生变化,破坏的只是范德华力,则A正确?白磷晶体属于分子晶体,在P4内部存在共价键,而结构微粒(P4)之间是通过范德华力结合的,则B错误?石英晶体(SiO2)是原子晶体,则C正确?分子晶体S?P等的熔点高于金属汞的熔点,所以D错? 2.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( ) A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体 C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中 答案:A 解析:晶体类型相同,克服粒子间作用力相同?3.用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( ) A.云母是热的不良导体,传热不均匀 B.石蜡是热的不良导体,传热不均匀 C.石蜡具有各向异性,不同方向导热性能不同 D.云母具有各向异性,不同方向导热性能不同 答案:D 解析:据题目叙述,可知云母具有各向异性,不同方向导热性不同,使石蜡熔化成椭圆形? 4.如图所示是某原子晶体A空间结构中的一个单元,A与某物质B反应生成C,其实质是每个A—A键中插入一个B原子,则C物质的化学式为( ) A.AB B.A5B4 C.AB2 D.A2B5 答案:C 解析:据题意可知一个A原子结合4个B原子,而一个B原子结合2个A原子,则A?B原子个数比为1∶2,C的化学式为AB2(本题亦可从SiO2的形成思考:图中A为Si原子,插入的B原子为氧,可得SiO2晶体,则C的化学式为AB2)?需注意:此图是某原子晶体空间结构中的一个单元? 5.下列组合中,晶胞的排列一致的是( ) A.ZnS?NaCl B.Cu?Mg C.NaCl?KCl D.CsCl?MgO 答案:C解析:A中ZnS与NaCl显然不一致;B中Cu属A1型,Mg属A3型;D中MgO属NaCl型;只有C中两物质一致? 6.有下列八种晶体: A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石 用序号回答下列问题: (1)属于原子晶体的化合物是__________?直接由原子构成的晶体是_____,直接由原子构成的分子晶体是______? (2)由极性分子构成的晶体是__________,含有共价键的离子晶体是________,属于分子晶体的单质是__________? (3)在一定条件下能导电而不发生化学变化的是__________,受热熔化后化学键不发生变化的是___________,需克服共价键的是____________? AAEHBFDEGBDEAH解析:首先正确地判断晶体类型,其次注意题目的附加要求,如属于原子晶体的化合物,另外稀有气体为单原子分子,金属晶体导电时仅是自由电子在外加电场作用下发生定向移动,属物理变化? 重点探究 晶胞中微粒数目的计算 计算晶胞中微粒数目的常用方法是均摊法?均摊法是指每个晶胞平均拥有的粒子数目?如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞?(1)长方体(或正方体)晶胞中不同位置的粒子的计算 ①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有 属于该晶胞; ②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有 属于该晶胞; ③处于面上的粒子,同时为2个晶胞所共有,每个粒子有 属于该晶胞; ④处于晶胞内部的粒子,则完全属于该晶胞? (2)非长方体(或正方体)晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占1/3? 特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定势,任何形状的晶胞均使用上述计算方法?不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点?侧棱?底面上的棱?面心上的粒子依次被6?3?4?2个晶胞共用. 晶体熔?沸点高低的比较 1.不同类型晶体的熔?沸点高低的一般规律 原子晶体>离子晶体>分子晶体? 金属晶体的熔?沸点差别很大,如钨?铂等沸点很高,如汞?镓?铯等沸点很低? 2.原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔?沸点高?如熔点:金刚石>石英>碳化硅>硅? 3.离子晶体 一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔?沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl? 4.分子晶体 (1)分子间作用力越大,物质的熔?沸点越高;具有分子间氢键的分子晶体,熔?沸点反常地高?如H2O>H2Te>H2Se>H2S? (2)组成和结构相似的分子晶体,相对分子质量越大,熔?沸点越高,如SnH4>GeH4>SiH4>CH4? (3)组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔?沸点越高,如CO>N2,CH3OH>CH3CH3? (4)同分异构体,支链越多,熔?沸点越低? 5.金属晶体 金属离子半径越小,离子的电荷数越多,其金属键越强,金属熔?沸点就越高,如熔?沸点:Na金刚石>NaCl>CsCl>干冰解析:根据不同物质晶体的结构特点来辨别图形所代表的物质?NaCl晶体是简单立方单元,每个Na+与6个Cl-紧邻,每个Cl-又与6个Na+紧邻,但观察与Na+距离最近且等距离的Na+数目时要抛开Cl-,从空间结构上看是12个Na+?CsCl晶体由Cs+?Cl-构成立方结构,但Cs+组成立方体的中心有1个Cl-,Cl-组成的立方体中心又镶入1个Cs+,可称为“体心立方”结构?Cl-紧邻8个Cs+,Cs+紧邻8个Cl-?干冰也是立方体结构,但在立方体每个正方形面的中央都有一个CO2分子?每个CO2分子紧邻12个CO2分子?金刚石的基本单元是正四面体形?每个碳原子紧邻4个其他碳原子?石墨的片层由正六边形结构组成,每个碳原子紧邻另外3个碳原子,每个碳原子为三个六边形共用,即每个六边形占有1个碳原子的1/3,所以大的结构中每个六边形占有的碳原子数是6× =2个?
晶体熔点通常由粒子间作用力而定?原子晶体中原子间共价键牢固,熔点很高?分子晶体的分子间作用力较弱,熔沸点较低?聚焦4 关于晶体的计算
【例4】 某离子晶体晶胞的结构如图所示,X位于立方体顶点,Y位于立方体中心?试分析:(1)晶体中每个Y同时吸引着________________个X,每个X同时吸引着______________个Y,该晶体的化学式为________________?
(2)晶体中每个X周围与它最接近且距离相等的X共有__________个?48XY212(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是__________?
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心 距离为__________cm?
109°28′解析:(1)同时吸引的原子个数即指在某原子周围距离最近且相等的其他种类的原子个数,观察上图可知,Y位于立方体的体心,X位于立方体的顶点,每个Y同时吸引着4个X,而每个X同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,晶体的化学式应为阴?阳离子的个数比,X?Y的个数比为4∶8,所以化学式为XY2?
(2)晶体中每个X和与它最接近的X之间的距离应为右图所示立方体的面对角线,在此X的上层?下层和同一层,每层均有4个X,共有12个? (3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知∠XYX=109°28′? 方法归纳:确定晶胞中粒子数目,首先看给出的图形是否为晶体的晶胞,若是晶体的晶胞,再分析若某个粒子为n个晶胞共有,则该粒子有 属于该晶胞;若不是晶体的晶胞,则按实际结构找相应粒子的数目?
高效作业
1.下列性质适合于分子晶体的是( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
答案:BC
解析:分子晶体,熔点低,液态不导电,易溶于溶剂(相似相溶)?
2.纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因?假设某纳米颗粒的大小和形状恰好与某晶体晶胞的大小和形状(如图)相同,则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )
A.87.5%
B.88.9%
C.96.3%
D.100% 答案:B
3.金属晶体具有延展性的原因是( )
A.金属键很微弱
B.金属键没有饱和性
C.密堆积层的阳离子容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键
D.金属阳离子之间存在斥力 答案:C解析:金属晶体具有延展性是由于密堆积层的阳离子受到外力作用时容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键?4.下列各组物质的晶体中,化学键类型相同?晶体类型也相同的是( )
A.SO2和SiO2
B.CO2和H2O
C.NaCl和HCl
D.CCl4和KCl
答案:B
解析:A项中两种化合物分子均为共价键结合的分子,但SO2形成分子晶体,SiO2为原子晶体?B项中两分子均为共价键结合的分子,且均形成分子晶体?C项中NaCl中含离子键,HCl为共价键结合的分子,前者是离子晶体,后者是分子晶体?D项中CCl4是以共价键结合的分子晶体,KCl中含离子键,为离子晶体?
5.科学家发现了一种新能源——“可燃冰”?它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)?其形成过程是埋于海底地层深处的大量有机质在缺氧环境中,被厌氧性细菌分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”?这种“可燃冰”的晶体类型是( )
A.离子晶体 B.分子晶体
C.原子晶体 D.金属晶体
答案:B
解析:“可燃冰”的晶体中的结构微粒是CH4分子和水分子,水分子之间以氢键和范德华力相结合,CH4分子和水分子之间以范德华力相结合,形成的晶体为分子晶体?
6.已知X?Y?Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )
A.ZXY3
B. ZX2Y6
C. ZX4Y8
D.ZX8Y12答案:A
7.下列说法中正确的是( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
答案:D
解析:A项中CsCl晶体中每个离子都吸引8个带相反电荷的离子;B项中金属晶体内部本身就存在自由电子,外加电场仅能导致其产生定向移动;C项中如P?S等分子晶体常温下呈固态?
8.氮是地球上极其丰富的元素?
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为____________________________________?
(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的________键比________键稳定(填“σ”或“π”)?
1s22s22p6πσ(3)(CH3)3NH+和 可形成离子液体?离子液体由阴阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作________(填代号)?
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
小b(4)X+中所有电子正好充满K?L?M三个电子层,它与N3-形成的晶体如图所示?X的元素符号是__________,与同一个N3-相连的X+有______个?
Cu6解析:(2)在N≡N中有一个σ键,2个π键? =347.5 kJ·mol-1
所以在N≡N中,π键比σ键稳定?
(3)离子液体中的作用力是离子键,尽管微弱但强于氢键和分子间作用力,所以其挥发性就小,不会污染环境,是“绿色”溶剂?
(4)X+所含质子=2+8+18+1=29,所以X为29号Cu元素?
从图上看○少●多,结合X3N知,○为N3-,以顶点上的○为中心,距离最近的X+有6个?构成一个完整的三维空间需8个这样的单元?
9.氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应?请回答下列问题:
(1)写出铬原子的基态电子排布式:______________,
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为__________?
1s22s22p63s23p63d54s1 K?Cu4(2)CrO2Cl2常温下为深红色液体,能与CCl4?CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子?
(3)在①苯?②CH3OH?③HCHO?④CS2?⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有__________(填序号),CS2分子的空间构型是________?非极性①③直线形10.四种元素X?Y?Z?W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1?
(1)Y?Z可分别与X形成只含一个中心原子的共价化合物a?b,它们的分子式分别是________?_________; 杂化轨道分别是_________?_________;a分子的立体结构是_______?
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是___________晶体?___________晶体?
CH4SiH4sp3sp3正四面体分子原子(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)______________?
(4)Y与Z比较,电负性较大的是___________(填元素符号)?
(5)W的元素符号是___________,其+2价离子的核外电子排布式是____________?CO2CZn 1s22s22p63s23p63d10解析:由“Y原子的L层p轨道中有2个电子”知Y为碳,再根据“Y?Z可分别与X形成只含一个中心原子的共价化合物”知Z应该为硅;由“W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1”知W为30号元素,即为锌;由核电荷数之和为51知X为氢,这样所有问题都可以得到解答?
11.有A?B?C?D?E?F六种元素,除E为第4周期元素外其余均为短周期元素,且A?B?C?F?D?E原子序数依次增大?A?E位于元素周期表的s区,其余元素位于p区,A?E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的一种单质易自燃;F的基态原子核外成对电子数是成单电子数的3倍?回答下列问题:
(1)写出下列元素的符号:D________,F__________?
(2)由A?B?C形成的ABC分子中,含有______个σ键,______个π键,分子的空间构型为_________?
PO22直线形(3)B?C两种元素分别与A元素形成的化合物中,易溶于水的物质是________(写化学式),
原因是______________? (4)B元素的单质与E元素的单质可形成一种青铜色的化合物,其化学式可写作BxE,这种化合物的平面图形如图所示,则x值为___________?
NH3氨气是一种极性分子,
且易与水分子形成氢键812.(1)原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响?试回答: ①BF3分子的立体结构为__________形,NF3分子的立体结构为__________形? ②碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同?在乙烷?乙烯?乙炔分子中,碳原子进行sp3杂化的是(写结构简式)___________,存在一个π键的是(写名称)___________? 平面三角三角锥CH3CH3乙烯③H2O?NH3?CH4分子中键角由大到小的顺序为______________,原因是______________? NH3分子中有1对孤对电子,H2O分子有2对孤对电子,对成键电子对的排斥作用增大,故键角逐渐减小 CH4>NH3>H2O(2)下图为CaF2?H3BO3(层状结构,层内的H3BO3分子通过氢键结合)?金属铜三种晶体的结构示意图,请回答下列问题: ①图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为______________,图Ⅲ中未标号的铜原子形成晶体后最紧邻的铜原子数为____________? ②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是_____________,H3BO3晶体中B原子个数与极性键个数比为______________?812O1∶613.A?B?C?D四种元素的原子序数均小于18,其最高正价依次为1,4,5,7,已知B原子的次外层电子数为2,A?C原子的次外层电子数为8?D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的?则: (1)写出C元素原子的价电子轨道表达式: ___________, 写出D元素原子的电子排布式:_________________? (2)已知B元素与氢元素形成的化合物在标准状况下的密度为1.161 g·L-1,则在该化合物分子中B原子的杂化方式为______________,在该化合物分子中含有___________个π键,______________个σ键? 1s22s22p63s23p5sp123(3)已知C?D两元素形成的化合物通常有CD3?CD5两种?这两种化合物一种为非极性分子,另一种为极性分子,则属于极性分子的化学式为_________________,该分子的空间构型为____________________? PCl3三角锥形(4)在A?D两元素形成的化合物组成的晶体中,阴?阳离子具有或近似具有球形对称结构,它们可以被看作刚性圆球,并彼此“相切”?下图所示为A和D形成的化合物的晶胞结构图及晶胞的剖面图: 若a=5.6×10-8cm,则该晶体的密度为____________g·cm-3(精确到小数点后1位)? 2.214.根据下面三个表格所给相关信息,回答问题: 表一:价电子对数和分子空间构型的关系:表二:部分物质的熔点: 表三:部分化学键和键能的关系: (1)指出下列物质分子或离子的空间构型: ______________,CS2______________;SO3______________? 正四面体形直线形平面正三角形(2)氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为______________? A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 D.氨气分子是极性分子,而甲烷是非极性分子 C(3)下列说法正确的是____________? A.原子晶体的熔点一定比离子晶体高 B.BCl3为分子晶体,其空间构型为平面正三角形 C.AlCl3的熔点比Al2O3低,工业上应该用电解AlCl3的方法来制备铝 D.同主族元素的氧化物可以形成不同类型的晶体,不同主族元素的氧化物可以形成相同类型的晶体 BD(4)SiO2晶体结构如图所示,则SiO2晶体中Si和Si—O键个数的比例为____________,Si(s)+O2(g)高温 SiO2(s),其反应热ΔH=________? 1∶4-990 kJ·mol-115.新华网北京2007年3月21日电,全国科学技术名词审定委员会公布:111号元素的中文名称为钅仑(读音同“伦”)?目前,这一命名已经得到国家语言文字工作委员会的同意?另据全国科学技术名词审定委员会有关负责人介绍,海峡两岸已在111号元素的中文名称上取得一致意见? 阅读上述新闻信息,解答下列问题: (1)2004年国际化学联合会将111号元素命名为Rg(英文名称为roentgenium,符号为Rg),用该名字命名的目的是纪念_____________(填代表科学家人名或地名的字母代号)? A.德国科学家威廉·伦琴 B.英国科学家卢瑟福 C.德国首都柏林 D.英国首都伦敦 A(2)从公布的111号元素的中文名称可以推断,该元素属于_____________元素(填“金属”或“非金属”)? (3)元素周期表中,111号元素与Cu在同一个纵行,根据基态原子的核外电子在原子轨道上的排列顺序,写出铜元素的基态原子的电子排布式:__________? 1s22s22p63s23p63d104s1金属(4)银元素和111号元素在同一个纵行中,银离子可以与氨分子形成化学式为 的离子,该离子中含有的化学键有____________?银的化合物有广泛的用途,如AgI可以用作催化剂,在人工降雨中,用作冰核形成剂;还用于医药工业?科学分析?电池业等?AgI的熔沸点较高,熔点558 ℃,沸点1 506 ℃,易溶于碘化钾?氰化钾等极性溶剂中,由此可判断AgI的晶体类型是____________-? 离子晶体共价键?配位键解析:(1)111号元素是德国重离子研究中心发现的,为了纪念发现伦琴射线的第一位诺贝尔物理学奖获得者威廉·伦琴,该中心将其命名为Rg(英文名称为roentgenium,符号为Rg)? (2)从该元素的中文名称的构字方式可以直接得知该元素的类别,带“金”字旁的为金属元素? (3)根据基态原子的核外电子在原子轨道上的排列顺序,可以写出铜元素(29号)的基态原子的电子排布式? (4)其中氨气分子内含有N—H共价键,而氨气与Ag+之间则是配位键;AgI的熔?沸点较高,且溶于极性溶剂,所以既不是分子晶体也不是原子晶体,而是离子晶体?
轻松学教材 一?晶体的常识 1.晶体与非晶体 (1)晶体 结构特征:原子在三维空间里呈周期性有序排列? 性质特征:有自范性?固定熔点?对称性?各向异性? (2)非晶体 结构特征:原子无序排列? 性质特征:没有自范性?固定熔点?对称性?各向异性? 2.晶胞 晶胞是描述晶体结构的基本单元?晶胞在晶体中的排列呈“无隙并置”? 二?几种典型的晶体模型 1.原子晶体(金刚石和二氧化硅) 金刚石键角为109°28′,每个最小的环上有6个碳原子?SiO2(正四面体,O—Si键角)为109°28′,每个最小的环上有12个原子,其中有6个Si和6个O? 2.分子晶体(干冰) 每个CO2分子周围等距紧邻的CO2分子有12个? 3.离子晶体 (1)NaCl型 在晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,配位数为6?每个晶胞含4个Na+和4个Cl-? (2)CsCl型 在晶体中,每个Cl-吸引8个Cs+,每个Cs+吸引8个Cl-,配位数为8? (3)晶格能 ①定义:气态离子形成1 mol离子晶体释放的能量,单位kJ·mol-1,通常取正值? ②影响因素 a.离子所带电荷:离子所带电荷越多,晶格能越大? b.离子的半径:离子的半径越小,晶格能越大? ③与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大? 4.金属晶体 (1)金属键——电子气理论 金属阳离子与自由电子间的相互作用? (2)金属晶体的几种典型堆积模型三?晶体的基本类型和性质比较 体验热身 1.下列有关晶体的叙述,错误的是( ) A.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 B.白磷晶体中,结构微粒之间通过共价键结合 C.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 D.分子晶体的熔点最低 答案:BD 解析:离子晶体是通过离子键将阴?阳离子结合在一起的,所以熔化时,离子键被破坏;而分子晶体是通过范德华力将分子结合在一起的,所以熔化时,分子内部的化学键未发生变化,破坏的只是范德华力,则A正确?白磷晶体属于分子晶体,在P4内部存在共价键,而结构微粒(P4)之间是通过范德华力结合的,则B错误?石英晶体(SiO2)是原子晶体,则C正确?分子晶体S?P等的熔点高于金属汞的熔点,所以D错? 2.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( ) A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体 C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中 答案:A 解析:晶体类型相同,克服粒子间作用力相同?3.用烧热的钢针去接触涂有薄薄一层石蜡的云母片的反面,熔化了的石蜡呈椭圆形,这是因为( ) A.云母是热的不良导体,传热不均匀 B.石蜡是热的不良导体,传热不均匀 C.石蜡具有各向异性,不同方向导热性能不同 D.云母具有各向异性,不同方向导热性能不同 答案:D 解析:据题目叙述,可知云母具有各向异性,不同方向导热性不同,使石蜡熔化成椭圆形? 4.如图所示是某原子晶体A空间结构中的一个单元,A与某物质B反应生成C,其实质是每个A—A键中插入一个B原子,则C物质的化学式为( ) A.AB B.A5B4 C.AB2 D.A2B5 答案:C 解析:据题意可知一个A原子结合4个B原子,而一个B原子结合2个A原子,则A?B原子个数比为1∶2,C的化学式为AB2(本题亦可从SiO2的形成思考:图中A为Si原子,插入的B原子为氧,可得SiO2晶体,则C的化学式为AB2)?需注意:此图是某原子晶体空间结构中的一个单元? 5.下列组合中,晶胞的排列一致的是( ) A.ZnS?NaCl B.Cu?Mg C.NaCl?KCl D.CsCl?MgO 答案:C解析:A中ZnS与NaCl显然不一致;B中Cu属A1型,Mg属A3型;D中MgO属NaCl型;只有C中两物质一致? 6.有下列八种晶体: A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石 用序号回答下列问题: (1)属于原子晶体的化合物是__________?直接由原子构成的晶体是_____,直接由原子构成的分子晶体是______? (2)由极性分子构成的晶体是__________,含有共价键的离子晶体是________,属于分子晶体的单质是__________? (3)在一定条件下能导电而不发生化学变化的是__________,受热熔化后化学键不发生变化的是___________,需克服共价键的是____________? AAEHBFDEGBDEAH解析:首先正确地判断晶体类型,其次注意题目的附加要求,如属于原子晶体的化合物,另外稀有气体为单原子分子,金属晶体导电时仅是自由电子在外加电场作用下发生定向移动,属物理变化? 重点探究 晶胞中微粒数目的计算 计算晶胞中微粒数目的常用方法是均摊法?均摊法是指每个晶胞平均拥有的粒子数目?如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞?(1)长方体(或正方体)晶胞中不同位置的粒子的计算 ①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有 属于该晶胞; ②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有 属于该晶胞; ③处于面上的粒子,同时为2个晶胞所共有,每个粒子有 属于该晶胞; ④处于晶胞内部的粒子,则完全属于该晶胞? (2)非长方体(或正方体)晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占1/3? 特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定势,任何形状的晶胞均使用上述计算方法?不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点?侧棱?底面上的棱?面心上的粒子依次被6?3?4?2个晶胞共用. 晶体熔?沸点高低的比较 1.不同类型晶体的熔?沸点高低的一般规律 原子晶体>离子晶体>分子晶体? 金属晶体的熔?沸点差别很大,如钨?铂等沸点很高,如汞?镓?铯等沸点很低? 2.原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔?沸点高?如熔点:金刚石>石英>碳化硅>硅? 3.离子晶体 一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔?沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl? 4.分子晶体 (1)分子间作用力越大,物质的熔?沸点越高;具有分子间氢键的分子晶体,熔?沸点反常地高?如H2O>H2Te>H2Se>H2S? (2)组成和结构相似的分子晶体,相对分子质量越大,熔?沸点越高,如SnH4>GeH4>SiH4>CH4? (3)组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔?沸点越高,如CO>N2,CH3OH>CH3CH3? (4)同分异构体,支链越多,熔?沸点越低? 5.金属晶体 金属离子半径越小,离子的电荷数越多,其金属键越强,金属熔?沸点就越高,如熔?沸点:Na
且易与水分子形成氢键812.(1)原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响?试回答: ①BF3分子的立体结构为__________形,NF3分子的立体结构为__________形? ②碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同?在乙烷?乙烯?乙炔分子中,碳原子进行sp3杂化的是(写结构简式)___________,存在一个π键的是(写名称)___________? 平面三角三角锥CH3CH3乙烯③H2O?NH3?CH4分子中键角由大到小的顺序为______________,原因是______________? NH3分子中有1对孤对电子,H2O分子有2对孤对电子,对成键电子对的排斥作用增大,故键角逐渐减小 CH4>NH3>H2O(2)下图为CaF2?H3BO3(层状结构,层内的H3BO3分子通过氢键结合)?金属铜三种晶体的结构示意图,请回答下列问题: ①图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为______________,图Ⅲ中未标号的铜原子形成晶体后最紧邻的铜原子数为____________? ②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是_____________,H3BO3晶体中B原子个数与极性键个数比为______________?812O1∶613.A?B?C?D四种元素的原子序数均小于18,其最高正价依次为1,4,5,7,已知B原子的次外层电子数为2,A?C原子的次外层电子数为8?D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的?则: (1)写出C元素原子的价电子轨道表达式: ___________, 写出D元素原子的电子排布式:_________________? (2)已知B元素与氢元素形成的化合物在标准状况下的密度为1.161 g·L-1,则在该化合物分子中B原子的杂化方式为______________,在该化合物分子中含有___________个π键,______________个σ键? 1s22s22p63s23p5sp123(3)已知C?D两元素形成的化合物通常有CD3?CD5两种?这两种化合物一种为非极性分子,另一种为极性分子,则属于极性分子的化学式为_________________,该分子的空间构型为____________________? PCl3三角锥形(4)在A?D两元素形成的化合物组成的晶体中,阴?阳离子具有或近似具有球形对称结构,它们可以被看作刚性圆球,并彼此“相切”?下图所示为A和D形成的化合物的晶胞结构图及晶胞的剖面图: 若a=5.6×10-8cm,则该晶体的密度为____________g·cm-3(精确到小数点后1位)? 2.214.根据下面三个表格所给相关信息,回答问题: 表一:价电子对数和分子空间构型的关系:表二:部分物质的熔点: 表三:部分化学键和键能的关系: (1)指出下列物质分子或离子的空间构型: ______________,CS2______________;SO3______________? 正四面体形直线形平面正三角形(2)氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为______________? A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 D.氨气分子是极性分子,而甲烷是非极性分子 C(3)下列说法正确的是____________? A.原子晶体的熔点一定比离子晶体高 B.BCl3为分子晶体,其空间构型为平面正三角形 C.AlCl3的熔点比Al2O3低,工业上应该用电解AlCl3的方法来制备铝 D.同主族元素的氧化物可以形成不同类型的晶体,不同主族元素的氧化物可以形成相同类型的晶体 BD(4)SiO2晶体结构如图所示,则SiO2晶体中Si和Si—O键个数的比例为____________,Si(s)+O2(g)高温 SiO2(s),其反应热ΔH=________? 1∶4-990 kJ·mol-115.新华网北京2007年3月21日电,全国科学技术名词审定委员会公布:111号元素的中文名称为钅仑(读音同“伦”)?目前,这一命名已经得到国家语言文字工作委员会的同意?另据全国科学技术名词审定委员会有关负责人介绍,海峡两岸已在111号元素的中文名称上取得一致意见? 阅读上述新闻信息,解答下列问题: (1)2004年国际化学联合会将111号元素命名为Rg(英文名称为roentgenium,符号为Rg),用该名字命名的目的是纪念_____________(填代表科学家人名或地名的字母代号)? A.德国科学家威廉·伦琴 B.英国科学家卢瑟福 C.德国首都柏林 D.英国首都伦敦 A(2)从公布的111号元素的中文名称可以推断,该元素属于_____________元素(填“金属”或“非金属”)? (3)元素周期表中,111号元素与Cu在同一个纵行,根据基态原子的核外电子在原子轨道上的排列顺序,写出铜元素的基态原子的电子排布式:__________? 1s22s22p63s23p63d104s1金属(4)银元素和111号元素在同一个纵行中,银离子可以与氨分子形成化学式为 的离子,该离子中含有的化学键有____________?银的化合物有广泛的用途,如AgI可以用作催化剂,在人工降雨中,用作冰核形成剂;还用于医药工业?科学分析?电池业等?AgI的熔沸点较高,熔点558 ℃,沸点1 506 ℃,易溶于碘化钾?氰化钾等极性溶剂中,由此可判断AgI的晶体类型是____________-? 离子晶体共价键?配位键解析:(1)111号元素是德国重离子研究中心发现的,为了纪念发现伦琴射线的第一位诺贝尔物理学奖获得者威廉·伦琴,该中心将其命名为Rg(英文名称为roentgenium,符号为Rg)? (2)从该元素的中文名称的构字方式可以直接得知该元素的类别,带“金”字旁的为金属元素? (3)根据基态原子的核外电子在原子轨道上的排列顺序,可以写出铜元素(29号)的基态原子的电子排布式? (4)其中氨气分子内含有N—H共价键,而氨气与Ag+之间则是配位键;AgI的熔?沸点较高,且溶于极性溶剂,所以既不是分子晶体也不是原子晶体,而是离子晶体?
同课章节目录
