2011届高考化学总复习课件系列 学案46 化学与资源开发利用
文档属性
| 名称 | 2011届高考化学总复习课件系列 学案46 化学与资源开发利用 |  | |
| 格式 | rar | ||
| 文件大小 | 573.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-09 13:16:00 | ||
图片预览











文档简介
课件101张PPT。第二十一章 化学与资源开发利用 学案46 化学与资源开发利用轻松学教材一?从水资源中获取洁净水的主要方法和原理
1.天然水净化
(1)混凝法
①一般过程:混凝沉淀?过滤?杀菌?
②常用的混凝剂:明矾?绿矾?聚合铝?硫酸铁等?
③明矾净水反应原理:离子方程式为
(2)化学软化法
①具有暂时硬度的水:水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的?常用软化方法为加热法,反应原理为②具有永久硬度的水:水的硬度是由钙?镁的硫酸盐或氯化物所引起的,常用软化方法为药剂法和离子交换法?
a.药剂法:把纯碱?生石灰等试剂加入到硬水中,与Ca2+?Mg2+反应形成沉淀,分离?
b.离子交换法:用离子交换剂除去硬水中的Ca2+?Mg2+?如用离子交换树脂软化水的过程为
2NaR+Ca2+===CaR2+2Na+,
2NaR+Mg2+====MgR2+2Na+?
而离子交换树脂的再生(用离子方程式表示)为
CaR2+2Na+===2NaR+Ca2+?2.污水处理
(1)酸碱中和法
酸性废水常用熟石灰中和,碱性废水常用H2SO4或CO2中和?
(2)沉淀法
Hg2+?Pb2+?Cu2+等重金属离子可用Na2S除去,反应的离子方程式为Hg2++S2-===HgS↓,
Pb2++S2-===PbS↓,Cu2++S2-===CuS↓?
3.海水淡化
常用方法为蒸馏法?电渗析法等?二?海水中盐的开发和利用
1.海水制盐
(1)利用蒸发法,从海水中主要获得氯化钠及氯化镁?氯化钾等副产品?
(2)电渗析法?冷冻法不仅能制得盐,同时还可得到淡水?
2.氯碱工业——食盐资源的利用
离子交换膜法电解食盐水:
(1)设备:离子交换膜电解槽?离子交换膜只允许Na+通过?
(2)原理:化学方程式为
?(3)工艺流程
在进入电解槽前需通过离子交换树脂进一步除去Ca2+?Mg2+等离子,以防破坏离子交换膜?
(4)产品
阳极室产品:氯气,补充饱和食盐水流出淡盐水?
阴极室产品:氢气和NaOH,补充纯水(加入一定NaOH溶液)流出NaOH溶液? 3.粗盐的精制
(1)目的:除去泥沙,使Ca2+?Mg2+?Fe3+? 等离子的含量达到要求?
(2)原因:Ca2+?Mg2+等会在碱溶液中形成沉淀,破坏离子交换膜,泥沙及 会引起杂质?
(3)试剂:BaCl2?Ca(OH)2?Na2CO3?稀盐酸?
用BaCl2除去 ,用Ca(OH)2除去Mg2+?Fe3+,用Na2CO3除去Ba2+及Ca2+,所加沉淀剂需过量?
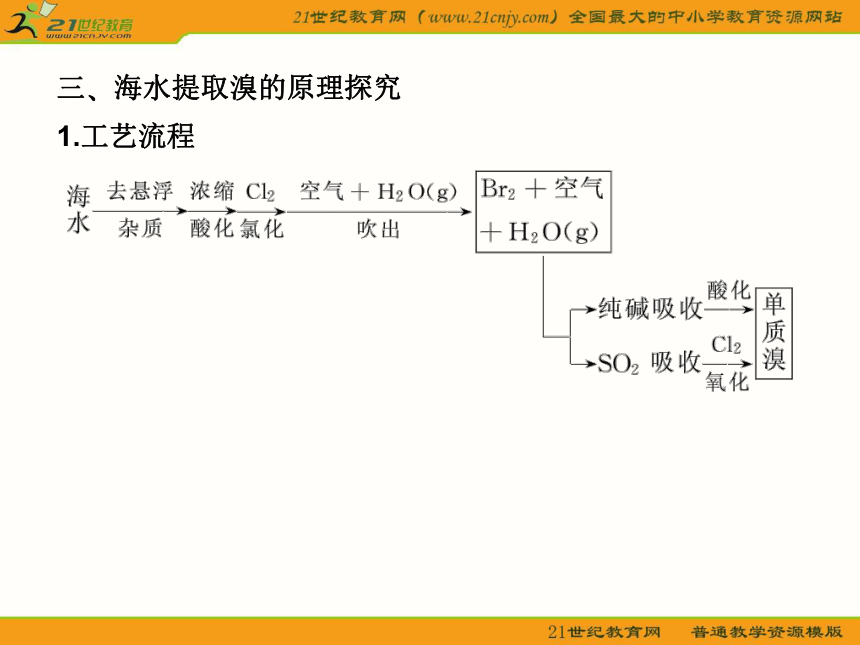
试剂的加入顺序:纯碱须加在钡试剂后,稀盐酸加在过滤后? (4)有关反应方程式:三?海水提取溴的原理探究
1.工艺流程2.主要反应原理:Cl2+2Br-===Br2+2Cl-
3.溴的吸收富集
(1)纯碱吸收法:海水中的溴离子被氧化为溴单质后,用热空气或水蒸气吹出,通过Na2CO3溶液使溴富集后,再将得到的溶液用稀硫酸酸化,用有机溶剂萃取溴单质?发生的反应:
3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑
5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O(2)SO2吸收法:用空气吹出的溴和大量的空气混合在一起,不易分离,用还原剂SO2吸收后,再用氯气氧化HBr即得到溴单质?特别提醒:①通氯气前要将海水酸化,pH为3.5时,氯气的氧化效果最好?
②用空气或H2O(g)将溴吹出,而不用CCl4萃取,因后者工艺复杂,设备投资大,经济效益低且对环境污染严重?四?海水提取镁工艺流程和化学平衡原理的应用
1.生产步骤
(1)加熟石灰;(2)过滤;(3)加盐酸;(4)浓缩结晶脱水干燥;(5)熔融电解?
2.工艺流程3.主要化学反应
(1)制备石灰乳4.工业生产中平衡原理的应用
(1)沉淀溶解平衡原理的应用
①向海水中加入沉淀剂Ca(OH)2,由于c(OH-)增大,Mg(OH)2的溶解度小于Ca(OH)2,可最大程度地将Mg2+转化为Mg(OH)2沉淀?
②向Mg(OH)2沉淀中加入盐酸,使沉淀溶解平衡右移? (2)水解平衡原理的应用
在MgCl2·6H2O脱水变为MgCl2时,由于MgCl2+2H2O
Mg(OH)2+2HCl水解平衡的存在,在HCl气体环境中,增大c(OH-),抑制了MgCl2的水解,避免了Mg(OH)2的生成?特别提醒:①为提高反应中Mg2+的浓度,将海水浓缩或用提取食盐后的盐卤?
②电解熔融MgCl2生成的Cl2可用于制盐酸,循环使用,节省成本?
③所得Mg(OH)2沉淀中含有的CaSO4杂质在加盐酸前应除去,以保证MgCl2的纯度?五?石油?煤?天然气的综合利用
1.石油和天然气
(1)石油的综合利用
①石油的分馏,分为常压分馏和减压分馏?
②石油的催化裂化:如十六烷裂化?
③石油的裂解:如己烷裂解? (2)天然气的综合利用
除了直接用作燃料外,还可以制造合成氨原料气(H2),合成甲醇及其他化工原料?例如:天然气重整的方程式
?2.裂化?裂解的对比3.煤的综合利用
(1)煤的干馏:将煤隔绝空气加强热,使之分解的过程,得到的固体物质焦炭?液态物质煤焦油?粗氨水,气态物质焦炉气,成分为H2?CH4?CO?CO2?N2等?
(2)煤的气化:是把煤中的有机物转化为可燃性气体的过程? (3)煤的液化
①直接液化:煤与氢气作用生成液体燃料?
②间接液化:先把煤转化成CO和H2,再催化合成烃类燃料?醇燃料及化学品等?体验热身1.下列叙述正确的是( )
①海水中含有大量的Br-,所以从海水中提取溴一般要经历浓缩和提取两个步骤
②铝是一种比较活泼的金属,所以铝合金制品易被腐蚀
③在煤中加入适量的生石灰,可以减少煤燃烧时二氧化硫的排放
④制造玻璃的主要原料是纯碱?石灰石和石英
A.②③ B.②④
C.①③D.③④答案:D
解析:海水中提取Br2要经历富集?氧化?萃取等,①错;铝在常温下易形成一层致密的氧化膜,不易被腐蚀,②错;根据钙基固硫,加入适量CaO可吸收SO2,减少污染,故选③④,D项正确?2.某工厂排放的酸性废水中含有较多的Cu 2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( )
A.食盐?硫酸B.胆矾?石灰水
C.铁粉?生石灰D.苏打?盐酸答案:C解析:铁粉能除去Cu2+,生石灰能中和H+且能沉淀Fe3+?A项中增加废水的酸性,且不能除去Cu2+,B项中增加废水中的Cu2+,D项中增加废水的酸性?3.我国实施的“南水北调”工程是为了解决北方地区长期缺水的状况,在这项工程完成之前北方的许多地区使用的是地下水,而地下水中含有较大量的Ca 2+?Mg2+等?科学上把含有较多Ca2+?Mg2+的水称为硬水?(1)将硬水中所含Ca2+?Mg2+? 等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分为__________和__________(填化学式)?
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3胶体沉淀?凝聚剂除去悬浮固体颗粒起到净水作用的过程中__________(填编号)?
①发生水解 ②发生氧化还原反应 ③发生胶体的聚沉 Mg(OH)2 CaCO3 ①②③ (3)净化后的水要进一步消毒,常用的消毒剂是Cl2?Cl2消毒的实质是Cl2和水反应生成了__________(填化学式),Cl2与水反应的离子方程式为__________?
(4)由于Cl2与水中的有机物作用会产生对人体不利的物质,所以世界卫生组织要求停止用Cl2对自来水进行消毒,而用其他的代用品,我国已经开始使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率之比为__________?
(5)从氧化还原反应角度看,下列物质中__________(填编号)可以作为Cl2的代用品?
①Ca(ClO)2 ②NH2Cl(氯氨) ③K2FeO4 ④SO2 ⑤Al2(SO4)3HClO Cl2+H2O====H++HClO+Cl- 2.63∶1 ①②③ 解析:水是重要的资源,所以有关水的题目也很多?
(1)从溶解度角度可以得出沉淀是Mg(OH)2?CaCO3;
(2)FeSO4·7H2O是常用的凝聚剂,其净水的过程发生了水解?氧化还原反应?胶体的聚沉等;(3)消毒剂Cl2的消毒作用主要是因为Cl2与水反应的产物中有HClO,Cl2+H2O===HCl+HClO;(4)使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率之比为
;(5)一般具有强氧化性?与水反应的产物对人体等没有影响的试剂都可以作水的消毒剂,如选项中的①②③?4.气化和液化是使煤变成清洁能源的有效途径?煤的气化的重要反应是: 和H2的混合气体是合成多种有机物的原料气?下图是合成某些物质的路线:其中,D易溶于水,且与CH3COOH互为同分异构体,F分子中的碳原子数是D中的3倍,H经催化氧化可得到G?请回答下列问题:
(1)写出下列物质的结构简式:
A____________________,H______________;指出A和H的关系:____________________?CH3OH CH3CH2CH2CH2OH 同系物 (2)利用合成气(H2+CO)生产汽油?甲醇和氨等已经实现了工业化,合成气也可合成醛?酸?酯等多种产物,下列表述正确的是__________?
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可得到不同的产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
④从合成气出发生成气态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有烯烃或水
A.①②④ B.②③④ C.②④⑤ D.③④⑤B (3)写出下列反应的化学方程式:
:___________________
____________________________________________;
②D与新制氢氧化铜加热:_____________
_____________________________________________?解析:本题以能源为载体考查烃的衍生物的性质,命题着眼点在于煤的气化和液化,同时它又结合有机化学反应类型,要求整合新信息得出结论?
(1)由题图知,A经两次催化氧化得到C,则A为CH3OH;B为HCHO,C为HCOOH,且H应为CH3CH2CH2CH2OH,G为CH3CH2CH2CHO,D的分子式为C2H4O2,易溶于水,说明不是酯,则D为HOCH2CHO,E为HOCH2—CH2OH,F为CH3COOCH2—CH2OOCCH3?
(2)依题意,CO和H2可合成汽油,汽油是烃类,所以必然生成水,不是化合反应,①和⑤都不正确?重点探究平衡移动原理在工业生产中的应用
1.沉淀溶解平衡原理
(1)沉淀的转化
①加热法转化暂时硬水时所得产物为CaCO3和Mg(OH)2,而不是CaCO3和MgCO3
反应: ,
但因为Mg(OH)2的溶解度远小于MgCO3,因此加热条件下又发生反应 .
②向海水中加入沉淀剂石灰乳,因为Mg(OH)2溶解度小于Ca(OH)2,所以Ca(OH)2会转化为Mg(OH)2? (2)沉淀的溶解
向Mg(OH)2中加入盐酸,使Mg(OH)2的溶解平衡向溶解的方向移动?
2.水解平衡原理
因MgCl2溶液浓缩结晶产物为MgCl2·6H2O,若直接加热,则因为促进MgCl2水解,MgCl2+2H2O Mg(OH)2+2HCl,水解平衡右移,使MgCl2不纯净,因此,在HCl气氛中,增大了c(HCl),抑制了MgCl2的水解?命题聚焦 聚焦1 氯碱工业粗盐的精制【例1】 氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下: 依据上图完成下列填空:
(1)与电源正极相连的电极上所发生的反应的化学方程式为______________________,与电源负极相连的电极附近,溶液的pH__________(填“不变”“升高”或“降低”)?2Cl--2e-===Cl2↑ 升高 (2)工业食盐中含Ca2+?Mg2+? 等杂质,为有效除去它们,加入试剂的合理顺序为__________?
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3bc (3)如果粗盐中 含量较高,必须添加钡试剂除去 ,
该钡试剂是否添加过量的判断方法是____________________________________?
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发?冷却?__________(填写操作名称)除去NaCl?
(5)由图示可知用离子交换膜法电解制碱工艺中,__________产品可循环使用?
(6)已知NaCl在60 ℃时的溶解度为37.1 g,现电解60 ℃时的粗制饱和食盐水1 371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为__________mol·L-1? 静置后取上层清液(或直接向上层清液)继续加入钡试剂,若
溶液变浑浊则证明钡试剂不足,若溶液无明显变化则证明钡试剂已经过量过滤 NaCl(或淡盐水) 7.14 解析:在电解饱和NaCl溶液时,电解池阴极附近溶液的pH会升高的原因是:电解时,Na+?H+在阴极放电:2H++2e-===H2↑,而H+在阴极不断放电打破了水的电离平衡,使阴极附近溶液中c(OH-)增大,故电解一段时间后阴极生成NaOH?离子交换膜法电解制碱技术同以前无隔膜法相比,避免了因Cl2进入阴极区与NaOH溶液接触发生如下发应:Cl2+2NaOH===NaCl+NaClO+H2O,影响产品的质量?方法归纳:氯碱工业是传统化工的重要内容,其主要产品有氯气?氢气?盐酸和烧碱,如今科学的发展赋予氯碱工业新的内容?化工生产相关问题的考查点主要还是基本原理,复习过程中要注意从工艺流程中提取出相关物质的物理?化学性质,尤其是与该生产工艺相关的性质,如制备?分离提纯?尾气处理等所用到的性质?要注重理解生产工艺中一些流程?操作的原理?聚焦2 海水提取镁工艺流程的化学平衡原理【例2】 海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl?Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为__________?
a.蒸馏 b.灼烧 c.过滤 d.蒸发 e.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是________________________?ec 在HCl气流中加热脱水 (3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是________?
a.精制饱和食盐水进入阳极室
b.纯水(加一定量NaOH)进入阴极室
c.阴极产物为氢氧化钠和氢气
d.阳极的电极反应为:Cl2+2e-===2Cl-d (4)母液中常含有MgCl2?NaCl?MgSO4?KCl等(其溶解度与温度的关系如图所示),可进一步加工制得一些重要的产品?若将母液加热升温到60 ℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是________;过滤上述晶体后,将滤液降温到30 ℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体?MgSO4?NaCl KCl 解析:(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,考虑MgCl2水解的因素,可以采取降温结晶方法?(2)为防止MgCl2水解,必须在HCl气流中加热脱水?(3)离子交换膜电解槽的阳极为金属钛网制成的?(4)由溶解度曲线可知,MgCl2?KCl随温度升高溶解度增大较多,而MgSO4随温度升高溶解度减小,NaCl随温度升高溶解度变化不大?因此在60 ℃以上析出的晶体主要是MgSO4?NaCl,30 ℃以下析出的晶体主要是MgCl2和KCl,用冷水洗涤该晶体,由于MgCl2的溶解度较大,最后可得到比较纯净的KCl晶体?方法归纳:通过图像考查考生的实验分析能力是高考的要求,本题一方面考查对氯碱工业相关实验的熟悉程度,另一方面还注重考查学生对图像的分析能力,符合现代高考对考生能力的要求?聚焦3 化石燃料的开发?利用
【例3】 (2008年潍坊)从原料和环境方面的要求看,绿色化学对生产中的化学反应提出了一个高原子利用率的要求,即尽可能不采用那些对产品的化学组成来说没有必要的原料?现有下列3种合成苯酚的反应路线:其中符合原子节约要求的生产过程是( )
A.只有①
B.只有②
C.只有③
D.①②③
解析:只有③直接氧化,一步反应,产率高,且得到苯酚和另一种重要的有机化工原料丙酮?
答案:C方法归纳:绿色化学是一种始端处理技术?简单说就是绿色原料?绿色工艺?绿色产物,总之我们尽可能选择无污染或少污染的原料?溶剂?催化剂及无污染工艺,从源头防止或减少环境污染?高效作业1.目前下列工艺过程没有直接使用离子交换技术的是( )
A.硬水的软化
B.电解饱和食盐水制造NaOH
C.电渗析淡化海水
D.海水中提取金属Mg
答案:D解析:硬水的软化?电解饱和食盐水制NaOH?电渗析淡化海水均使用离子交换技术;海水提取镁,使其发生反应Ca(OH)2+MgCl2[FY=]Mg(OH)2↓+CaCl2,再过滤得Mg(OH)2,最终制得Mg,没有使用离子交换技术?2.下列各工业生产中,石灰石?生石灰?熟石灰都不能作为原料的是( )
①炼铁 ②用生铁炼钢 ③从海水中提取镁 ④铝的冶炼 ⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧制硫酸
A.④⑧
B.⑤⑥
C.①②③
D.⑤⑥⑦答案:A
解析:①炼铁中加石灰石造渣,②炼钢中加生石灰除硅?锰,③提取镁用熟石灰沉淀Mg2+,⑤制水泥的主要原料是石灰石和黏土,⑥制玻璃的主要原料是碳酸钠?石灰石和二氧化硅,⑦制漂白粉用熟石灰和Cl2反应?故选A?3.工业上获得苯主要通过( )
A.煤的干馏
B.石油常压分馏
C.石油减压分馏
D.石油催化裂化
答案:A
解析:煤通过干馏得到煤焦油,在煤焦油中含有多种芳香族化合物,从中可以得到苯?石油分馏得到含碳原子数不一的烷烃混合物,得不到苯?石油催化裂化主要得到含不饱和烃的汽油?故选A?4.下列说法中,不正确的是( )
A.煮沸暂时硬水时,水的硬度一定降低
B.硬水中加入适量石灰水后,由于生成Mg(OH)2?CaCO3沉淀,水就软化了
C.永久硬水主要是由含有Ca2+?Mg2+的硫酸盐和氯化物形成的,加热煮沸是不能软化的
D.如果用HR型离子交换树脂软化硬水,则发生的交换反应可以表示为Ca2++2HR===CaR2+2H+答案:B解析:水的硬度是由Ca(HCO3)2或Mg(HCO3)2引起的,称为暂时硬水,可通过加热煮沸方法进行软化?水的硬度是由Ca2+?Mg2+的硫酸盐或氯化物引起的,称为永久硬水,加热煮沸不能软化,可通过药剂法[加入Na2CO3?Ca(OH)2]及离子交换法(如Ca2++2HR===CaR2+2H+)进行软化,B项中加入Ca(OH)2,只能除去Mg2+,再加入Na2CO3才能除去Ca2+,故B项错?5.用高铁酸钠(Na2FeO4)对来自河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒和净化处理的优点分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解生成Fe(OH)2,可使水中悬浮物凝聚沉降
D.Na2FeO4中的Fe元素为+6价,具有强氧化性,能消毒杀菌答案:BD解析:Na2FeO4中Fe元素显+6价,处于最高价具有强氧化性,所以能杀菌,且还原产物为Fe3+,由于Fe3++3H2O
Fe(OH)2(胶体)+3H+,Fe(OH)3胶体具有净水作用?6.如何从石油获取更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油?
资料一:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态?
资料二:石油催化裂化中通常使用Al2O3作催化剂?
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图?实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味? (1)该装置仪器连接的顺序应遵循的原则为__________,为保证实验成功,实验前必须进行的操作是__________,装置中较长导管的作用是__________?
(2)试管Ⅱ中少量液体凝结说明了__________?
(3)试管Ⅲ中溶液褪色说明了____________________?从下往上,从左到右 检验装置的气密性 导气?冷凝气体 裂化生成了5个碳原子数以上的烃裂化生成了碳原子数小于5的烯烃 (4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是________________________________________?
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式:________________________________________?
(6)石油裂化的重要意义是__________?不能,因为裂化产物中有烯烃,易与溴发生加成反应 可提高石油产品中轻质燃油,特别是汽油的产量和质量解析:仪器连接的顺序应遵循从下往上,从左到右的原则,装入药品之前要检验装置的气密性?依据石油分馏工业的分馏塔原理,设置了长导管,其作用除导气外,兼起冷凝气体的作用;依据催化裂化原理,下列反应皆有可能发生:试管Ⅱ中有液体生成,说明生成5个碳原子数以上的烃,因为常温常压下,5个碳原子数以上的烃大都呈液体,试管Ⅲ中KMnO4溶液褪色说明生成常温常压下呈气态的5个碳原子数以下的烯烃;由于裂化产物中有烯烃生成,易与溴发生加成反应,所以不能用来萃取卤素单质;从以上变化可以看出,石油裂化的主要目的是为了获得更多的轻质燃油,特别是汽油的产量和质量?7.从石油和煤中可以得到多种化工资源,如用来生产苯酚和丙酮的丙烯和苯,其生产流程如下:回答下列问题:
(1)石油分馏时可以得到一些丙烯,但远不能满足生产需要,把石油分馏产品中的重油经过__________可得到更多丙烯?
(2)从煤焦油中分离得到苯的方法为__________?
(3)生产流程中①和②的反应类型为__________________?__________________?
(4)写出反应①和②的化学方程式____________________?__________________?裂解 分馏 加成反应 氧化反应 解析:通过裂解可以从重油中得到更多丙烯?乙烯等产品;煤焦油的主要成分为苯及苯的同系物?稠环芳香烃等?只能用分馏方法分离出苯;反应①使丙烯中的不饱和键变为饱和键,故属于加成反应,反应②中使有机物加氧,属于典型的氧化反应,可以利用元素守恒写出两个化学方程式?8.我国实施“南水北调”工程是为了解决北方地区长期缺水的状况,在这项工程完成之前北方的许多地区是饮用地下水,且地下水中含有较多的Ca2+?Mg2+等,科学上把含有较多Ca2+?Mg2+的水称为硬水?
(1)把硬水中所含Ca2+?Mg2+? 等除去的方法,是加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分为__________和__________(填化学式)?Mg(OH)2 CaCO3 (2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀?该凝聚剂除去悬浮固体颗粒起到净水作用的过程中依次发生__________(填写编号)?
①水解 ②氧化还原反应 ③胶体的聚沉
(3)经过净化后的水要进一步消毒,常用的消毒剂是Cl2,应用Cl2消毒的实质是Cl2和水反应生成了__________(填化学式),Cl2与水反应的离子方程式为:__________________________?②①③ HClO Cl2+H2O====H++Cl-+HClO (4)由于Cl2与水中的有机物作用产生对人体不利的物质,所以世界卫生组织要求停止用Cl2对自来水进行消毒,而用其他的代用品,我国已经开始使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率化(单位质量转移电子数之比)为__________?
(5)从氧化还原反应的角度看,下列物质中,__________可以作为Cl2的代用品?(填写编号)
①Ca(ClO)2 ②NH2Cl(氯胺) ③K2FeO4 ④SO2 ⑤Al2(SO4)3 2.63∶1 ①②③ 解析:水是重要的资源,本题是通过身边的具体物质对水进行考查,内容主要是水的净化?消毒?氧化还原反应等?(1)从溶解度角度分析可以得出,沉淀的主要成分是Mg(OH)2?CaCO3?(2)FeSO4·7H2O除去水中悬浮固体颗粒时发生了氧化还原反应?水解?胶体的聚沉等?(3)Cl2消毒的实质是Cl2与水反应生成了HClO,Cl2+H2O===HCl+HClO?(4)ClO2和Cl2的效毒效率比为 =2.63∶1?(5)具有强氧化性?与水反应的产物对人体等没有影响的物质都可以做水的消毒剂,可选其中的①②③?9.烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如图所示:(1)电解饱和食盐水的
总反应方程式为___________________,阳极发 生的电极反应式为______________________? (2)工业生产用的食盐水进入电解槽之前需精制,请简要说 明需精制的原因:______________________________? (3)目前氯碱工业主要采用的方法有三种,它们各有特点
(见表):因为食盐水中含有Ca2+?Mg2+等杂质,在电解过程中产生的沉淀会堵塞离子膜,所以要除去(3)比较三种方法可看出电解槽的特点,决定了电解槽的革新趋势?
三种方法各有优缺点:隔膜法中产品纯度较低?能耗高,对工人健康不利;水解电解法在能耗?环境污染两方面有问题;离子膜法电解液中氢氧化钠含量较低,但这种方法取代了目前的其他方法,说明电解液中氢氧化钠含量高不是决定因素,而产品纯度很高?总能耗低?无对工人或环境不利的因素成为决定条件?所以,促进电解槽革新的主要因素为:提高产品中氢氧化钠的纯度(或降低产品中氯化钠含量)?降低总能耗?有利于环境或工人的身体健康?(其他表达合理也可)(4)氯碱工业的产品中氯气和氢气为气体,运输和贮藏有相当大的困难,特别是这两种气体的运输过程中还存在很大的安全隐患?联合生产能在很大程度上解决这类问题,而且节约能源?降低成本?减少安全风险,是循环经济?绿色化学的体现? 10.某市市郊某硫酸厂周边地区废气?废渣和废水对土壤?水质量和蔬菜?水稻生产带来严重威胁,据环保部门监察,该地区农业环境与主要农产品质量?土壤和蔬菜已受到严重污染,灌溉水源受轻度污染,稻米品质超出了警戒水平?所以,环境保护与综合利用原料在化工生产中十分重要?
(1)化工厂厂址选择是一个复杂的问题,举例说明它要全面综合考虑的问题有:______________________________(至少举3例)?请比较三种方法的优缺点,指出主要是哪些方面的因素不断促进着电解槽的革新?
(4)氯碱工业的选址比较特殊?如通常不会单独建氯碱化工厂,而是与农药厂?制药厂?盐酸生产厂等建在一起,请分析这种建厂方式的原因和带来的好处? 10.某市市郊某硫酸厂周边地区废气?废渣和废水对土壤?水质量和蔬菜?水稻生产带来严重威胁,据环保部门监察,该地区农业环境与主要农产品质量?土壤和蔬菜已受到严重污染,灌溉水源受轻度污染,稻米品质超出了警戒水平?所以,环境保护与综合利用原料在化工生产中十分重要?
(1)化工厂厂址选择是一个复杂的问题,举例说明它要全面综合考虑的问题有:___________________________________________(至少举3例)?原料?水源?能源?土地供应?市场需求?交通运输?风向?环境保护等 (2)在硫酸生产中主要的尾气是__________,写出有关化学方程式表示如何吸收和利用尾气__________________________?
(3)含有硫酸的废水可以用____________________处理?
(4)煅烧黄铁矿后的废渣可用作制__________的原料,或用于制__________,还可以冶炼__________?SO2 SO2+2NH3+H2O===(NH4)2SO3 (NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O石灰乳中和 水泥砖铁解析:选择化工厂厂址要从原料来源?原料成本?交通情况?周边需求?地理位置?环境保护等方面去思考,本题是开放题,答案合理就行;至于废气?废渣和废水的处理要根据硫酸生产流程综合防治和利用进行考虑,注意选择的方法要合理可行?11.工业上的“三酸两碱”是指硫酸?硝酸?盐酸?纯碱和烧碱,氨气与这些工业原料的生产有着密切的关系?如氨气是生成硝酸?纯碱的原料,其水溶液是硫酸工业中尾气的吸收剂?下面是部分生产工艺流程图或装置图?材料一 侯氏制纯碱工艺流程图:材料二 阳离子交换膜法电解饱和食盐水原理示意图:材料三 某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程:请回答下列问题:
(1)材料一中第Ⅳ步操作名称为__________,为什么先通入A气体再通B气体?__________________?
(2)材料二中精制的食盐水通过离子交换膜电解槽电解,透过阳离子交换膜的离子a是__________,b入口通入的溶液是__________,电解饱和食盐水的离子方程式是______________________?加热分解 A为氨气,先通入氨气,一方面提供反应物,
另一方面使溶液呈碱性有利于CO2的吸收Na+ 精制的饱和食盐水 (3)工业上除用电解法制烧碱外,还可用熟石灰—纯碱法来生产,写出有关反应方程式:______________________________________?
(4)材料三中沉淀池内发生的主要反应方程式是_______
___________________________________,从绿色化学和资源综合利用的角度,说明上述流程的主要优点是____________________________________________________________________________________________________________________?Ca(OH)2+Na2CO3====CaCO3↓+2NaOHCaSO4+CO2+2NH3+H2O=====CaCO3↓+(NH4)2SO4 该流程中,产生的CO2可循环使用,得到的产品和副产品都是有用的物质,不会造成环境污染12.第47届联合国大会将每年的3月22日定为“世界水日”?我国是一个淡水资源平均水平远低于世界平均水平的缺水国家,海水淡化是解决我国淡水缺乏的一种好方法,海水淡化技术成为我国“十五”期间科技攻关的一个项目,海水淡化也被誉为21世纪的朝阳产业? (1)有一种真空蒸发式海水淡化装置,该装置利用柴油机缸套废热水加热海水,使其蒸发汽化,蒸发温度为40 ℃左右?产出的蒸汽冷凝成淡水,淡水汇入集水槽,由水泵抽出,供船上使用?该装置的原理为__________________________,与电渗析法原理__________(填“是”或“不”)相同;
(2)水的沸点为100 ℃,为什么在此条件下蒸发温度仅为40 ℃左右?__________________________;使海水中的水分蒸发,然后冷凝得到淡水 不因为在此条件下,压强很小,压强越小,物质的沸点越低(3)该淡化过程中体现了哪些资源的合理利用? ?答案:使柴油机缸套废热水得到充分合理利用,并得到淡水资源解析:本题中装置为真空蒸发式海水淡化装置,一定要从装置名称中得到解题关键信息,即蒸发海水时压强很小,使水的沸点降低,可以用较少热量使水蒸发汽化,在充分节约能源的同时,又得到资源(淡水)?
1.天然水净化
(1)混凝法
①一般过程:混凝沉淀?过滤?杀菌?
②常用的混凝剂:明矾?绿矾?聚合铝?硫酸铁等?
③明矾净水反应原理:离子方程式为
(2)化学软化法
①具有暂时硬度的水:水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的?常用软化方法为加热法,反应原理为②具有永久硬度的水:水的硬度是由钙?镁的硫酸盐或氯化物所引起的,常用软化方法为药剂法和离子交换法?
a.药剂法:把纯碱?生石灰等试剂加入到硬水中,与Ca2+?Mg2+反应形成沉淀,分离?
b.离子交换法:用离子交换剂除去硬水中的Ca2+?Mg2+?如用离子交换树脂软化水的过程为
2NaR+Ca2+===CaR2+2Na+,
2NaR+Mg2+====MgR2+2Na+?
而离子交换树脂的再生(用离子方程式表示)为
CaR2+2Na+===2NaR+Ca2+?2.污水处理
(1)酸碱中和法
酸性废水常用熟石灰中和,碱性废水常用H2SO4或CO2中和?
(2)沉淀法
Hg2+?Pb2+?Cu2+等重金属离子可用Na2S除去,反应的离子方程式为Hg2++S2-===HgS↓,
Pb2++S2-===PbS↓,Cu2++S2-===CuS↓?
3.海水淡化
常用方法为蒸馏法?电渗析法等?二?海水中盐的开发和利用
1.海水制盐
(1)利用蒸发法,从海水中主要获得氯化钠及氯化镁?氯化钾等副产品?
(2)电渗析法?冷冻法不仅能制得盐,同时还可得到淡水?
2.氯碱工业——食盐资源的利用
离子交换膜法电解食盐水:
(1)设备:离子交换膜电解槽?离子交换膜只允许Na+通过?
(2)原理:化学方程式为
?(3)工艺流程
在进入电解槽前需通过离子交换树脂进一步除去Ca2+?Mg2+等离子,以防破坏离子交换膜?
(4)产品
阳极室产品:氯气,补充饱和食盐水流出淡盐水?
阴极室产品:氢气和NaOH,补充纯水(加入一定NaOH溶液)流出NaOH溶液? 3.粗盐的精制
(1)目的:除去泥沙,使Ca2+?Mg2+?Fe3+? 等离子的含量达到要求?
(2)原因:Ca2+?Mg2+等会在碱溶液中形成沉淀,破坏离子交换膜,泥沙及 会引起杂质?
(3)试剂:BaCl2?Ca(OH)2?Na2CO3?稀盐酸?
用BaCl2除去 ,用Ca(OH)2除去Mg2+?Fe3+,用Na2CO3除去Ba2+及Ca2+,所加沉淀剂需过量?
试剂的加入顺序:纯碱须加在钡试剂后,稀盐酸加在过滤后? (4)有关反应方程式:三?海水提取溴的原理探究
1.工艺流程2.主要反应原理:Cl2+2Br-===Br2+2Cl-
3.溴的吸收富集
(1)纯碱吸收法:海水中的溴离子被氧化为溴单质后,用热空气或水蒸气吹出,通过Na2CO3溶液使溴富集后,再将得到的溶液用稀硫酸酸化,用有机溶剂萃取溴单质?发生的反应:
3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑
5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O(2)SO2吸收法:用空气吹出的溴和大量的空气混合在一起,不易分离,用还原剂SO2吸收后,再用氯气氧化HBr即得到溴单质?特别提醒:①通氯气前要将海水酸化,pH为3.5时,氯气的氧化效果最好?
②用空气或H2O(g)将溴吹出,而不用CCl4萃取,因后者工艺复杂,设备投资大,经济效益低且对环境污染严重?四?海水提取镁工艺流程和化学平衡原理的应用
1.生产步骤
(1)加熟石灰;(2)过滤;(3)加盐酸;(4)浓缩结晶脱水干燥;(5)熔融电解?
2.工艺流程3.主要化学反应
(1)制备石灰乳4.工业生产中平衡原理的应用
(1)沉淀溶解平衡原理的应用
①向海水中加入沉淀剂Ca(OH)2,由于c(OH-)增大,Mg(OH)2的溶解度小于Ca(OH)2,可最大程度地将Mg2+转化为Mg(OH)2沉淀?
②向Mg(OH)2沉淀中加入盐酸,使沉淀溶解平衡右移? (2)水解平衡原理的应用
在MgCl2·6H2O脱水变为MgCl2时,由于MgCl2+2H2O
Mg(OH)2+2HCl水解平衡的存在,在HCl气体环境中,增大c(OH-),抑制了MgCl2的水解,避免了Mg(OH)2的生成?特别提醒:①为提高反应中Mg2+的浓度,将海水浓缩或用提取食盐后的盐卤?
②电解熔融MgCl2生成的Cl2可用于制盐酸,循环使用,节省成本?
③所得Mg(OH)2沉淀中含有的CaSO4杂质在加盐酸前应除去,以保证MgCl2的纯度?五?石油?煤?天然气的综合利用
1.石油和天然气
(1)石油的综合利用
①石油的分馏,分为常压分馏和减压分馏?
②石油的催化裂化:如十六烷裂化?
③石油的裂解:如己烷裂解? (2)天然气的综合利用
除了直接用作燃料外,还可以制造合成氨原料气(H2),合成甲醇及其他化工原料?例如:天然气重整的方程式
?2.裂化?裂解的对比3.煤的综合利用
(1)煤的干馏:将煤隔绝空气加强热,使之分解的过程,得到的固体物质焦炭?液态物质煤焦油?粗氨水,气态物质焦炉气,成分为H2?CH4?CO?CO2?N2等?
(2)煤的气化:是把煤中的有机物转化为可燃性气体的过程? (3)煤的液化
①直接液化:煤与氢气作用生成液体燃料?
②间接液化:先把煤转化成CO和H2,再催化合成烃类燃料?醇燃料及化学品等?体验热身1.下列叙述正确的是( )
①海水中含有大量的Br-,所以从海水中提取溴一般要经历浓缩和提取两个步骤
②铝是一种比较活泼的金属,所以铝合金制品易被腐蚀
③在煤中加入适量的生石灰,可以减少煤燃烧时二氧化硫的排放
④制造玻璃的主要原料是纯碱?石灰石和石英
A.②③ B.②④
C.①③D.③④答案:D
解析:海水中提取Br2要经历富集?氧化?萃取等,①错;铝在常温下易形成一层致密的氧化膜,不易被腐蚀,②错;根据钙基固硫,加入适量CaO可吸收SO2,减少污染,故选③④,D项正确?2.某工厂排放的酸性废水中含有较多的Cu 2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的( )
A.食盐?硫酸B.胆矾?石灰水
C.铁粉?生石灰D.苏打?盐酸答案:C解析:铁粉能除去Cu2+,生石灰能中和H+且能沉淀Fe3+?A项中增加废水的酸性,且不能除去Cu2+,B项中增加废水中的Cu2+,D项中增加废水的酸性?3.我国实施的“南水北调”工程是为了解决北方地区长期缺水的状况,在这项工程完成之前北方的许多地区使用的是地下水,而地下水中含有较大量的Ca 2+?Mg2+等?科学上把含有较多Ca2+?Mg2+的水称为硬水?(1)将硬水中所含Ca2+?Mg2+? 等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分为__________和__________(填化学式)?
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3胶体沉淀?凝聚剂除去悬浮固体颗粒起到净水作用的过程中__________(填编号)?
①发生水解 ②发生氧化还原反应 ③发生胶体的聚沉 Mg(OH)2 CaCO3 ①②③ (3)净化后的水要进一步消毒,常用的消毒剂是Cl2?Cl2消毒的实质是Cl2和水反应生成了__________(填化学式),Cl2与水反应的离子方程式为__________?
(4)由于Cl2与水中的有机物作用会产生对人体不利的物质,所以世界卫生组织要求停止用Cl2对自来水进行消毒,而用其他的代用品,我国已经开始使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率之比为__________?
(5)从氧化还原反应角度看,下列物质中__________(填编号)可以作为Cl2的代用品?
①Ca(ClO)2 ②NH2Cl(氯氨) ③K2FeO4 ④SO2 ⑤Al2(SO4)3HClO Cl2+H2O====H++HClO+Cl- 2.63∶1 ①②③ 解析:水是重要的资源,所以有关水的题目也很多?
(1)从溶解度角度可以得出沉淀是Mg(OH)2?CaCO3;
(2)FeSO4·7H2O是常用的凝聚剂,其净水的过程发生了水解?氧化还原反应?胶体的聚沉等;(3)消毒剂Cl2的消毒作用主要是因为Cl2与水反应的产物中有HClO,Cl2+H2O===HCl+HClO;(4)使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率之比为
;(5)一般具有强氧化性?与水反应的产物对人体等没有影响的试剂都可以作水的消毒剂,如选项中的①②③?4.气化和液化是使煤变成清洁能源的有效途径?煤的气化的重要反应是: 和H2的混合气体是合成多种有机物的原料气?下图是合成某些物质的路线:其中,D易溶于水,且与CH3COOH互为同分异构体,F分子中的碳原子数是D中的3倍,H经催化氧化可得到G?请回答下列问题:
(1)写出下列物质的结构简式:
A____________________,H______________;指出A和H的关系:____________________?CH3OH CH3CH2CH2CH2OH 同系物 (2)利用合成气(H2+CO)生产汽油?甲醇和氨等已经实现了工业化,合成气也可合成醛?酸?酯等多种产物,下列表述正确的是__________?
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可得到不同的产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
④从合成气出发生成气态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有烯烃或水
A.①②④ B.②③④ C.②④⑤ D.③④⑤B (3)写出下列反应的化学方程式:
:___________________
____________________________________________;
②D与新制氢氧化铜加热:_____________
_____________________________________________?解析:本题以能源为载体考查烃的衍生物的性质,命题着眼点在于煤的气化和液化,同时它又结合有机化学反应类型,要求整合新信息得出结论?
(1)由题图知,A经两次催化氧化得到C,则A为CH3OH;B为HCHO,C为HCOOH,且H应为CH3CH2CH2CH2OH,G为CH3CH2CH2CHO,D的分子式为C2H4O2,易溶于水,说明不是酯,则D为HOCH2CHO,E为HOCH2—CH2OH,F为CH3COOCH2—CH2OOCCH3?
(2)依题意,CO和H2可合成汽油,汽油是烃类,所以必然生成水,不是化合反应,①和⑤都不正确?重点探究平衡移动原理在工业生产中的应用
1.沉淀溶解平衡原理
(1)沉淀的转化
①加热法转化暂时硬水时所得产物为CaCO3和Mg(OH)2,而不是CaCO3和MgCO3
反应: ,
但因为Mg(OH)2的溶解度远小于MgCO3,因此加热条件下又发生反应 .
②向海水中加入沉淀剂石灰乳,因为Mg(OH)2溶解度小于Ca(OH)2,所以Ca(OH)2会转化为Mg(OH)2? (2)沉淀的溶解
向Mg(OH)2中加入盐酸,使Mg(OH)2的溶解平衡向溶解的方向移动?
2.水解平衡原理
因MgCl2溶液浓缩结晶产物为MgCl2·6H2O,若直接加热,则因为促进MgCl2水解,MgCl2+2H2O Mg(OH)2+2HCl,水解平衡右移,使MgCl2不纯净,因此,在HCl气氛中,增大了c(HCl),抑制了MgCl2的水解?命题聚焦 聚焦1 氯碱工业粗盐的精制【例1】 氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下: 依据上图完成下列填空:
(1)与电源正极相连的电极上所发生的反应的化学方程式为______________________,与电源负极相连的电极附近,溶液的pH__________(填“不变”“升高”或“降低”)?2Cl--2e-===Cl2↑ 升高 (2)工业食盐中含Ca2+?Mg2+? 等杂质,为有效除去它们,加入试剂的合理顺序为__________?
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3bc (3)如果粗盐中 含量较高,必须添加钡试剂除去 ,
该钡试剂是否添加过量的判断方法是____________________________________?
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发?冷却?__________(填写操作名称)除去NaCl?
(5)由图示可知用离子交换膜法电解制碱工艺中,__________产品可循环使用?
(6)已知NaCl在60 ℃时的溶解度为37.1 g,现电解60 ℃时的粗制饱和食盐水1 371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为__________mol·L-1? 静置后取上层清液(或直接向上层清液)继续加入钡试剂,若
溶液变浑浊则证明钡试剂不足,若溶液无明显变化则证明钡试剂已经过量过滤 NaCl(或淡盐水) 7.14 解析:在电解饱和NaCl溶液时,电解池阴极附近溶液的pH会升高的原因是:电解时,Na+?H+在阴极放电:2H++2e-===H2↑,而H+在阴极不断放电打破了水的电离平衡,使阴极附近溶液中c(OH-)增大,故电解一段时间后阴极生成NaOH?离子交换膜法电解制碱技术同以前无隔膜法相比,避免了因Cl2进入阴极区与NaOH溶液接触发生如下发应:Cl2+2NaOH===NaCl+NaClO+H2O,影响产品的质量?方法归纳:氯碱工业是传统化工的重要内容,其主要产品有氯气?氢气?盐酸和烧碱,如今科学的发展赋予氯碱工业新的内容?化工生产相关问题的考查点主要还是基本原理,复习过程中要注意从工艺流程中提取出相关物质的物理?化学性质,尤其是与该生产工艺相关的性质,如制备?分离提纯?尾气处理等所用到的性质?要注重理解生产工艺中一些流程?操作的原理?聚焦2 海水提取镁工艺流程的化学平衡原理【例2】 海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl?Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为__________?
a.蒸馏 b.灼烧 c.过滤 d.蒸发 e.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是________________________?ec 在HCl气流中加热脱水 (3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是________?
a.精制饱和食盐水进入阳极室
b.纯水(加一定量NaOH)进入阴极室
c.阴极产物为氢氧化钠和氢气
d.阳极的电极反应为:Cl2+2e-===2Cl-d (4)母液中常含有MgCl2?NaCl?MgSO4?KCl等(其溶解度与温度的关系如图所示),可进一步加工制得一些重要的产品?若将母液加热升温到60 ℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是________;过滤上述晶体后,将滤液降温到30 ℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体?MgSO4?NaCl KCl 解析:(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,考虑MgCl2水解的因素,可以采取降温结晶方法?(2)为防止MgCl2水解,必须在HCl气流中加热脱水?(3)离子交换膜电解槽的阳极为金属钛网制成的?(4)由溶解度曲线可知,MgCl2?KCl随温度升高溶解度增大较多,而MgSO4随温度升高溶解度减小,NaCl随温度升高溶解度变化不大?因此在60 ℃以上析出的晶体主要是MgSO4?NaCl,30 ℃以下析出的晶体主要是MgCl2和KCl,用冷水洗涤该晶体,由于MgCl2的溶解度较大,最后可得到比较纯净的KCl晶体?方法归纳:通过图像考查考生的实验分析能力是高考的要求,本题一方面考查对氯碱工业相关实验的熟悉程度,另一方面还注重考查学生对图像的分析能力,符合现代高考对考生能力的要求?聚焦3 化石燃料的开发?利用
【例3】 (2008年潍坊)从原料和环境方面的要求看,绿色化学对生产中的化学反应提出了一个高原子利用率的要求,即尽可能不采用那些对产品的化学组成来说没有必要的原料?现有下列3种合成苯酚的反应路线:其中符合原子节约要求的生产过程是( )
A.只有①
B.只有②
C.只有③
D.①②③
解析:只有③直接氧化,一步反应,产率高,且得到苯酚和另一种重要的有机化工原料丙酮?
答案:C方法归纳:绿色化学是一种始端处理技术?简单说就是绿色原料?绿色工艺?绿色产物,总之我们尽可能选择无污染或少污染的原料?溶剂?催化剂及无污染工艺,从源头防止或减少环境污染?高效作业1.目前下列工艺过程没有直接使用离子交换技术的是( )
A.硬水的软化
B.电解饱和食盐水制造NaOH
C.电渗析淡化海水
D.海水中提取金属Mg
答案:D解析:硬水的软化?电解饱和食盐水制NaOH?电渗析淡化海水均使用离子交换技术;海水提取镁,使其发生反应Ca(OH)2+MgCl2[FY=]Mg(OH)2↓+CaCl2,再过滤得Mg(OH)2,最终制得Mg,没有使用离子交换技术?2.下列各工业生产中,石灰石?生石灰?熟石灰都不能作为原料的是( )
①炼铁 ②用生铁炼钢 ③从海水中提取镁 ④铝的冶炼 ⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧制硫酸
A.④⑧
B.⑤⑥
C.①②③
D.⑤⑥⑦答案:A
解析:①炼铁中加石灰石造渣,②炼钢中加生石灰除硅?锰,③提取镁用熟石灰沉淀Mg2+,⑤制水泥的主要原料是石灰石和黏土,⑥制玻璃的主要原料是碳酸钠?石灰石和二氧化硅,⑦制漂白粉用熟石灰和Cl2反应?故选A?3.工业上获得苯主要通过( )
A.煤的干馏
B.石油常压分馏
C.石油减压分馏
D.石油催化裂化
答案:A
解析:煤通过干馏得到煤焦油,在煤焦油中含有多种芳香族化合物,从中可以得到苯?石油分馏得到含碳原子数不一的烷烃混合物,得不到苯?石油催化裂化主要得到含不饱和烃的汽油?故选A?4.下列说法中,不正确的是( )
A.煮沸暂时硬水时,水的硬度一定降低
B.硬水中加入适量石灰水后,由于生成Mg(OH)2?CaCO3沉淀,水就软化了
C.永久硬水主要是由含有Ca2+?Mg2+的硫酸盐和氯化物形成的,加热煮沸是不能软化的
D.如果用HR型离子交换树脂软化硬水,则发生的交换反应可以表示为Ca2++2HR===CaR2+2H+答案:B解析:水的硬度是由Ca(HCO3)2或Mg(HCO3)2引起的,称为暂时硬水,可通过加热煮沸方法进行软化?水的硬度是由Ca2+?Mg2+的硫酸盐或氯化物引起的,称为永久硬水,加热煮沸不能软化,可通过药剂法[加入Na2CO3?Ca(OH)2]及离子交换法(如Ca2++2HR===CaR2+2H+)进行软化,B项中加入Ca(OH)2,只能除去Mg2+,再加入Na2CO3才能除去Ca2+,故B项错?5.用高铁酸钠(Na2FeO4)对来自河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒和净化处理的优点分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解生成Fe(OH)2,可使水中悬浮物凝聚沉降
D.Na2FeO4中的Fe元素为+6价,具有强氧化性,能消毒杀菌答案:BD解析:Na2FeO4中Fe元素显+6价,处于最高价具有强氧化性,所以能杀菌,且还原产物为Fe3+,由于Fe3++3H2O
Fe(OH)2(胶体)+3H+,Fe(OH)3胶体具有净水作用?6.如何从石油获取更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油?
资料一:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态?
资料二:石油催化裂化中通常使用Al2O3作催化剂?
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图?实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味? (1)该装置仪器连接的顺序应遵循的原则为__________,为保证实验成功,实验前必须进行的操作是__________,装置中较长导管的作用是__________?
(2)试管Ⅱ中少量液体凝结说明了__________?
(3)试管Ⅲ中溶液褪色说明了____________________?从下往上,从左到右 检验装置的气密性 导气?冷凝气体 裂化生成了5个碳原子数以上的烃裂化生成了碳原子数小于5的烯烃 (4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是________________________________________?
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式:________________________________________?
(6)石油裂化的重要意义是__________?不能,因为裂化产物中有烯烃,易与溴发生加成反应 可提高石油产品中轻质燃油,特别是汽油的产量和质量解析:仪器连接的顺序应遵循从下往上,从左到右的原则,装入药品之前要检验装置的气密性?依据石油分馏工业的分馏塔原理,设置了长导管,其作用除导气外,兼起冷凝气体的作用;依据催化裂化原理,下列反应皆有可能发生:试管Ⅱ中有液体生成,说明生成5个碳原子数以上的烃,因为常温常压下,5个碳原子数以上的烃大都呈液体,试管Ⅲ中KMnO4溶液褪色说明生成常温常压下呈气态的5个碳原子数以下的烯烃;由于裂化产物中有烯烃生成,易与溴发生加成反应,所以不能用来萃取卤素单质;从以上变化可以看出,石油裂化的主要目的是为了获得更多的轻质燃油,特别是汽油的产量和质量?7.从石油和煤中可以得到多种化工资源,如用来生产苯酚和丙酮的丙烯和苯,其生产流程如下:回答下列问题:
(1)石油分馏时可以得到一些丙烯,但远不能满足生产需要,把石油分馏产品中的重油经过__________可得到更多丙烯?
(2)从煤焦油中分离得到苯的方法为__________?
(3)生产流程中①和②的反应类型为__________________?__________________?
(4)写出反应①和②的化学方程式____________________?__________________?裂解 分馏 加成反应 氧化反应 解析:通过裂解可以从重油中得到更多丙烯?乙烯等产品;煤焦油的主要成分为苯及苯的同系物?稠环芳香烃等?只能用分馏方法分离出苯;反应①使丙烯中的不饱和键变为饱和键,故属于加成反应,反应②中使有机物加氧,属于典型的氧化反应,可以利用元素守恒写出两个化学方程式?8.我国实施“南水北调”工程是为了解决北方地区长期缺水的状况,在这项工程完成之前北方的许多地区是饮用地下水,且地下水中含有较多的Ca2+?Mg2+等,科学上把含有较多Ca2+?Mg2+的水称为硬水?
(1)把硬水中所含Ca2+?Mg2+? 等除去的方法,是加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分为__________和__________(填化学式)?Mg(OH)2 CaCO3 (2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀?该凝聚剂除去悬浮固体颗粒起到净水作用的过程中依次发生__________(填写编号)?
①水解 ②氧化还原反应 ③胶体的聚沉
(3)经过净化后的水要进一步消毒,常用的消毒剂是Cl2,应用Cl2消毒的实质是Cl2和水反应生成了__________(填化学式),Cl2与水反应的离子方程式为:__________________________?②①③ HClO Cl2+H2O====H++Cl-+HClO (4)由于Cl2与水中的有机物作用产生对人体不利的物质,所以世界卫生组织要求停止用Cl2对自来水进行消毒,而用其他的代用品,我国已经开始使用ClO2代替Cl2对自来水进行消毒,ClO2和Cl2的消毒效率化(单位质量转移电子数之比)为__________?
(5)从氧化还原反应的角度看,下列物质中,__________可以作为Cl2的代用品?(填写编号)
①Ca(ClO)2 ②NH2Cl(氯胺) ③K2FeO4 ④SO2 ⑤Al2(SO4)3 2.63∶1 ①②③ 解析:水是重要的资源,本题是通过身边的具体物质对水进行考查,内容主要是水的净化?消毒?氧化还原反应等?(1)从溶解度角度分析可以得出,沉淀的主要成分是Mg(OH)2?CaCO3?(2)FeSO4·7H2O除去水中悬浮固体颗粒时发生了氧化还原反应?水解?胶体的聚沉等?(3)Cl2消毒的实质是Cl2与水反应生成了HClO,Cl2+H2O===HCl+HClO?(4)ClO2和Cl2的效毒效率比为 =2.63∶1?(5)具有强氧化性?与水反应的产物对人体等没有影响的物质都可以做水的消毒剂,可选其中的①②③?9.烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如图所示:(1)电解饱和食盐水的
总反应方程式为___________________,阳极发 生的电极反应式为______________________? (2)工业生产用的食盐水进入电解槽之前需精制,请简要说 明需精制的原因:______________________________? (3)目前氯碱工业主要采用的方法有三种,它们各有特点
(见表):因为食盐水中含有Ca2+?Mg2+等杂质,在电解过程中产生的沉淀会堵塞离子膜,所以要除去(3)比较三种方法可看出电解槽的特点,决定了电解槽的革新趋势?
三种方法各有优缺点:隔膜法中产品纯度较低?能耗高,对工人健康不利;水解电解法在能耗?环境污染两方面有问题;离子膜法电解液中氢氧化钠含量较低,但这种方法取代了目前的其他方法,说明电解液中氢氧化钠含量高不是决定因素,而产品纯度很高?总能耗低?无对工人或环境不利的因素成为决定条件?所以,促进电解槽革新的主要因素为:提高产品中氢氧化钠的纯度(或降低产品中氯化钠含量)?降低总能耗?有利于环境或工人的身体健康?(其他表达合理也可)(4)氯碱工业的产品中氯气和氢气为气体,运输和贮藏有相当大的困难,特别是这两种气体的运输过程中还存在很大的安全隐患?联合生产能在很大程度上解决这类问题,而且节约能源?降低成本?减少安全风险,是循环经济?绿色化学的体现? 10.某市市郊某硫酸厂周边地区废气?废渣和废水对土壤?水质量和蔬菜?水稻生产带来严重威胁,据环保部门监察,该地区农业环境与主要农产品质量?土壤和蔬菜已受到严重污染,灌溉水源受轻度污染,稻米品质超出了警戒水平?所以,环境保护与综合利用原料在化工生产中十分重要?
(1)化工厂厂址选择是一个复杂的问题,举例说明它要全面综合考虑的问题有:______________________________(至少举3例)?请比较三种方法的优缺点,指出主要是哪些方面的因素不断促进着电解槽的革新?
(4)氯碱工业的选址比较特殊?如通常不会单独建氯碱化工厂,而是与农药厂?制药厂?盐酸生产厂等建在一起,请分析这种建厂方式的原因和带来的好处? 10.某市市郊某硫酸厂周边地区废气?废渣和废水对土壤?水质量和蔬菜?水稻生产带来严重威胁,据环保部门监察,该地区农业环境与主要农产品质量?土壤和蔬菜已受到严重污染,灌溉水源受轻度污染,稻米品质超出了警戒水平?所以,环境保护与综合利用原料在化工生产中十分重要?
(1)化工厂厂址选择是一个复杂的问题,举例说明它要全面综合考虑的问题有:___________________________________________(至少举3例)?原料?水源?能源?土地供应?市场需求?交通运输?风向?环境保护等 (2)在硫酸生产中主要的尾气是__________,写出有关化学方程式表示如何吸收和利用尾气__________________________?
(3)含有硫酸的废水可以用____________________处理?
(4)煅烧黄铁矿后的废渣可用作制__________的原料,或用于制__________,还可以冶炼__________?SO2 SO2+2NH3+H2O===(NH4)2SO3 (NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O石灰乳中和 水泥砖铁解析:选择化工厂厂址要从原料来源?原料成本?交通情况?周边需求?地理位置?环境保护等方面去思考,本题是开放题,答案合理就行;至于废气?废渣和废水的处理要根据硫酸生产流程综合防治和利用进行考虑,注意选择的方法要合理可行?11.工业上的“三酸两碱”是指硫酸?硝酸?盐酸?纯碱和烧碱,氨气与这些工业原料的生产有着密切的关系?如氨气是生成硝酸?纯碱的原料,其水溶液是硫酸工业中尾气的吸收剂?下面是部分生产工艺流程图或装置图?材料一 侯氏制纯碱工艺流程图:材料二 阳离子交换膜法电解饱和食盐水原理示意图:材料三 某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程:请回答下列问题:
(1)材料一中第Ⅳ步操作名称为__________,为什么先通入A气体再通B气体?__________________?
(2)材料二中精制的食盐水通过离子交换膜电解槽电解,透过阳离子交换膜的离子a是__________,b入口通入的溶液是__________,电解饱和食盐水的离子方程式是______________________?加热分解 A为氨气,先通入氨气,一方面提供反应物,
另一方面使溶液呈碱性有利于CO2的吸收Na+ 精制的饱和食盐水 (3)工业上除用电解法制烧碱外,还可用熟石灰—纯碱法来生产,写出有关反应方程式:______________________________________?
(4)材料三中沉淀池内发生的主要反应方程式是_______
___________________________________,从绿色化学和资源综合利用的角度,说明上述流程的主要优点是____________________________________________________________________________________________________________________?Ca(OH)2+Na2CO3====CaCO3↓+2NaOHCaSO4+CO2+2NH3+H2O=====CaCO3↓+(NH4)2SO4 该流程中,产生的CO2可循环使用,得到的产品和副产品都是有用的物质,不会造成环境污染12.第47届联合国大会将每年的3月22日定为“世界水日”?我国是一个淡水资源平均水平远低于世界平均水平的缺水国家,海水淡化是解决我国淡水缺乏的一种好方法,海水淡化技术成为我国“十五”期间科技攻关的一个项目,海水淡化也被誉为21世纪的朝阳产业? (1)有一种真空蒸发式海水淡化装置,该装置利用柴油机缸套废热水加热海水,使其蒸发汽化,蒸发温度为40 ℃左右?产出的蒸汽冷凝成淡水,淡水汇入集水槽,由水泵抽出,供船上使用?该装置的原理为__________________________,与电渗析法原理__________(填“是”或“不”)相同;
(2)水的沸点为100 ℃,为什么在此条件下蒸发温度仅为40 ℃左右?__________________________;使海水中的水分蒸发,然后冷凝得到淡水 不因为在此条件下,压强很小,压强越小,物质的沸点越低(3)该淡化过程中体现了哪些资源的合理利用? ?答案:使柴油机缸套废热水得到充分合理利用,并得到淡水资源解析:本题中装置为真空蒸发式海水淡化装置,一定要从装置名称中得到解题关键信息,即蒸发海水时压强很小,使水的沸点降低,可以用较少热量使水蒸发汽化,在充分节约能源的同时,又得到资源(淡水)?
同课章节目录
