高中化学 第2节 化学电源课件 新人教版选修4
文档属性
| 名称 | 高中化学 第2节 化学电源课件 新人教版选修4 |  | |
| 格式 | rar | ||
| 文件大小 | 817.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-10 17:02:00 | ||
图片预览





文档简介
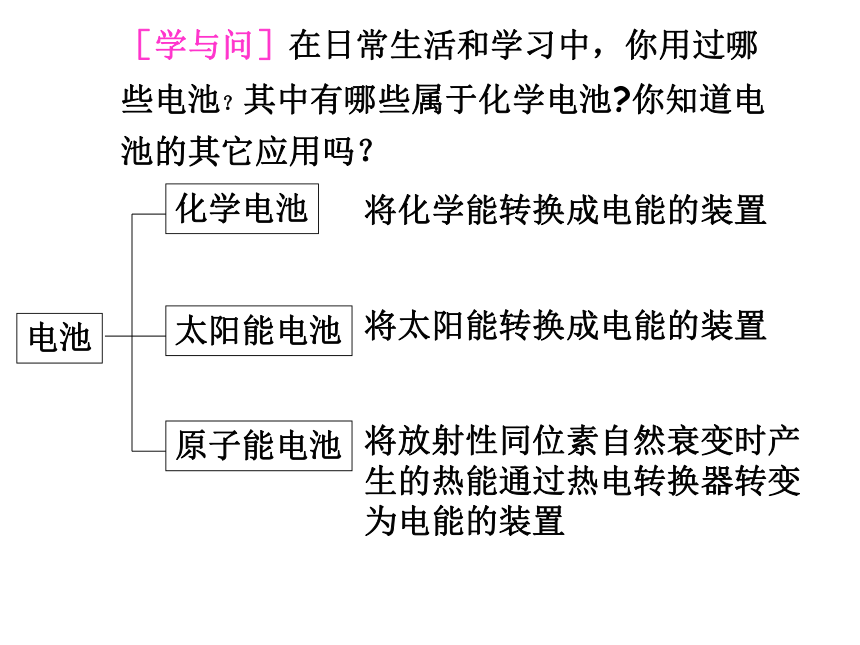
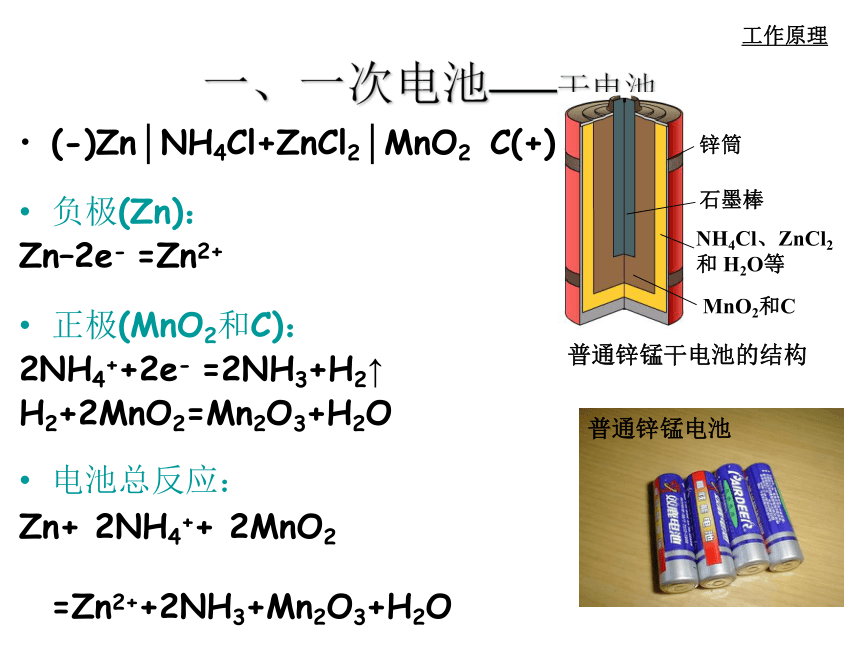
课件22张PPT。第四章 电化学基础第二节 化学电源[学与问]在日常生活和学习中,你用过哪些电池?其中有哪些属于化学电池?你知道电池的其它应用吗? 电池化学电池太阳能电池原子能电池将化学能转换成电能的装置将太阳能转换成电能的装置将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置用途广泛的电池用于汽车的铅蓄电池和燃料电池用途广泛的电池用于“神六”的太阳能电池笔记本电脑专用电池手机专用电池摄像机专用电池各式各样的纽扣电池小型高性能燃料电池 阅读教材P74页并回答问题:1、化学电池与其它能源相比有哪些优点?2、判断电池的优劣标准主要是什么?3、目前化学电池主要分哪几大类?能量转换效率高,供能稳定可靠,可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便,易于维护,并可在各种环境下工作单位质量或单位体积所能输出电能的多少,即比能量的大小;输出功率的大小即比功率的大小以及电池的存储时间的长短。除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。化学电池氢气、甲醇、天然气、煤气与氧气组成燃料电池 电池中的反应物质消耗到一定程度,就不能再次利用。 又称充电电池或蓄电池。放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用。 是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池。一、一次电池——干电池(-)Zn│NH4Cl+ZnCl2│MnO2 C(+)
负极(Zn):
Zn–2e- =Zn2+
正极(MnO2和C):
2NH4++2e- =2NH3+H2↑
H2+2MnO2=Mn2O3+H2O
电池总反应:
Zn+ 2NH4++ 2MnO2
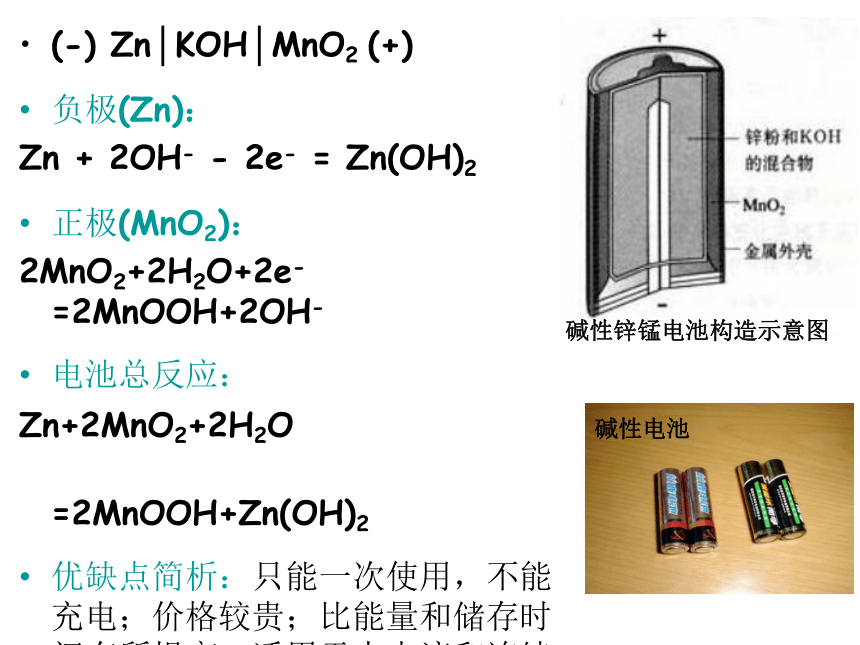
=Zn2++2NH3+Mn2O3+H2O工作原理碱性锌锰电池构造示意图(-) Zn│KOH│MnO2 (+)
负极(Zn):
Zn + 2OH- - 2e- = Zn(OH)2
正极(MnO2):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2H2O
=2MnOOH+Zn(OH)2
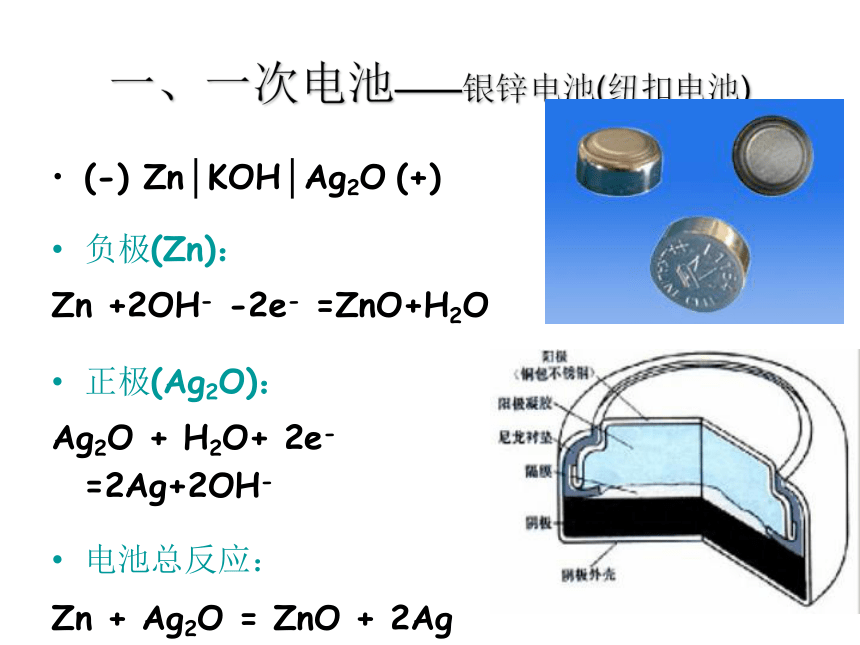
优缺点简析:只能一次使用,不能充电;价格较贵;比能量和储存时间有所提高,适用于大电流和连续放电。一、一次电池——银锌电池(纽扣电池)(-) Zn│KOH│Ag2O (+)
负极(Zn):
Zn +2OH- -2e- =ZnO+H2O
正极(Ag2O):
Ag2O + H2O+ 2e- =2Ag+2OH-
电池总反应:
Zn + Ag2O = ZnO + 2Ag二、二次电池——铅蓄电池(-) Pb│H2SO4│PbO2 (+)
负极(Pb):
Pb-2e-+SO42-=PbSO4
正极(PbO2):
PbO2+2e-+4H++SO42-
=PbSO4+2H2O
电池总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
阅读P76,了解铅蓄电池的充电原理及铅蓄电池的优缺点。放电原理充电原理①放电过程
负极:氧化反应 Pb(s)+SO42-(aq)-2e-=PbSO4(s)
正极:还原反应
PbO2(s)+4H+(aq)+SO42-(aq)+2e-=2PbSO4 (s) +2H2O(l)
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
②充电过程
阴极(接电源负极):还原反应
PbSO4(s)+2e-=Pb(s)+SO42-(aq)
阳极(接电源正极):氧化反应
PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq)
充电过程总反应:
2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq) 缺点:比能量低、笨重、废弃电池污染环境
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池:镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……铅蓄电池的充放电过程:铅蓄电池的优缺点简析:三、燃料电池——氢氧燃料电池 (-) Pt│H2│H+│O2│Pt (+)
负极(Pt):2H2-4e-=4H+
正极(Pt):O2+4H++4e-=2H2O
电池总反应:2H2+O2=2H2O
(-) Pt│H2│OH-│O2│Pt (+)
负极(Pt):2H2-4e-+4OH-=4H2O
正极(Pt):O2+2H2O+4e-=4OH-
电池总反应:2H2+O2=2H2O工作原理 ①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……燃料电池的规律燃料电池与前几种电池的差别: ①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。化学电池的组成能导电的物质还原性较强的物质(多是金属电极本身)氧化性较强的物质酸溶液
碱溶液
盐溶液
或
熔融液小结流出电子流入电子氧化反应还原反应减 少 污 染
节 约 资 源书写电极反应式应注意以下几点:1.确定原电池的正负极,弄清正负极上发生反应的物质;
2.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
3.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;书写电极反应式应注意以下几点:4.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
5.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。再 见 练习1、航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2=2H2O,
酸式电池中电解质是酸,其负极反应可表示为2H2-4e-=4H+ ,则其正极反应式为:
_______________________。
碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应可表示为:______________________。O2+4e-+4H+=2H2O 2H2- 4e-+4OH-=4H2O 练习2、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2mol电子,锌的质量理论上减小6?5gC 练习3、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
________________________
此时电池内总的反应式 :
________________________CH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O
负极(Zn):
Zn–2e- =Zn2+
正极(MnO2和C):
2NH4++2e- =2NH3+H2↑
H2+2MnO2=Mn2O3+H2O
电池总反应:
Zn+ 2NH4++ 2MnO2
=Zn2++2NH3+Mn2O3+H2O工作原理碱性锌锰电池构造示意图(-) Zn│KOH│MnO2 (+)
负极(Zn):
Zn + 2OH- - 2e- = Zn(OH)2
正极(MnO2):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2H2O
=2MnOOH+Zn(OH)2
优缺点简析:只能一次使用,不能充电;价格较贵;比能量和储存时间有所提高,适用于大电流和连续放电。一、一次电池——银锌电池(纽扣电池)(-) Zn│KOH│Ag2O (+)
负极(Zn):
Zn +2OH- -2e- =ZnO+H2O
正极(Ag2O):
Ag2O + H2O+ 2e- =2Ag+2OH-
电池总反应:
Zn + Ag2O = ZnO + 2Ag二、二次电池——铅蓄电池(-) Pb│H2SO4│PbO2 (+)
负极(Pb):
Pb-2e-+SO42-=PbSO4
正极(PbO2):
PbO2+2e-+4H++SO42-
=PbSO4+2H2O
电池总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
阅读P76,了解铅蓄电池的充电原理及铅蓄电池的优缺点。放电原理充电原理①放电过程
负极:氧化反应 Pb(s)+SO42-(aq)-2e-=PbSO4(s)
正极:还原反应
PbO2(s)+4H+(aq)+SO42-(aq)+2e-=2PbSO4 (s) +2H2O(l)
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
②充电过程
阴极(接电源负极):还原反应
PbSO4(s)+2e-=Pb(s)+SO42-(aq)
阳极(接电源正极):氧化反应
PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq)
充电过程总反应:
2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq) 缺点:比能量低、笨重、废弃电池污染环境
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池:镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……铅蓄电池的充放电过程:铅蓄电池的优缺点简析:三、燃料电池——氢氧燃料电池 (-) Pt│H2│H+│O2│Pt (+)
负极(Pt):2H2-4e-=4H+
正极(Pt):O2+4H++4e-=2H2O
电池总反应:2H2+O2=2H2O
(-) Pt│H2│OH-│O2│Pt (+)
负极(Pt):2H2-4e-+4OH-=4H2O
正极(Pt):O2+2H2O+4e-=4OH-
电池总反应:2H2+O2=2H2O工作原理 ①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……燃料电池的规律燃料电池与前几种电池的差别: ①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。化学电池的组成能导电的物质还原性较强的物质(多是金属电极本身)氧化性较强的物质酸溶液
碱溶液
盐溶液
或
熔融液小结流出电子流入电子氧化反应还原反应减 少 污 染
节 约 资 源书写电极反应式应注意以下几点:1.确定原电池的正负极,弄清正负极上发生反应的物质;
2.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
3.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;书写电极反应式应注意以下几点:4.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
5.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。再 见 练习1、航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2=2H2O,
酸式电池中电解质是酸,其负极反应可表示为2H2-4e-=4H+ ,则其正极反应式为:
_______________________。
碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应可表示为:______________________。O2+4e-+4H+=2H2O 2H2- 4e-+4OH-=4H2O 练习2、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2mol电子,锌的质量理论上减小6?5gC 练习3、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
________________________
此时电池内总的反应式 :
________________________CH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O
