高中化学 第一节 化学反应与能量的变化 中和热的测定课件 新人教版选修4
文档属性
| 名称 | 高中化学 第一节 化学反应与能量的变化 中和热的测定课件 新人教版选修4 |

|
|
| 格式 | rar | ||
| 文件大小 | 625.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-10 00:00:00 | ||
图片预览







文档简介
课件20张PPT。第一 章 化学反应与能量1、物质发生化学反应产生新物质的同时,伴随着能量的
变化
2、能量变化的主要原因是化学键的断裂与形成:
化学键断裂,吸收能量;化学键形成,放出能量; (微观)第一节 化学反应与能量的变化3、化学能与热能相互转化——吸热反应与放热反应
反应中吸热还是放热,决定于反应物的总能量与生成物
总能量的相对大小。(宏观) Q1>Q2,Q1E2,E1(1)所有燃烧反应
(2)中和反应
(3)大多数化合反应 (例外C+CO2=CO)
(4)活泼金属跟水或酸反应
(5)物质的缓慢氧化 常见的吸热反应:
(1)大多数分解反应(特殊爆炸反应为放热)
(2)晶体间的反应
(3)以C、H2、CO为还原剂的氧化还原反应。反应热 焓变 化学反应过程中所释放或吸收的能量,都可以用热量(或转换成相应的热量)来表述,叫做
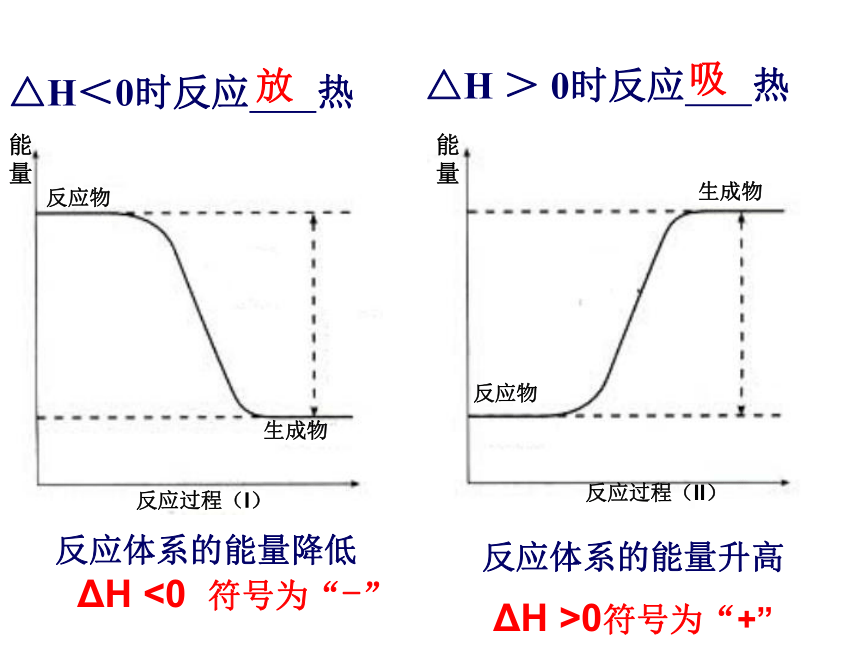
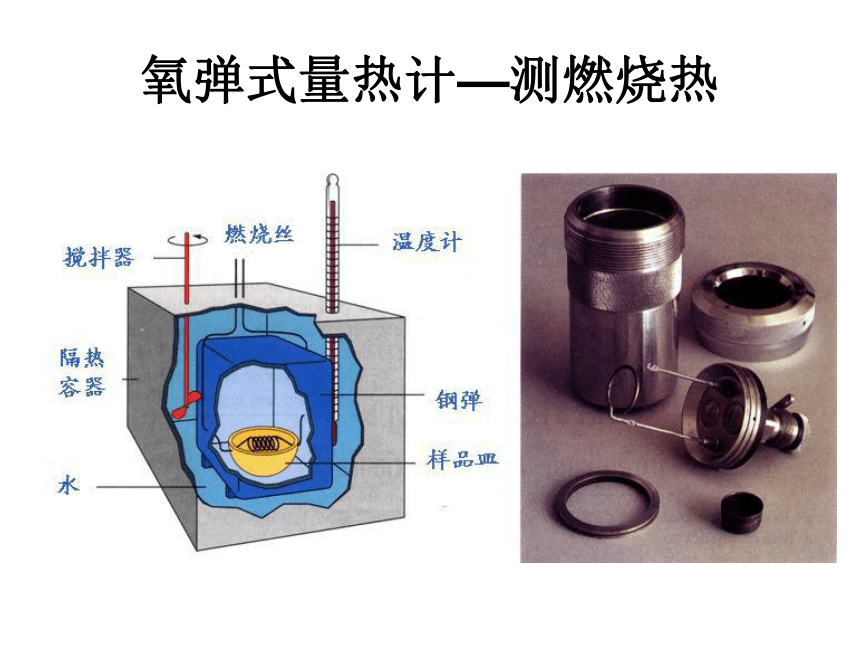
反应热,恒压条件下的反应热,又称为“焓变”。符号: ΔH ,单位:kJ/mol 或 kJ?mol-1△H<0时反应 热 放吸△H > 0时反应 热反应体系的能量降低 ΔH <0 符号为“-”反应体系的能量升高ΔH >0符号为“+”我们到底获得了多少热量? 请思考:一个测量热量的仪器,应该具有哪些功能和部件??它应该具有…1.保温功能:有盖子,隔热材料
2.温度测定功能:温度计
3.点燃功能:燃烧丝
4.搅拌功能:搅拌棒
它长什么样?氧弹式量热计—测燃烧热小小设计师 请利用实验室现有的仪器和物品,设计一个用以测定中和反应放热的量热计。1.科学探究:中和热的测定 昭苏县曙光中学 叶森
2010年9月30日我们的猜想: 测定强酸强碱反应中和热 ,化学反应的热效应。 需要的仪器和材料: 大烧杯(500ml)、小烧杯(100ml)、温度计、两支量筒(50ml)、泡沫塑料、泡沫塑料板、环形玻璃棒。 0.50mol/L盐酸、0.55mol/L氢氧化钠溶液。中和热 在稀溶液中,酸跟碱发生中和反应而生成1molH20(l),这时的反应热叫做中和热.
活动与探究 1、请大家观察量热计的构造,分析一下,量热器直接测定的数据是什么?是焓变的数值吗? 是体系(溶液)温度的变化2、根据体系温度变化可以求得什么物理量?可以求得反应吸收或放出的热量Q =m c ΔtQ:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。 3、请在下列的药品中选择一种你认为最合适的酸和碱。
50 mL 0.50 mol/LHCl溶液
50 mL 0.50 mol/LCH3COOH溶液
0.7mL 18mol/LH2SO4溶液
50 mL 0.50 mol/LNaOH溶液
50 mL 0.50 mol/LNH3溶液
强酸、强碱的稀溶液!活动与探究4、酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 Q =(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ②Q =m c Δt?已知 V酸=V碱=50 mL。 c酸= c碱=0.50 mol/L。
ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g·℃)
请把以上数据代入式②,得出Q的表示式。 Q = 0.418(t2-t1)kJ ③ 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度均为0.50 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)5、③式表示的是中和热吗?为什么?16.116.216.316.216.216.319.419.419.516.1516.216.33.253.23.2活动与探究为什么实际值和理论值存在较大的差异?为了使实际值和理论值更接近,你有什么好的改进方案?强酸、强碱反应:
H+(aq)+OH-(aq)=H2O(l); △H= - 57.3kJ/moL差别=-(57.3-53.8)kj/mol=-3.5 kj/mol①作为量热器的仪器装置,要尽量减少热量散失。②盐酸和氢氧化钠溶液浓度的配制必须准确。③盐酸和氢氧化钠溶液的体积必须量取准确。④温度计的读数要准确。⑤实验操作要快。问题探究4、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验变 小变 小变 小不 变谢谢
变化
2、能量变化的主要原因是化学键的断裂与形成:
化学键断裂,吸收能量;化学键形成,放出能量; (微观)第一节 化学反应与能量的变化3、化学能与热能相互转化——吸热反应与放热反应
反应中吸热还是放热,决定于反应物的总能量与生成物
总能量的相对大小。(宏观) Q1>Q2,Q1
(2)中和反应
(3)大多数化合反应 (例外C+CO2=CO)
(4)活泼金属跟水或酸反应
(5)物质的缓慢氧化 常见的吸热反应:
(1)大多数分解反应(特殊爆炸反应为放热)
(2)晶体间的反应
(3)以C、H2、CO为还原剂的氧化还原反应。反应热 焓变 化学反应过程中所释放或吸收的能量,都可以用热量(或转换成相应的热量)来表述,叫做
反应热,恒压条件下的反应热,又称为“焓变”。符号: ΔH ,单位:kJ/mol 或 kJ?mol-1△H<0时反应 热 放吸△H > 0时反应 热反应体系的能量降低 ΔH <0 符号为“-”反应体系的能量升高ΔH >0符号为“+”我们到底获得了多少热量? 请思考:一个测量热量的仪器,应该具有哪些功能和部件??它应该具有…1.保温功能:有盖子,隔热材料
2.温度测定功能:温度计
3.点燃功能:燃烧丝
4.搅拌功能:搅拌棒
它长什么样?氧弹式量热计—测燃烧热小小设计师 请利用实验室现有的仪器和物品,设计一个用以测定中和反应放热的量热计。1.科学探究:中和热的测定 昭苏县曙光中学 叶森
2010年9月30日我们的猜想: 测定强酸强碱反应中和热 ,化学反应的热效应。 需要的仪器和材料: 大烧杯(500ml)、小烧杯(100ml)、温度计、两支量筒(50ml)、泡沫塑料、泡沫塑料板、环形玻璃棒。 0.50mol/L盐酸、0.55mol/L氢氧化钠溶液。中和热 在稀溶液中,酸跟碱发生中和反应而生成1molH20(l),这时的反应热叫做中和热.
活动与探究 1、请大家观察量热计的构造,分析一下,量热器直接测定的数据是什么?是焓变的数值吗? 是体系(溶液)温度的变化2、根据体系温度变化可以求得什么物理量?可以求得反应吸收或放出的热量Q =m c ΔtQ:中和反应放出的热量。
m:反应混合液的质量。
c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。 3、请在下列的药品中选择一种你认为最合适的酸和碱。
50 mL 0.50 mol/LHCl溶液
50 mL 0.50 mol/LCH3COOH溶液
0.7mL 18mol/LH2SO4溶液
50 mL 0.50 mol/LNaOH溶液
50 mL 0.50 mol/LNH3溶液
强酸、强碱的稀溶液!活动与探究4、酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 Q =(V酸ρ酸+V碱ρ碱)·c·(t2-t1) ②Q =m c Δt?已知 V酸=V碱=50 mL。 c酸= c碱=0.50 mol/L。
ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g·℃)
请把以上数据代入式②,得出Q的表示式。 Q = 0.418(t2-t1)kJ ③ 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度均为0.50 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)5、③式表示的是中和热吗?为什么?16.116.216.316.216.216.319.419.419.516.1516.216.33.253.23.2活动与探究为什么实际值和理论值存在较大的差异?为了使实际值和理论值更接近,你有什么好的改进方案?强酸、强碱反应:
H+(aq)+OH-(aq)=H2O(l); △H= - 57.3kJ/moL差别=-(57.3-53.8)kj/mol=-3.5 kj/mol①作为量热器的仪器装置,要尽量减少热量散失。②盐酸和氢氧化钠溶液浓度的配制必须准确。③盐酸和氢氧化钠溶液的体积必须量取准确。④温度计的读数要准确。⑤实验操作要快。问题探究4、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验变 小变 小变 小不 变谢谢
