高中化学 专题三第四单元 沉淀溶解平衡课件 苏教版选修4
文档属性
| 名称 | 高中化学 专题三第四单元 沉淀溶解平衡课件 苏教版选修4 |

|
|
| 格式 | rar | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-10 00:00:00 | ||
图片预览










文档简介
课件55张PPT。沉淀溶解平衡第四单元湖南张家界溶洞 吉林省吉林市官马溶洞 山东淄博博山溶洞 陕西商洛地区柞水县柞水溶洞 溶解度回顾与整理 在一定温度下, 某固态物质在100g溶剂达到饱和状态时所溶解的溶质质量,通常以符号 S 表示。
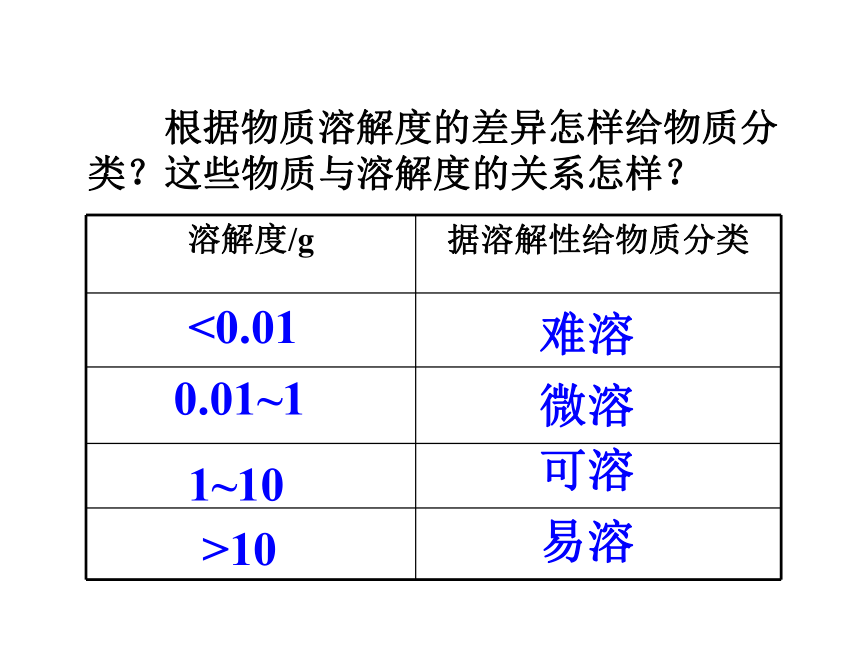
如果不指明溶剂,通常所说的溶解度是指在水里溶解度。 根据物质溶解度的差异怎样给物质分类?这些物质与溶解度的关系怎样?<0.010.01~1易溶>101~10难溶微溶可溶2.请按如下步骤进行实验。
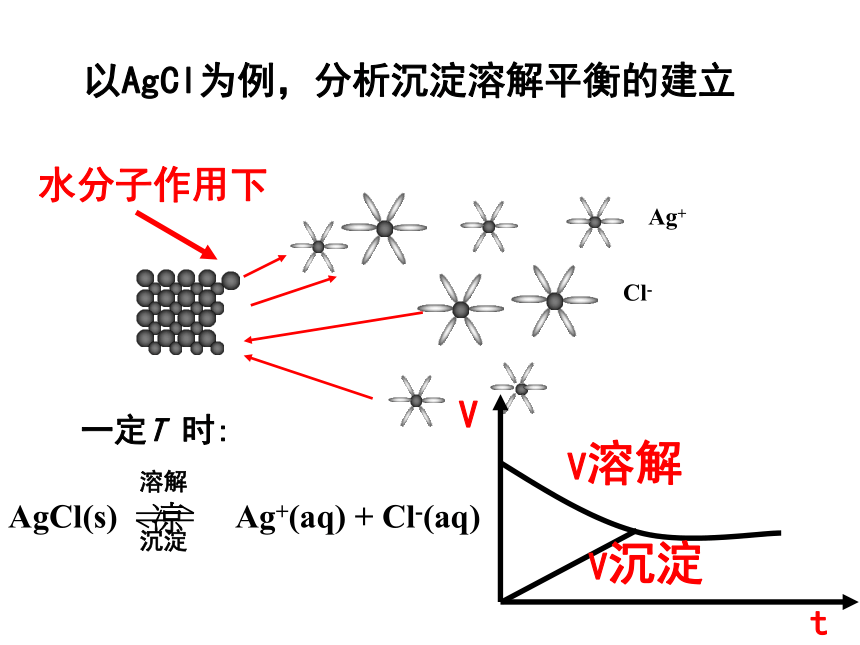
(1) 将少量 PbI2 (难溶于水)固体加入盛有一定量水的 50 mL 烧杯中,用玻璃棒充分搅拌,静置一段时间。 (2)取上层清液2 mL,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。现象:溶液中出现黄色浑浊现象。结论:说明澄清溶液里存在I-离子,即说明碘化铅在水中有少量的溶解。1.氯化银、硫酸钡属于难溶物,它们在水中是否完全不能溶解? 溶解
AgCl(s) ? Ag+(aq) + Cl-(aq)
沉淀 以AgCl为例,分析沉淀溶解平衡的建立一定T 时:水分子作用下沉淀溶解平衡的概念我们知道,沉淀在水中的溶解过程实际上是一个可逆过程,即存在沉淀和溶解两个互为可逆的过程。因此,在一定条件下会建立化学平衡。请你尝试给沉淀溶解平衡下定义。 由于沉淀溶解平衡属于化学平衡,所以也可以用研究化学平衡的方法来研究沉淀溶解平衡。 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成了电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡.1.定义:一、沉淀溶解平衡表示方法: 意义:不表示 电离平衡
表示:一方面:少量的Ag+ 和Cl-脱离AgCl表面进入水中,另一方面:溶液中的Ag+和Cl-受AgCl表面的阴、阳离子的吸引回到AgCl的表面3.影响因素内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:绝大多数难溶盐的溶解是吸热过程。③同离子效应:④其他2.特征逆、动、等、定、变不移动 不变不变不变不变正反应正反应正反应正反应逆反应逆反应增大增大增大增大增大增大减小减小减小减小练 习请运用化学平衡的特征分析下列说法是否正确。
(1)当沉淀溶解达到最大程度时,沉淀溶解过程及离子结合成沉淀的过程均会停止。( )
(2)当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化。( )
(3)对于平衡AgCl(s) Ag +(aq) + Cl-(aq)
来说,其平衡常数可用:K =c(Ag+) ·c(Cl-)表示( )二、溶度积常数(简称溶度积)1、定义 在一定条件下,难溶性电解质形成饱和溶液,达到溶解平衡,其溶解平衡常数叫做溶度积常数或简称溶度积.例:写出下列难溶电解质的溶解平衡关系式和溶度积表达式。Ksp = c(Ag+) . c(Br-)Ksp = c(Fe3+) . c3(OH-)3、意义: Ksp的大小反映了物质在水中的溶解
能力。Ksp越大,其溶解能力越强。 4、特点: 和其他平衡常数一样,Ksp 与温度有关,一定温度下,Ksp是常数。 完成难溶物CaCO3、Ag2CrO4、
Mg(OH)2在水中的沉淀溶解平衡的关系式和溶度积。 阅读课本 P82 表 3-14通过对比不同难溶电解质的溶度积与溶解度数值,你能得出什么结论?溶度积的应用 例1. 已知室温下PbI2的溶度积为7.1×10-9,求饱和溶液中Pb2+和I-的浓度;在c(I-)=0.1mol·L-1的溶液中, Pb2+的浓度最大可达到多少?Ksp =c (Pb2+) · c2(I-)(1)已知溶度积求离子浓度:解:c (Pb2+) = Ksp/c2(I-) =7.1×10-9/0.12
=7.1×10-7mol·L-1即:该溶液里允许Pb2+的最大浓度为7.1×10-7mol·L-1例2. 已知 298K 时AgCl 的 Ksp = 1.8×10-10,
求其溶解度S(2)已知溶度积求溶解度:解:Ksp = c(Ag+) . c(Cl-)设AgCl的溶解度为S,在1L饱和溶液中,
c(Ag +) = X,c(Cl-) = X Ksp[AgCl]= c(Ag +) ·c(Cl-)= X 2 = 1.8×10-10c[AgCl]= c(Ag + ) =1.34×10-4mol·L-1S [AgCl]= 1.34×10-4mol·L-1 ×1L×143.5g·mol-1
×100g÷1000g = 1.9×10-4g例3. 已知AgCl 298 K 时在水中溶解度为
1.92×10-4g,计算其Ksp。解:M(AgCl) = 143.5 g · mol-1
n(AgCl)=1.92×10-4g×1000g÷100g÷143.5 g · mol-1
= 1.34 ×10-5 mol
c(AgCl)= 1.34 ×10-5 mol/1L= 1.34 ×10-5 mol·L-1
Ksp=c(Ag+) ·c(Cl-) = (1.34 ×10-5 )2 = 1.8×10-10(3)已知溶解度求溶度积例4. 已知298K时, MgCO3的 Ksp = 6.82×10-6,溶液中c(Mg2+)=0.0001mol·L-1,c(CO32-) = 0.0001mol·L-1,此时Mg2+和CO32-能否共存?(4)利用溶度积判断离子共存:解:c(Mg2+) . c(CO32-) = (0.0001)2 =1×10-81×10-8 < 6.82×10-6所以,此时Mg2+和CO32-能共存沉淀溶解平衡的应用沉淀的生成问题1:
钡离子是有毒的重金属离子,如果误食可溶性钡盐,应采取什么措施?
可以用碳酸钠或硫酸钠洗胃吗?
应想办法使钡离子沉淀生成的沉淀既不溶于水也不溶于酸,因此,应选用硫酸钠将钡离子沉淀。一、沉淀的生成2.欲使某物质沉淀析出的条件:离子积> Kspa 、加沉淀剂:如沉淀Ba2+ 、Cu2+、Hg2+等,以Na2SO4、 Na2S 、H2S做沉淀剂Cu2++S2- =CuS↓ Hg2++S2-=HgS↓Ba2++SO42- =BaSO4↓ 3.方法 1.意义:在物质的检验、提纯及工厂废水的处
理等方面有重要意义。工业废水的处理工业废水硫化物等重金属离子(如Cu2+、Hg2+等)转化成沉淀b、调PH值例1:工业原料氯化铵中混有氯化铁,加氨水调pH至3--4Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+例2.如何除去酸性硫酸铜溶液中的Fe3+ c、同离子效应法例:硫酸钡在硫酸中的溶解度比在纯水中小。硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。d、氧化还原法糖吃多了易患龋齿,请大家完成
教科书P83页交流与讨论。问题1: 龋齿和含氟牙膏(1)钙、磷在骨骼牙齿中的存在形式Ca5(PO4)3OH羟基磷灰石(2)存在的溶解平衡(3)吃糖为何会出现龋齿?沉淀溶解平衡理论(4)含氟牙膏的使用使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固注:氟过量会导致氟斑牙,因此,生活在水中含氟量
较高的地区的人,不宜使用含氟牙膏提示:糖在酶的作用下产生了一种有机弱酸二、沉淀的转化1.实质是沉淀溶解平衡的移动 ①一般溶解能力相对较强的物质易转化为溶解能力相对较弱的物质,即Ksp大的沉淀可以向Ksp小的沉淀转化。 ②.两种同类难溶强电解质的Ksp相差不大时,通过控制离子浓度,Ksp小的沉淀也可以向Ksp大的沉淀转化。2.沉淀转化的类型总之,沉淀──溶解平衡是暂时的、有条件的,只要改变条件,沉淀和溶解这对矛盾可以相互转化。③将难溶物转化为能够易于处理的沉淀。适用于不易被酸或碱所溶解、不易形成离子、也无明显氧化性、还原性的难溶盐。实验一:取一支试管,向盛有2mL 0.1mol/LNaCl溶液的试管中加入几的AgNO3 (0.1mol/L)溶液,观察现象并记录。实验二:将所得悬浊液分成两份,向其中一份悬浊液中滴加KI溶液对比,观察滴加KI溶液前后沉淀颜色的变化并纪录。实验三:向实验2的试管中滴加硫化钠溶液。 有人认为,盐与盐在溶液中发生复分解反应的条件之一是两种盐均为可溶性盐,请你利用下面的实验验证这一结论是否正确,并利用沉淀溶解平衡的相关知识和所提供的信息对实验现象进行解释。P84产生白色沉淀Ag++Cl-= AgCl↓沉淀由白色转化为浅黄色沉淀由浅黄色转化为黑色结论:实验告诉我们不同的沉淀之间在一定的条件下
是可以相互转化的!沉淀转化的实质:沉淀溶解平衡的移动 沉淀转化的条件:
一般而言,难溶电解质转化成更加难溶的物质 说明硫化银的溶解度小于碘化银,碘化银的溶解度小于氯化银Na2S == S2- + 2Na+ Ksp差值越大,沉淀转化越彻底。即生成的沉淀Ksp越小,转化越彻底。沉淀转化方向:AgCl → AgI → Ag2SKI == I- + K+4.沉淀的转化应用:
a.氟化物防治龋齿
b.工业处理重晶石
c.锅炉中水垢的除去在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐然后用酸溶解,使阳离子进入溶液。例如重晶石是制备钡的重要原料,但BaSO4不溶于酸,用饱和碳酸钠溶液处理即可转化为易溶于酸的碳酸钡。请你分析其原理。Na2CO3 == CO32- + 2Na+总反应离子方程式:问题2:BaSO4 、BaCO3Ba2+BaSO4……BaCO3问题3:锅炉的水垢中除了CaCO3和Mg(OH)2外,还有CaSO4使得水垢结实,用酸很难快速除去,要快速除去水垢,可以用饱和Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而快速除去。三、分步沉淀几种离子………分步沉淀如何除去混在NaCl溶液中的铜离子?
如何除去硫酸铜溶液中的铁离子?提示:虽然加碱,两种离子均会沉淀,但溶解度小的会优先沉淀。根据溶解度的差异考虑沉淀的先后顺序。可以通过控制pH的方法,使铁离子转化为氢氧化铁沉淀,而将铜离子保留下来。例1:已知AgI的Ksp=8.5×10-17,AgCl的Ksp=1.8×10-10.在含有0.01mol/LNaI和0.01mol/LNaCl的溶液中,逐滴加入AgNO3溶液,先析出什么沉淀?例2.如何除去酸性氯化镁溶液中的Cu2+ 、Fe3+ 、 Fe2+ ,且分别得到Cu(OH)2 、Fe(OH)3。1.沉淀的溶解实质 是设法不断移去溶解平衡体系中的 相应离子,使平衡向沉淀溶解的方向移动例:CaCO3易溶于H2CO3,易溶于HCla.酸(碱)溶解法四、沉淀的溶解例:Al(OH)3既溶于HCl,又溶于NaOHb.难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液2.欲使某物质溶解,必要条件:各离子浓度乘积<Ksp3.方法2HCO3-溶洞的形成:c、其它沉淀溶解的方法利用氧化还原反应使沉淀溶解CuS、HgS等不能溶于非氧化性的强酸,如盐酸,只能溶于氧化性的强酸,如硝酸,甚至是王水,其间发生了氧化还原反应生成配位化合物使沉淀溶解银氨溶液的制取就是典型的例子。利用生成稳定的可溶配位化合物[Ag(NH3)]2OH来溶解沉淀AgOH总 结沉淀的生成
沉淀的转化
分步沉淀
沉淀的溶解例1. 将4×10-3mol·L-1的AgNO3溶液与4×10-3mol·L-1的NaCl溶液等体积混合能否有沉淀析出?[Ksp(AgCl)= 1.8×10-10]解:c(Ag+)=2 ×10-3mol·L-1
c(Cl-)= 2 ×10-3
c(Ag+) · c(Cl-)= 2 ×10-3× 2 ×10-3
=4.0 ×10-6 > Ksp=1.8×10-10所以有AgCl沉淀析出。例2.取5ml 0.002mol·L-1 BaCl2与等体积的 0.02mol·L-1 Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?BaSO4的 Ksp=1.1×10-10)解: SO42- + Ba2+ == BaSO4↓Ksp ≈ 0.009×c(Ba2+) = 1.1×10-10
c(Ba2+) = 1.2×10-8(mol·L-1) < 10-5 mol·L-1
所以Ba2+已沉淀完全。SO42-过量0.009mol·L-1例3.在1mol·L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在什么范 围才能除去Fe3+ ?
[使c(Fe3+) ≤ 10-5mol·L-1]解: Fe(OH)3的 Ksp = 2.6×10-39 ,
Cu(OH)2 的Ksp= 5.6×10-20 pH = 2.8
pH > 2.8pH = 4.4
控制 pH:2.8 ~ 4.4 教科书P83页除去硫酸铜溶液中混有的少量铁离子的流程图加入什么试剂最好呢?CuO、Cu(OH)2或Cu2(OH)2CO31.过量AgCl溶解在下列各种物质中,问哪种溶液中c(Ag+)最小 ( )
A. 100mL水
B. 1000mL水
C. 100mL0.2mol·L-1KCl溶液
D. 1000mL0.5mol·L-1KNO3溶液
C练 习2. 将5mL 1×10-5mol·L-1的AgNO3溶液和15mL 4×10-5mol·L-1的K2CrO4溶液混合时,有无砖红色Ag2CrO4沉淀生成?(已知该温度下Ag2CrO4的 Ksp = 9 ×10-12)练 习
如果不指明溶剂,通常所说的溶解度是指在水里溶解度。 根据物质溶解度的差异怎样给物质分类?这些物质与溶解度的关系怎样?<0.010.01~1易溶>101~10难溶微溶可溶2.请按如下步骤进行实验。
(1) 将少量 PbI2 (难溶于水)固体加入盛有一定量水的 50 mL 烧杯中,用玻璃棒充分搅拌,静置一段时间。 (2)取上层清液2 mL,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。现象:溶液中出现黄色浑浊现象。结论:说明澄清溶液里存在I-离子,即说明碘化铅在水中有少量的溶解。1.氯化银、硫酸钡属于难溶物,它们在水中是否完全不能溶解? 溶解
AgCl(s) ? Ag+(aq) + Cl-(aq)
沉淀 以AgCl为例,分析沉淀溶解平衡的建立一定T 时:水分子作用下沉淀溶解平衡的概念我们知道,沉淀在水中的溶解过程实际上是一个可逆过程,即存在沉淀和溶解两个互为可逆的过程。因此,在一定条件下会建立化学平衡。请你尝试给沉淀溶解平衡下定义。 由于沉淀溶解平衡属于化学平衡,所以也可以用研究化学平衡的方法来研究沉淀溶解平衡。 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成了电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡.1.定义:一、沉淀溶解平衡表示方法: 意义:不表示 电离平衡
表示:一方面:少量的Ag+ 和Cl-脱离AgCl表面进入水中,另一方面:溶液中的Ag+和Cl-受AgCl表面的阴、阳离子的吸引回到AgCl的表面3.影响因素内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:绝大多数难溶盐的溶解是吸热过程。③同离子效应:④其他2.特征逆、动、等、定、变不移动 不变不变不变不变正反应正反应正反应正反应逆反应逆反应增大增大增大增大增大增大减小减小减小减小练 习请运用化学平衡的特征分析下列说法是否正确。
(1)当沉淀溶解达到最大程度时,沉淀溶解过程及离子结合成沉淀的过程均会停止。( )
(2)当沉淀溶解平衡建立时,溶液中离子的浓度不再发生变化。( )
(3)对于平衡AgCl(s) Ag +(aq) + Cl-(aq)
来说,其平衡常数可用:K =c(Ag+) ·c(Cl-)表示( )二、溶度积常数(简称溶度积)1、定义 在一定条件下,难溶性电解质形成饱和溶液,达到溶解平衡,其溶解平衡常数叫做溶度积常数或简称溶度积.例:写出下列难溶电解质的溶解平衡关系式和溶度积表达式。Ksp = c(Ag+) . c(Br-)Ksp = c(Fe3+) . c3(OH-)3、意义: Ksp的大小反映了物质在水中的溶解
能力。Ksp越大,其溶解能力越强。 4、特点: 和其他平衡常数一样,Ksp 与温度有关,一定温度下,Ksp是常数。 完成难溶物CaCO3、Ag2CrO4、
Mg(OH)2在水中的沉淀溶解平衡的关系式和溶度积。 阅读课本 P82 表 3-14通过对比不同难溶电解质的溶度积与溶解度数值,你能得出什么结论?溶度积的应用 例1. 已知室温下PbI2的溶度积为7.1×10-9,求饱和溶液中Pb2+和I-的浓度;在c(I-)=0.1mol·L-1的溶液中, Pb2+的浓度最大可达到多少?Ksp =c (Pb2+) · c2(I-)(1)已知溶度积求离子浓度:解:c (Pb2+) = Ksp/c2(I-) =7.1×10-9/0.12
=7.1×10-7mol·L-1即:该溶液里允许Pb2+的最大浓度为7.1×10-7mol·L-1例2. 已知 298K 时AgCl 的 Ksp = 1.8×10-10,
求其溶解度S(2)已知溶度积求溶解度:解:Ksp = c(Ag+) . c(Cl-)设AgCl的溶解度为S,在1L饱和溶液中,
c(Ag +) = X,c(Cl-) = X Ksp[AgCl]= c(Ag +) ·c(Cl-)= X 2 = 1.8×10-10c[AgCl]= c(Ag + ) =1.34×10-4mol·L-1S [AgCl]= 1.34×10-4mol·L-1 ×1L×143.5g·mol-1
×100g÷1000g = 1.9×10-4g例3. 已知AgCl 298 K 时在水中溶解度为
1.92×10-4g,计算其Ksp。解:M(AgCl) = 143.5 g · mol-1
n(AgCl)=1.92×10-4g×1000g÷100g÷143.5 g · mol-1
= 1.34 ×10-5 mol
c(AgCl)= 1.34 ×10-5 mol/1L= 1.34 ×10-5 mol·L-1
Ksp=c(Ag+) ·c(Cl-) = (1.34 ×10-5 )2 = 1.8×10-10(3)已知溶解度求溶度积例4. 已知298K时, MgCO3的 Ksp = 6.82×10-6,溶液中c(Mg2+)=0.0001mol·L-1,c(CO32-) = 0.0001mol·L-1,此时Mg2+和CO32-能否共存?(4)利用溶度积判断离子共存:解:c(Mg2+) . c(CO32-) = (0.0001)2 =1×10-81×10-8 < 6.82×10-6所以,此时Mg2+和CO32-能共存沉淀溶解平衡的应用沉淀的生成问题1:
钡离子是有毒的重金属离子,如果误食可溶性钡盐,应采取什么措施?
可以用碳酸钠或硫酸钠洗胃吗?
应想办法使钡离子沉淀生成的沉淀既不溶于水也不溶于酸,因此,应选用硫酸钠将钡离子沉淀。一、沉淀的生成2.欲使某物质沉淀析出的条件:离子积> Kspa 、加沉淀剂:如沉淀Ba2+ 、Cu2+、Hg2+等,以Na2SO4、 Na2S 、H2S做沉淀剂Cu2++S2- =CuS↓ Hg2++S2-=HgS↓Ba2++SO42- =BaSO4↓ 3.方法 1.意义:在物质的检验、提纯及工厂废水的处
理等方面有重要意义。工业废水的处理工业废水硫化物等重金属离子(如Cu2+、Hg2+等)转化成沉淀b、调PH值例1:工业原料氯化铵中混有氯化铁,加氨水调pH至3--4Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+例2.如何除去酸性硫酸铜溶液中的Fe3+ c、同离子效应法例:硫酸钡在硫酸中的溶解度比在纯水中小。硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。d、氧化还原法糖吃多了易患龋齿,请大家完成
教科书P83页交流与讨论。问题1: 龋齿和含氟牙膏(1)钙、磷在骨骼牙齿中的存在形式Ca5(PO4)3OH羟基磷灰石(2)存在的溶解平衡(3)吃糖为何会出现龋齿?沉淀溶解平衡理论(4)含氟牙膏的使用使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固注:氟过量会导致氟斑牙,因此,生活在水中含氟量
较高的地区的人,不宜使用含氟牙膏提示:糖在酶的作用下产生了一种有机弱酸二、沉淀的转化1.实质是沉淀溶解平衡的移动 ①一般溶解能力相对较强的物质易转化为溶解能力相对较弱的物质,即Ksp大的沉淀可以向Ksp小的沉淀转化。 ②.两种同类难溶强电解质的Ksp相差不大时,通过控制离子浓度,Ksp小的沉淀也可以向Ksp大的沉淀转化。2.沉淀转化的类型总之,沉淀──溶解平衡是暂时的、有条件的,只要改变条件,沉淀和溶解这对矛盾可以相互转化。③将难溶物转化为能够易于处理的沉淀。适用于不易被酸或碱所溶解、不易形成离子、也无明显氧化性、还原性的难溶盐。实验一:取一支试管,向盛有2mL 0.1mol/LNaCl溶液的试管中加入几的AgNO3 (0.1mol/L)溶液,观察现象并记录。实验二:将所得悬浊液分成两份,向其中一份悬浊液中滴加KI溶液对比,观察滴加KI溶液前后沉淀颜色的变化并纪录。实验三:向实验2的试管中滴加硫化钠溶液。 有人认为,盐与盐在溶液中发生复分解反应的条件之一是两种盐均为可溶性盐,请你利用下面的实验验证这一结论是否正确,并利用沉淀溶解平衡的相关知识和所提供的信息对实验现象进行解释。P84产生白色沉淀Ag++Cl-= AgCl↓沉淀由白色转化为浅黄色沉淀由浅黄色转化为黑色结论:实验告诉我们不同的沉淀之间在一定的条件下
是可以相互转化的!沉淀转化的实质:沉淀溶解平衡的移动 沉淀转化的条件:
一般而言,难溶电解质转化成更加难溶的物质 说明硫化银的溶解度小于碘化银,碘化银的溶解度小于氯化银Na2S == S2- + 2Na+ Ksp差值越大,沉淀转化越彻底。即生成的沉淀Ksp越小,转化越彻底。沉淀转化方向:AgCl → AgI → Ag2SKI == I- + K+4.沉淀的转化应用:
a.氟化物防治龋齿
b.工业处理重晶石
c.锅炉中水垢的除去在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐然后用酸溶解,使阳离子进入溶液。例如重晶石是制备钡的重要原料,但BaSO4不溶于酸,用饱和碳酸钠溶液处理即可转化为易溶于酸的碳酸钡。请你分析其原理。Na2CO3 == CO32- + 2Na+总反应离子方程式:问题2:BaSO4 、BaCO3Ba2+BaSO4……BaCO3问题3:锅炉的水垢中除了CaCO3和Mg(OH)2外,还有CaSO4使得水垢结实,用酸很难快速除去,要快速除去水垢,可以用饱和Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而快速除去。三、分步沉淀几种离子………分步沉淀如何除去混在NaCl溶液中的铜离子?
如何除去硫酸铜溶液中的铁离子?提示:虽然加碱,两种离子均会沉淀,但溶解度小的会优先沉淀。根据溶解度的差异考虑沉淀的先后顺序。可以通过控制pH的方法,使铁离子转化为氢氧化铁沉淀,而将铜离子保留下来。例1:已知AgI的Ksp=8.5×10-17,AgCl的Ksp=1.8×10-10.在含有0.01mol/LNaI和0.01mol/LNaCl的溶液中,逐滴加入AgNO3溶液,先析出什么沉淀?例2.如何除去酸性氯化镁溶液中的Cu2+ 、Fe3+ 、 Fe2+ ,且分别得到Cu(OH)2 、Fe(OH)3。1.沉淀的溶解实质 是设法不断移去溶解平衡体系中的 相应离子,使平衡向沉淀溶解的方向移动例:CaCO3易溶于H2CO3,易溶于HCla.酸(碱)溶解法四、沉淀的溶解例:Al(OH)3既溶于HCl,又溶于NaOHb.难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液2.欲使某物质溶解,必要条件:各离子浓度乘积<Ksp3.方法2HCO3-溶洞的形成:c、其它沉淀溶解的方法利用氧化还原反应使沉淀溶解CuS、HgS等不能溶于非氧化性的强酸,如盐酸,只能溶于氧化性的强酸,如硝酸,甚至是王水,其间发生了氧化还原反应生成配位化合物使沉淀溶解银氨溶液的制取就是典型的例子。利用生成稳定的可溶配位化合物[Ag(NH3)]2OH来溶解沉淀AgOH总 结沉淀的生成
沉淀的转化
分步沉淀
沉淀的溶解例1. 将4×10-3mol·L-1的AgNO3溶液与4×10-3mol·L-1的NaCl溶液等体积混合能否有沉淀析出?[Ksp(AgCl)= 1.8×10-10]解:c(Ag+)=2 ×10-3mol·L-1
c(Cl-)= 2 ×10-3
c(Ag+) · c(Cl-)= 2 ×10-3× 2 ×10-3
=4.0 ×10-6 > Ksp=1.8×10-10所以有AgCl沉淀析出。例2.取5ml 0.002mol·L-1 BaCl2与等体积的 0.02mol·L-1 Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?BaSO4的 Ksp=1.1×10-10)解: SO42- + Ba2+ == BaSO4↓Ksp ≈ 0.009×c(Ba2+) = 1.1×10-10
c(Ba2+) = 1.2×10-8(mol·L-1) < 10-5 mol·L-1
所以Ba2+已沉淀完全。SO42-过量0.009mol·L-1例3.在1mol·L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在什么范 围才能除去Fe3+ ?
[使c(Fe3+) ≤ 10-5mol·L-1]解: Fe(OH)3的 Ksp = 2.6×10-39 ,
Cu(OH)2 的Ksp= 5.6×10-20 pH = 2.8
pH > 2.8pH = 4.4
控制 pH:2.8 ~ 4.4 教科书P83页除去硫酸铜溶液中混有的少量铁离子的流程图加入什么试剂最好呢?CuO、Cu(OH)2或Cu2(OH)2CO31.过量AgCl溶解在下列各种物质中,问哪种溶液中c(Ag+)最小 ( )
A. 100mL水
B. 1000mL水
C. 100mL0.2mol·L-1KCl溶液
D. 1000mL0.5mol·L-1KNO3溶液
C练 习2. 将5mL 1×10-5mol·L-1的AgNO3溶液和15mL 4×10-5mol·L-1的K2CrO4溶液混合时,有无砖红色Ag2CrO4沉淀生成?(已知该温度下Ag2CrO4的 Ksp = 9 ×10-12)练 习
