物质的量应用于化学方程式的计算
文档属性
| 名称 | 物质的量应用于化学方程式的计算 |  | |
| 格式 | rar | ||
| 文件大小 | 121.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-10 17:29:00 | ||
图片预览





文档简介
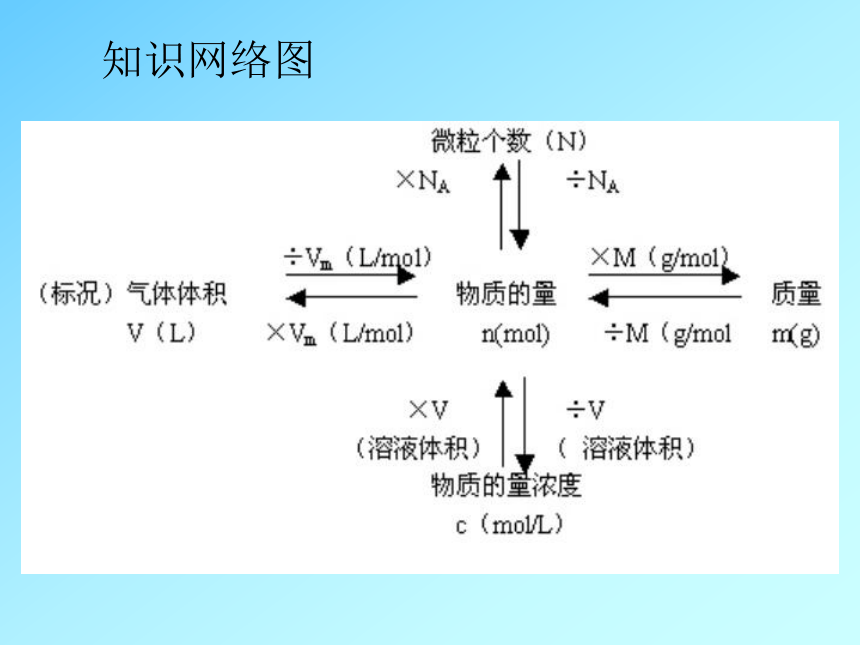
课件13张PPT。物质的量应用于化学方程式的计算知识网络图化学计量数γ之比 2 : 1 : 2
微粒个数之比 2 : 1 : 2
扩大倍数 2×6.02×1023 : 1×6.02×1023 : 2×6.02×1023 物质的量之比 2mol : 1mol : 2mol
结论:化学方程式中各物质的化学计量数之比,等于组成各物质
的粒子数之比,因而也等于各物质的物质的量之比。
化学计量数γ之比 1 : 1 : 2 微粒个数之比 1 : 1 : 2 扩大倍数 1×6.02×1023 : 1×6.02×1023 : 2×6.02×1023 物质的量之比 1mol : 1mol : 2mol
相同条件下
气体体积比 1体积 : 1体积 : 2体积
结论:对于气体物质,因为相同条件下分子数相等,物质的量相
等、物质的体积也相等,所以化学反应中物质的系数之比等于相
同条件下气体的体积比,即1LH2和1LCl2完全反应生成2LHCl气体。例1:完全中和0.10molNaOH,需要硫酸的物质的量是多少?
所需硫酸的质量是多少?解:2NaOH +H2SO4 =Na2SO4 + 2H2O
2mol 1mol
0.10mol n(H2SO4)
硫酸的质量:练习1:氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二
氧化氯,其变化可表述为:
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号)
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2则转移电子的物质的量为 mol
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的
效率(以单位质量得到的电子数表示)是Cl2的 倍。
解析:(1)根据化合价升降配平方程式
未知物化学式可用观察法,由氢氧原子个数确定为H2O
(2)根据生成KCl知2molHCl显酸性,2molHCl被氧化,显还原性。
(3)产生1molCl2转移电子2mol,所以产生0.1molCl2时,转移电子
0.2mol
(4)每摩尔ClO2可得5mol电子,单位质量得电子数 ,而每摩
尔Cl2可得电子2mol,单位质量得 电子数,二者比值为2.63
例2:将30g二氧化锰的质量分数为76.6%的软锰矿石与足量
12mol/L浓盐酸完全反应(杂质不参加反应)。计算(1)参加
反应的浓盐酸的体积(2)生成的氯气的体积(标准状况)。
分析:根据题目中所给的已知条件,可先计算出参加反应的二氧
化锰的物质的量,然后根据化学反应中各物质之间的化学计量数
之比,计算出参加反应的浓盐酸的体积和生成的氯气的体积。例3:400mL某浓度的氢氧化钠溶液恰好与5.8L氯气
(标准状况)完全反应,计算(1)生成的NaClO的物质
的量;(2)该溶液中NaOH的物质的量浓度。练习1:23g金属钠与水反应后等到500mL溶液,求该溶液中溶质
物质的量浓度和反应时生成氢气的体积(标准状况下)?答案:该溶液物质的量浓度为2mol/L,生成的氢气在标况下体积
为11.2L。练习2:在一定条件下,与足量的固体完全反应后,产生的气体
全部收集起来只有1.68L(标准状况),则此气体在标准状况下
的密度为( )
A. 1.43g/L B.1.90g/L
C. 2.14g/L D.2.38g/L
答案:B*练习3:在托盘天平的两盘,放上质量相等的A、B两烧杯,调至
平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放
入下述各组物质,结果天平仍保持平衡的是( )
A.0.5mol Na和0.5mol Mg
B.0.1mol Zn和0.1mol Al
C. 和
D. 和答案:A、C1.计算的基本步骤
(1)写出化学方程式。
(2)写出已知、未知量
(3)列出比例式求解x。
(4)写出答案。
2.弄清应注意的问题
(1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。
如果是氧化还原反应,也可以利用电子转移关系进行有关计算。小结
微粒个数之比 2 : 1 : 2
扩大倍数 2×6.02×1023 : 1×6.02×1023 : 2×6.02×1023 物质的量之比 2mol : 1mol : 2mol
结论:化学方程式中各物质的化学计量数之比,等于组成各物质
的粒子数之比,因而也等于各物质的物质的量之比。
化学计量数γ之比 1 : 1 : 2 微粒个数之比 1 : 1 : 2 扩大倍数 1×6.02×1023 : 1×6.02×1023 : 2×6.02×1023 物质的量之比 1mol : 1mol : 2mol
相同条件下
气体体积比 1体积 : 1体积 : 2体积
结论:对于气体物质,因为相同条件下分子数相等,物质的量相
等、物质的体积也相等,所以化学反应中物质的系数之比等于相
同条件下气体的体积比,即1LH2和1LCl2完全反应生成2LHCl气体。例1:完全中和0.10molNaOH,需要硫酸的物质的量是多少?
所需硫酸的质量是多少?解:2NaOH +H2SO4 =Na2SO4 + 2H2O
2mol 1mol
0.10mol n(H2SO4)
硫酸的质量:练习1:氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二
氧化氯,其变化可表述为:
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号)
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2则转移电子的物质的量为 mol
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的
效率(以单位质量得到的电子数表示)是Cl2的 倍。
解析:(1)根据化合价升降配平方程式
未知物化学式可用观察法,由氢氧原子个数确定为H2O
(2)根据生成KCl知2molHCl显酸性,2molHCl被氧化,显还原性。
(3)产生1molCl2转移电子2mol,所以产生0.1molCl2时,转移电子
0.2mol
(4)每摩尔ClO2可得5mol电子,单位质量得电子数 ,而每摩
尔Cl2可得电子2mol,单位质量得 电子数,二者比值为2.63
例2:将30g二氧化锰的质量分数为76.6%的软锰矿石与足量
12mol/L浓盐酸完全反应(杂质不参加反应)。计算(1)参加
反应的浓盐酸的体积(2)生成的氯气的体积(标准状况)。
分析:根据题目中所给的已知条件,可先计算出参加反应的二氧
化锰的物质的量,然后根据化学反应中各物质之间的化学计量数
之比,计算出参加反应的浓盐酸的体积和生成的氯气的体积。例3:400mL某浓度的氢氧化钠溶液恰好与5.8L氯气
(标准状况)完全反应,计算(1)生成的NaClO的物质
的量;(2)该溶液中NaOH的物质的量浓度。练习1:23g金属钠与水反应后等到500mL溶液,求该溶液中溶质
物质的量浓度和反应时生成氢气的体积(标准状况下)?答案:该溶液物质的量浓度为2mol/L,生成的氢气在标况下体积
为11.2L。练习2:在一定条件下,与足量的固体完全反应后,产生的气体
全部收集起来只有1.68L(标准状况),则此气体在标准状况下
的密度为( )
A. 1.43g/L B.1.90g/L
C. 2.14g/L D.2.38g/L
答案:B*练习3:在托盘天平的两盘,放上质量相等的A、B两烧杯,调至
平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放
入下述各组物质,结果天平仍保持平衡的是( )
A.0.5mol Na和0.5mol Mg
B.0.1mol Zn和0.1mol Al
C. 和
D. 和答案:A、C1.计算的基本步骤
(1)写出化学方程式。
(2)写出已知、未知量
(3)列出比例式求解x。
(4)写出答案。
2.弄清应注意的问题
(1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。
如果是氧化还原反应,也可以利用电子转移关系进行有关计算。小结
