胶体复习
图片预览








文档简介
课件22张PPT。胶体的性质及其应用
复 习FZH 2006.12.26本章复习的主要内容一、分散系二、胶体三、胶体的制法四、胶体的性质五、应用六、分散系的分离七、“先沉淀后溶解”实验现象小结一、分散系:由一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物。
1、组成:
分散质:分散系中分散成微粒的物质。
分散剂:分散系中微粒分散在其中的物质。2、分类:知识小结 二、胶体:1、胶体知识不是研究某种物质所特有的性质,而是物质的聚集状态表现的性质。是以分散质粒子大小为本质特征的.2、概念:
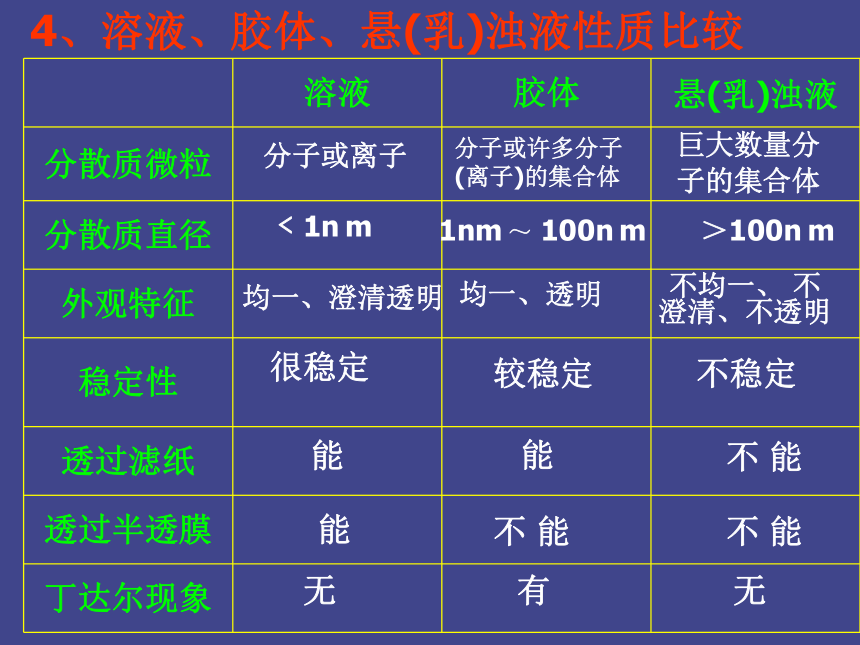
分散质粒子的直径在1 — 100nm之间的分散系3、分类:知识小结分子或离子分子或许多分子(离子)的集合体巨大数量分子的集合体 ﹤1n m1nm ~ 100n m >100n m均一、澄清透明均一、透明不均一、 不澄清、不透明很稳定较稳定不稳定能能能不 能不 能不 能无有无4、溶液、胶体、悬(乳)浊液性质比较 1、将淀粉-KI混合液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取杯中液体进行实验,能证明半透膜有破损的是 ( )
A.加入碘水变蓝色
B.加入碘水不变蓝色
C.加入AgNO3溶液产生黄色沉淀
D.加入氯水变蓝色AD反馈练习2、NaCl溶于水形成溶液,如果NaCl分散在酒精中,可形成_________.
胶体1、(2000年全国高考题)下列关于胶体的叙述不正确的是 ( )
A.布朗运动是胶体微粒特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象课前练习A2、(1997年全国高考题)将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是 ( )
A.硅酸溶胶 B. 2mol/LNaOH溶液
C.2mol/LH2SO4溶液 D. 2mol/LMgSO4溶液
【答案】C
【解析】 使Fe(OH)3溶胶凝聚的方法有①加热②加入带相反电荷胶粒的胶体溶液③加入电解质溶液。题中所给的四种物质均可以使Fe(OH)3溶胶凝聚。由于产生的Fe(OH)3沉淀又溶解,可推知所加的物质是酸。课前练习 (1)分散法(分散法):将较大的粒子粉碎成胶体粒子大小的方法,生产上使用较广的是研磨法。如:磨墨、制豆浆等
(2)溶解法:淀粉、蛋白质溶于水制得。
(3)凝聚法:是分子或离子聚集成较大的颗粒(胶体粒子大小)的方法,常用化学反应法(如水解法、复分解法).如:知识小结三、胶体的制法FeCl3+3H2O=Fe(OH)3(胶体)+3HClKI+AgNO3=AgI+KNO3Na2SiO3+2HCl=2NaCl+H2SiO3(胶体) 1、丁达尔现象
原因:胶体粒子较大(1~100nm),对光具有散射作用,光在胶体的通路中出现一条明亮的光带。
是区别胶体和溶液的方法之一
2、布朗运动
原因:胶体微粒受分散剂分子不停的、无规则的撞击,形成不停的、无秩序的运动。
是胶体稳定性的原因之一 , 此现象不是胶体独有的现象.知识小结四、胶体的性质 3、胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。也是胶体稳定性的主要原因4、胶体的凝聚
原因:当破坏胶体微粒原来带有的相同电荷时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:⑴加热 ⑵加电解质溶液
⑶加带相反电荷的胶体通电后胶粒向哪个方向移动,带电规律?(1)金属氢氧化物、金属氧化物的胶粒带正电荷;
(2)非金属氧化物、金属硫化物的胶粒、硅胶、土壤带负电荷。练习1.用半透膜把分子或离子从胶体溶液中分离出来的方法叫( )
A.电泳 B.电解
C.凝聚 D.渗析2.下列分离物质的方法中,根据粒子大小进行分离的是 ( )
A.蒸馏 B.重结晶
C.沉降 D.渗析DD3.能证明胶粒比溶液中溶质微粒直径大的实验是( )
A.电泳 B.丁达尔现象
C.布朗运动 D.渗析BD4.(2002年上海市高考题)将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是 ( )
A.冷水 B.沸水
C.NaOH溶液 D.NaCl浓溶液B五、应用:(1)江河入海口沙州的形成
(2)盐析
(3)AlCl3的净水作用
(4)制豆腐
(5)使用墨水5.不能用胶体的知识解释的现象是 A、牛油与NaOH 溶液共煮,向反应后所得溶液中加入食盐,会有固体析出 B、一支钢笔使用两种不同牌号蓝墨水,易出现堵塞 C、向氯化铁溶液中加入NaOH溶液,会出现红褐色沉淀 D、在河水与海水得交界处,有三角洲形成C分散系的分离方法,因分散质的大小或状态而定:
①悬浊液用过滤方法
②乳浊液用分液方法
③溶液可用蒸发结晶等方法。 ④胶体溶液用渗析方法
知识小结六、分散系的分离知识小结④ 、胶体的提纯--渗析。利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。其原理为:胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。提纯可以达到净化、精制胶体的目地[拓宽]滤纸可将胶体和沉淀分离1.胶体(酸/碱)溶液中加碱或酸
2.Ca(OH)2溶液中通CO2或SO2
3.Ca(ClO)2溶液中通CO2
4.Al3+加入OH-
5.AlO2-加入H+
6.Ca(OH)2溶液中加H3PO4
7.往Ag+溶液中加氨水
知识小结七、“先沉淀后溶解”实验现象小结1、已知土壤胶体粒子带负电,在土壤里施用含氮量相等的下列肥料,肥效较差的是 ( )
A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D.NH4Cl
2、下列事实与胶体知识有关的是 ( )
①用卤水点豆腐 ②明矾净水 ③河海交接处易沉积形成沙洲 ④配氯化铁溶液时加入少量盐酸
A.①②③ B.②③④
C.①③④ D.全部都是 C巩固练习A3.有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、Bi2S3胶体、NaOH溶液。现将有关实验现象记录如下:(1)电泳:甲液的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入丙液中,先出现凝聚,后液体变清,则
甲为 ,乙为 , 丙为 ,丁为 。Fe(OH)3NaOH溶液硅酸胶体Bi2S3胶体4、生活和生产中常用到胶体的性质,请看下述三例:
⑴做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是
。
⑵在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径为10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集 ,阴极聚集 ,理由是
。
⑶水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种作用运用了
原理。电解质氯化铁使血液中蛋白质胶体凝聚陶土胶粒氧化铁胶粒前者带负电荷向阳极移动,后者带正电荷,向阴极移动电泳请继续努力!再见!
复 习FZH 2006.12.26本章复习的主要内容一、分散系二、胶体三、胶体的制法四、胶体的性质五、应用六、分散系的分离七、“先沉淀后溶解”实验现象小结一、分散系:由一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物。
1、组成:
分散质:分散系中分散成微粒的物质。
分散剂:分散系中微粒分散在其中的物质。2、分类:知识小结 二、胶体:1、胶体知识不是研究某种物质所特有的性质,而是物质的聚集状态表现的性质。是以分散质粒子大小为本质特征的.2、概念:
分散质粒子的直径在1 — 100nm之间的分散系3、分类:知识小结分子或离子分子或许多分子(离子)的集合体巨大数量分子的集合体 ﹤1n m1nm ~ 100n m >100n m均一、澄清透明均一、透明不均一、 不澄清、不透明很稳定较稳定不稳定能能能不 能不 能不 能无有无4、溶液、胶体、悬(乳)浊液性质比较 1、将淀粉-KI混合液装在半透膜袋中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取杯中液体进行实验,能证明半透膜有破损的是 ( )
A.加入碘水变蓝色
B.加入碘水不变蓝色
C.加入AgNO3溶液产生黄色沉淀
D.加入氯水变蓝色AD反馈练习2、NaCl溶于水形成溶液,如果NaCl分散在酒精中,可形成_________.
胶体1、(2000年全国高考题)下列关于胶体的叙述不正确的是 ( )
A.布朗运动是胶体微粒特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象课前练习A2、(1997年全国高考题)将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是 ( )
A.硅酸溶胶 B. 2mol/LNaOH溶液
C.2mol/LH2SO4溶液 D. 2mol/LMgSO4溶液
【答案】C
【解析】 使Fe(OH)3溶胶凝聚的方法有①加热②加入带相反电荷胶粒的胶体溶液③加入电解质溶液。题中所给的四种物质均可以使Fe(OH)3溶胶凝聚。由于产生的Fe(OH)3沉淀又溶解,可推知所加的物质是酸。课前练习 (1)分散法(分散法):将较大的粒子粉碎成胶体粒子大小的方法,生产上使用较广的是研磨法。如:磨墨、制豆浆等
(2)溶解法:淀粉、蛋白质溶于水制得。
(3)凝聚法:是分子或离子聚集成较大的颗粒(胶体粒子大小)的方法,常用化学反应法(如水解法、复分解法).如:知识小结三、胶体的制法FeCl3+3H2O=Fe(OH)3(胶体)+3HClKI+AgNO3=AgI+KNO3Na2SiO3+2HCl=2NaCl+H2SiO3(胶体) 1、丁达尔现象
原因:胶体粒子较大(1~100nm),对光具有散射作用,光在胶体的通路中出现一条明亮的光带。
是区别胶体和溶液的方法之一
2、布朗运动
原因:胶体微粒受分散剂分子不停的、无规则的撞击,形成不停的、无秩序的运动。
是胶体稳定性的原因之一 , 此现象不是胶体独有的现象.知识小结四、胶体的性质 3、胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。也是胶体稳定性的主要原因4、胶体的凝聚
原因:当破坏胶体微粒原来带有的相同电荷时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:⑴加热 ⑵加电解质溶液
⑶加带相反电荷的胶体通电后胶粒向哪个方向移动,带电规律?(1)金属氢氧化物、金属氧化物的胶粒带正电荷;
(2)非金属氧化物、金属硫化物的胶粒、硅胶、土壤带负电荷。练习1.用半透膜把分子或离子从胶体溶液中分离出来的方法叫( )
A.电泳 B.电解
C.凝聚 D.渗析2.下列分离物质的方法中,根据粒子大小进行分离的是 ( )
A.蒸馏 B.重结晶
C.沉降 D.渗析DD3.能证明胶粒比溶液中溶质微粒直径大的实验是( )
A.电泳 B.丁达尔现象
C.布朗运动 D.渗析BD4.(2002年上海市高考题)将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是 ( )
A.冷水 B.沸水
C.NaOH溶液 D.NaCl浓溶液B五、应用:(1)江河入海口沙州的形成
(2)盐析
(3)AlCl3的净水作用
(4)制豆腐
(5)使用墨水5.不能用胶体的知识解释的现象是 A、牛油与NaOH 溶液共煮,向反应后所得溶液中加入食盐,会有固体析出 B、一支钢笔使用两种不同牌号蓝墨水,易出现堵塞 C、向氯化铁溶液中加入NaOH溶液,会出现红褐色沉淀 D、在河水与海水得交界处,有三角洲形成C分散系的分离方法,因分散质的大小或状态而定:
①悬浊液用过滤方法
②乳浊液用分液方法
③溶液可用蒸发结晶等方法。 ④胶体溶液用渗析方法
知识小结六、分散系的分离知识小结④ 、胶体的提纯--渗析。利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。其原理为:胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。提纯可以达到净化、精制胶体的目地[拓宽]滤纸可将胶体和沉淀分离1.胶体(酸/碱)溶液中加碱或酸
2.Ca(OH)2溶液中通CO2或SO2
3.Ca(ClO)2溶液中通CO2
4.Al3+加入OH-
5.AlO2-加入H+
6.Ca(OH)2溶液中加H3PO4
7.往Ag+溶液中加氨水
知识小结七、“先沉淀后溶解”实验现象小结1、已知土壤胶体粒子带负电,在土壤里施用含氮量相等的下列肥料,肥效较差的是 ( )
A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D.NH4Cl
2、下列事实与胶体知识有关的是 ( )
①用卤水点豆腐 ②明矾净水 ③河海交接处易沉积形成沙洲 ④配氯化铁溶液时加入少量盐酸
A.①②③ B.②③④
C.①③④ D.全部都是 C巩固练习A3.有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、Bi2S3胶体、NaOH溶液。现将有关实验现象记录如下:(1)电泳:甲液的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入丙液中,先出现凝聚,后液体变清,则
甲为 ,乙为 , 丙为 ,丁为 。Fe(OH)3NaOH溶液硅酸胶体Bi2S3胶体4、生活和生产中常用到胶体的性质,请看下述三例:
⑴做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是
。
⑵在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径为10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集 ,阴极聚集 ,理由是
。
⑶水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种作用运用了
原理。电解质氯化铁使血液中蛋白质胶体凝聚陶土胶粒氧化铁胶粒前者带负电荷向阳极移动,后者带正电荷,向阴极移动电泳请继续努力!再见!
