《化学物质及其变化》全章复习
文档属性
| 名称 | 《化学物质及其变化》全章复习 |  | |
| 格式 | rar | ||
| 文件大小 | 732.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-12 16:06:00 | ||
图片预览









文档简介
课件41张PPT。章 末 专 题 复 习
物质的分类、离子反应、氧化还原反应是中学化学的重要理论部分,是联系元素及其化合物知识的桥梁,也是高考的热点之一。本章首先介绍了物质的组成与分类的重要方法,胶体部分是对有关溶液知识的补充。然后重点学习了电解质、离子反应及其应用。最后是对氧化还原反应相关概念的分析以及氧化剂还原剂的判断。通过本节的复习,我将对本章的知识进一步深化巩固。
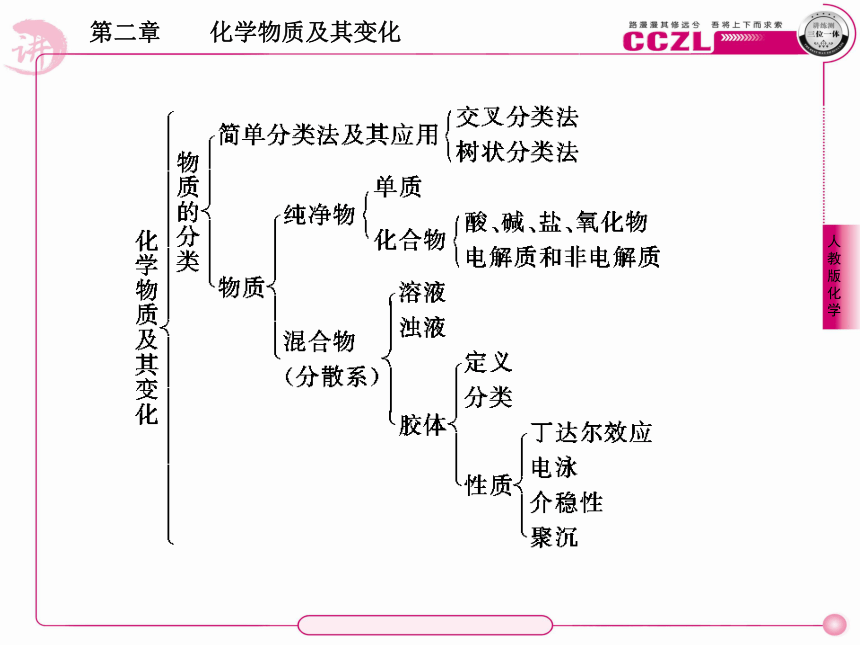
分类是学习和研究化学物质及其变化的一种常用方法。分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。常用的分类方法有交叉分类法和树状分类法。
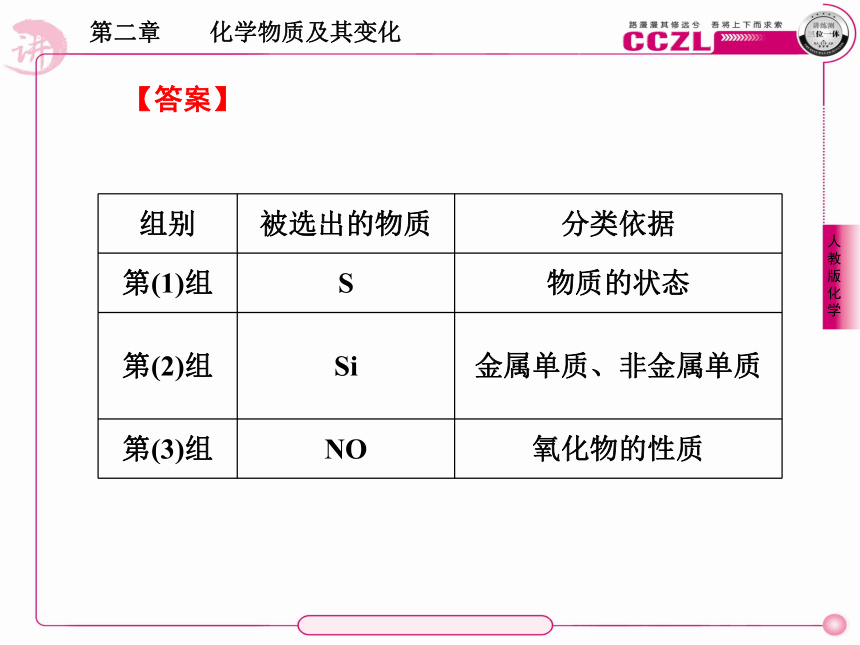
1.以组成为标准对物质进行分类2.以分散质粒子大小为标准对分散系进行分类【例1】 今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在相应的表格内。三组物质分别为:
(1)O2、Cl2、S、N2 (2)Fe、Na、Al、Si (3)NO、CO2、SO2、P2O5【解析】 不同的分类标准其分类方法不同,其分类的基本原则是分在同一类的物质应具有相似之处,在对物质进行分类时,通常可从物理性质中的状态、颜色或从物质的组成进行分析,如纯净物、混合物、金属单质、非金属单质、氧化物、酸、碱、盐等。
第(1)组,所给四种物质均为非金属单质,而O2、Cl2、N2属于气态单质,而S则属于固态单质;第(2)组,所给四种物质均为单质,而Fe、Na、Al属于金属单质,Si属于非金属单质;第(3)组,所给四种物质为四种氧化物,通过对氧化物分析可得出,其中,CO2、SO2、P2O5为常见的酸性氧化物,而NO则属于不成盐氧化物。【答案】 【例2】 下列关于溶液和胶体和叙述,正确的是
( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有【解析】 本题考查了溶液与胶体的性质。胶体本身是不带电,只是胶体中的胶体粒子具有较大的表面积,吸附了溶液中的离子而使胶体粒子带了电荷,故A项错误;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错误;溶液中溶质粒子的运动也是没有规律的,C项错误;丁达尔效应可以用来区分溶液和胶体,D项正确。
【答案】 D【例3】 (河南平顶山2009-2010学年度调研题)FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A.加入饱和的MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜
C.都比较稳定,密封保存一段时间也都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解
【解析】 胶体与溶液均比较稳定,故C项正确;而胶体由于其微粒粒度的大小,其不能通过半透膜,具有聚沉的特性等,而溶液不可。
【答案】 C
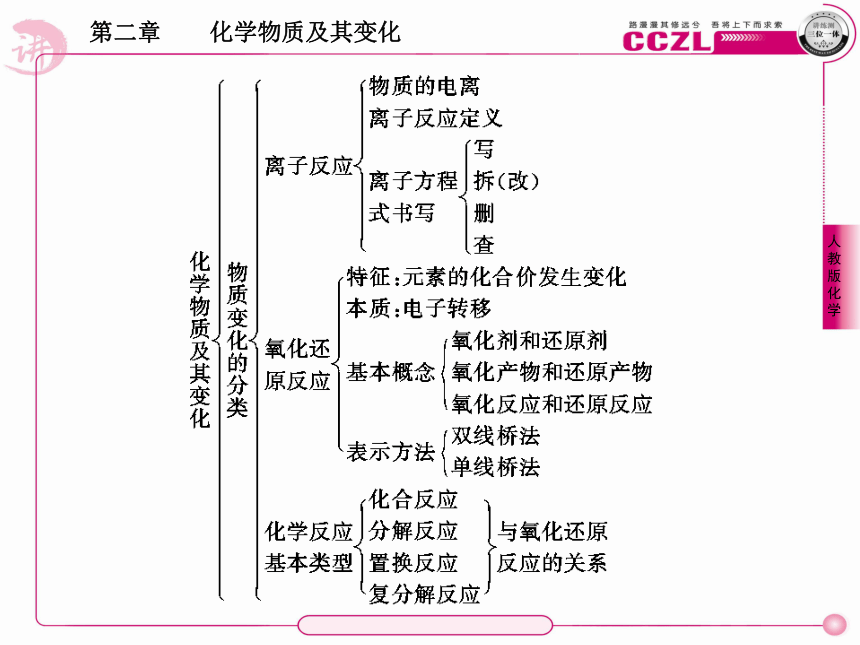
1.量不同,离子反应不同
(1)生成的产物可与过量的物质继续反应的离子反应。这类离子反应,只需注意题给条件,判断产物是否与过量物质继续反应,准确确定产物形式即可。如NaOH与AlCl3溶液(少量或过量),NaAlO2溶液通CO2(少量或过量),Ca(OH)2溶液通CO2(少量或过量),NaAlO2溶液加盐酸(少量或过量),有关离子方程式都有所区别。(2)酸式盐与量有关的离子反应。一般书写时,量不足的物质中参加反应的离子的物质的量之比一定要与它的化学式相符合;而足量的物质中参加反应的离子的物质的量之比不一定与化学式相符。如果没有明确的用量,用任一反应物作为足量写出的离子方程式均属正确。如NaHSO4溶液与Ba(HCO3)2(少量或过量),Ca(HCO3)2溶液与NaOH(少量或过量),Ca(OH)2溶液与NaHCO3(少量或过量),NaH2PO4溶液与Ba(OH)2(少量或过量),均应明确量的影响。
(3)较特殊且与量有关的离子反应。这类反应要求量与其他因素统筹兼顾。如Mg(HCO3)2溶液与过量NaOH反应,不可忽视Mg(OH)2比MgCO3更难溶、更稳定;明矾与足量Ba(OH)2溶液反应;不可忽视Al(OH)3的两性;NH4HSO4与足量Ba(OH)2反应,不可忽视NH3·H2O也是弱电解质;新制氯水与少量FeBr2溶液反应,不可忽视Fe2+、Br-都能被Cl2氧化等。2.混合顺序不同,离子反应不同
如AlCl3与NaOH、Na2CO3与HCl、Na2S与FeCl3、氯水与FeBr2、氨水与AgNO3等。这些情况归根到底还是与量的多少有关。
3.书写“十不忽视”
反应条件(如加热、不加热):溶液浓度(浓、稀);物质聚集状态(气、液、固);电荷守恒;方程式中化学计量数的正确化简;电解质的强弱;电解质的溶解性;电离平衡与水解平衡;难溶物的溶解度大小[如CuSO4溶液与Na2S生成CuS?而不是Cu(OH)2?];水解相互促进等。【答案】 见解析【例5】 下列反应的离子方程式正确的是( )
A.碳酸氢钙溶液与稀盐酸的反应
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑?
B.碳酸钙溶于醋酸中
CaCO3+2H+===Ca2++CO2↑+H2O
C.澄清石灰水跟硝酸反应
Ca(OH)2+2H+===Ca2++2H2O
D.硫酸铜溶液跟氢氧化钡溶液反应E.氯化铁溶液中加入过量铁粉
Fe3++Fe===2Fe2+↑
F.单质铁与稀盐酸反应
2Fe+6H+===2Fe3++3H2?
G.向稀氨水中加入稀盐酸【答案】 G、H、I
【点拨】 判断离子方程式的正误应注意:(1)看原理,是否符合客观实际;(2)看改写,看用化学式还是用离子符号表示;(3)看守恒,即左右两端原子个数、电荷数是否相等;(4)看配比,不足量物质参加反应的离子的配比与其化学式中离子个数比应相同;(5)看符号,“===”
“?? ”“↓?”“↑”使用是否适当。【例6】 (山东五莲2009-2010学年度上学期期中考试)有Na、Cl2、NaOH溶液、FeCl2溶液四种物质,按下列要求,选用其中的两种物质,并写出相应的离子方程式。
(1)氧化还原反应,一种单质氧化一种阳离子
________________________________________________________________________;
(2)非氧化还原反应,
________________________________________________________________________;(3)氧化还原反应,一种单质在同一反应中既是氧化剂又是还原剂
________________________________________________________________________。
【答案】 (1)Cl2+2Fe2+===2Fe3++2Cl-
(2)Fe2++2OH-===Fe(OH)2↓
(3)Cl2+2OH-===Cl-+ClO-+H2O1.电子守恒律:氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数;或者说氧化还原反应中,有物质元素化合价升高必有物质元素化合价降低,且化合价降低总值必等于升高总值。
应用:求某一反应中被氧化与被还原的原子数之比,或氧化剂与还原剂分子数之比及氧化产物与还原产物分子数之比;进行氧化还原反应的有关计算。2.强弱律:较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较弱的物质制备氧化性较强的物质,或用还原性较强的物质制备还原性较弱的物质;亦可用于比较物质间氧化性或还原性的强弱。
3.价态律:元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质;物质若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质氧化性或还原性的有无。
注意:元素处于最高价,具有氧化性,但不一定氧化性最强,如氧化性HClO>HClO4。4.转化律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。如浓H2SO4与SO2不会发生反应;KClO3+6HCl===KCl+3Cl2?+3H2O反应中,中+5价氯不会转化为KCl中-1价氯;反应H2SO4(浓)+H2S===S?+SO2?+2H2O中,浓H2SO4对应的还原产物是SO2,H2S对应的氧化产物是S。
5.先后律:一般说来,在浓度相差不大的溶液中,同时含有几种还原剂(或氧化剂)时,若加入氧化剂(或还原剂),则它首先与溶液中最强的还原剂(或氧化剂)反应。
应用:分析判断氧化还原反应发生的先后顺序。
如向含Br-和I-的混合中液通入Cl2,首先被氧化的是I-。
【例7】 今有三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+I2+2KCl
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2?+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
【解析】 根据①可得氧化性FeCl3>I2。根据②可得氧化性:Cl2>FeCl3。根据③可得氧化性:KMnO4>Cl2。则氧化性:KMnO4>Cl2>FeCl3>I2,要氧化I-而不影响Fe2+和Cl-,必须选氧化能力比I2强,而比KMnO4、Cl2弱的氧化剂,只有FeCl3满足要求。
【答案】 C
【点拨】 判断氧化性强弱的方法是氧化剂的氧化性大于氧化产物的氧化性。【例8】 (河南濮阳市华龙区高级中学2009-2010学年度第一次月考,22)从氧化还原的角度分析水的作用
(A.氧化剂 B.还原剂 C.既做氧化剂又是还原剂 D.既不是氧化剂又不是还原剂。填字母)
(1)电解水
________________________________________________________________________。
(2)铁和水蒸气作用生成四氧化三铁和氢气
________________________________________________________________________。(3)氟气和水作用(2F2+2H2O=4HF+O2)
________________________________________________________________________。
(4)氯气和水反应(Cl2+H2O=HCl+HClO)
________________________________________________________________________。
【解析】 依据参加反应中的氢、氧元素的化合价的变化可判断。
【答案】 (1)C (2)A (3)B (4)D【例9】 化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如下图中:
(1)在上述有编号的步骤中,需用还原剂的是____________,需用氧化剂的是____________。(填编号)
(2)完成步骤①的化学方程式,标出电子转移的方向和数目:Na2Cr2O7+6KI+14HCl===2CrCl3+2NaCl+6KCl+3I2+____________。
【答案】 (1)① ④⑥
(2)
【点拨】 ①发生还原反应,④⑥发生氧化反应。
【例10】 氨与灼热的氧化铜反应,生成N2、Cu和化合物A。
(1)写出A的化学式。
(2)写出反应的化学方程式,并标明电子的转移方向和数目。
(3)当有17g还原剂发生反应时,求消耗的氧化剂的质量。【答案】 (1)NH3+CuO―→N2+Cu+A,据质量守恒,推知A为H2O。
(3)2NH3 ~ 3CuO
2×17 3×80
物质的分类、离子反应、氧化还原反应是中学化学的重要理论部分,是联系元素及其化合物知识的桥梁,也是高考的热点之一。本章首先介绍了物质的组成与分类的重要方法,胶体部分是对有关溶液知识的补充。然后重点学习了电解质、离子反应及其应用。最后是对氧化还原反应相关概念的分析以及氧化剂还原剂的判断。通过本节的复习,我将对本章的知识进一步深化巩固。
分类是学习和研究化学物质及其变化的一种常用方法。分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。常用的分类方法有交叉分类法和树状分类法。
1.以组成为标准对物质进行分类2.以分散质粒子大小为标准对分散系进行分类【例1】 今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在相应的表格内。三组物质分别为:
(1)O2、Cl2、S、N2 (2)Fe、Na、Al、Si (3)NO、CO2、SO2、P2O5【解析】 不同的分类标准其分类方法不同,其分类的基本原则是分在同一类的物质应具有相似之处,在对物质进行分类时,通常可从物理性质中的状态、颜色或从物质的组成进行分析,如纯净物、混合物、金属单质、非金属单质、氧化物、酸、碱、盐等。
第(1)组,所给四种物质均为非金属单质,而O2、Cl2、N2属于气态单质,而S则属于固态单质;第(2)组,所给四种物质均为单质,而Fe、Na、Al属于金属单质,Si属于非金属单质;第(3)组,所给四种物质为四种氧化物,通过对氧化物分析可得出,其中,CO2、SO2、P2O5为常见的酸性氧化物,而NO则属于不成盐氧化物。【答案】 【例2】 下列关于溶液和胶体和叙述,正确的是
( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有【解析】 本题考查了溶液与胶体的性质。胶体本身是不带电,只是胶体中的胶体粒子具有较大的表面积,吸附了溶液中的离子而使胶体粒子带了电荷,故A项错误;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错误;溶液中溶质粒子的运动也是没有规律的,C项错误;丁达尔效应可以用来区分溶液和胶体,D项正确。
【答案】 D【例3】 (河南平顶山2009-2010学年度调研题)FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A.加入饱和的MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜
C.都比较稳定,密封保存一段时间也都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解
【解析】 胶体与溶液均比较稳定,故C项正确;而胶体由于其微粒粒度的大小,其不能通过半透膜,具有聚沉的特性等,而溶液不可。
【答案】 C
1.量不同,离子反应不同
(1)生成的产物可与过量的物质继续反应的离子反应。这类离子反应,只需注意题给条件,判断产物是否与过量物质继续反应,准确确定产物形式即可。如NaOH与AlCl3溶液(少量或过量),NaAlO2溶液通CO2(少量或过量),Ca(OH)2溶液通CO2(少量或过量),NaAlO2溶液加盐酸(少量或过量),有关离子方程式都有所区别。(2)酸式盐与量有关的离子反应。一般书写时,量不足的物质中参加反应的离子的物质的量之比一定要与它的化学式相符合;而足量的物质中参加反应的离子的物质的量之比不一定与化学式相符。如果没有明确的用量,用任一反应物作为足量写出的离子方程式均属正确。如NaHSO4溶液与Ba(HCO3)2(少量或过量),Ca(HCO3)2溶液与NaOH(少量或过量),Ca(OH)2溶液与NaHCO3(少量或过量),NaH2PO4溶液与Ba(OH)2(少量或过量),均应明确量的影响。
(3)较特殊且与量有关的离子反应。这类反应要求量与其他因素统筹兼顾。如Mg(HCO3)2溶液与过量NaOH反应,不可忽视Mg(OH)2比MgCO3更难溶、更稳定;明矾与足量Ba(OH)2溶液反应;不可忽视Al(OH)3的两性;NH4HSO4与足量Ba(OH)2反应,不可忽视NH3·H2O也是弱电解质;新制氯水与少量FeBr2溶液反应,不可忽视Fe2+、Br-都能被Cl2氧化等。2.混合顺序不同,离子反应不同
如AlCl3与NaOH、Na2CO3与HCl、Na2S与FeCl3、氯水与FeBr2、氨水与AgNO3等。这些情况归根到底还是与量的多少有关。
3.书写“十不忽视”
反应条件(如加热、不加热):溶液浓度(浓、稀);物质聚集状态(气、液、固);电荷守恒;方程式中化学计量数的正确化简;电解质的强弱;电解质的溶解性;电离平衡与水解平衡;难溶物的溶解度大小[如CuSO4溶液与Na2S生成CuS?而不是Cu(OH)2?];水解相互促进等。【答案】 见解析【例5】 下列反应的离子方程式正确的是( )
A.碳酸氢钙溶液与稀盐酸的反应
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑?
B.碳酸钙溶于醋酸中
CaCO3+2H+===Ca2++CO2↑+H2O
C.澄清石灰水跟硝酸反应
Ca(OH)2+2H+===Ca2++2H2O
D.硫酸铜溶液跟氢氧化钡溶液反应E.氯化铁溶液中加入过量铁粉
Fe3++Fe===2Fe2+↑
F.单质铁与稀盐酸反应
2Fe+6H+===2Fe3++3H2?
G.向稀氨水中加入稀盐酸【答案】 G、H、I
【点拨】 判断离子方程式的正误应注意:(1)看原理,是否符合客观实际;(2)看改写,看用化学式还是用离子符号表示;(3)看守恒,即左右两端原子个数、电荷数是否相等;(4)看配比,不足量物质参加反应的离子的配比与其化学式中离子个数比应相同;(5)看符号,“===”
“?? ”“↓?”“↑”使用是否适当。【例6】 (山东五莲2009-2010学年度上学期期中考试)有Na、Cl2、NaOH溶液、FeCl2溶液四种物质,按下列要求,选用其中的两种物质,并写出相应的离子方程式。
(1)氧化还原反应,一种单质氧化一种阳离子
________________________________________________________________________;
(2)非氧化还原反应,
________________________________________________________________________;(3)氧化还原反应,一种单质在同一反应中既是氧化剂又是还原剂
________________________________________________________________________。
【答案】 (1)Cl2+2Fe2+===2Fe3++2Cl-
(2)Fe2++2OH-===Fe(OH)2↓
(3)Cl2+2OH-===Cl-+ClO-+H2O1.电子守恒律:氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子总数;或者说氧化还原反应中,有物质元素化合价升高必有物质元素化合价降低,且化合价降低总值必等于升高总值。
应用:求某一反应中被氧化与被还原的原子数之比,或氧化剂与还原剂分子数之比及氧化产物与还原产物分子数之比;进行氧化还原反应的有关计算。2.强弱律:较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较弱的物质制备氧化性较强的物质,或用还原性较强的物质制备还原性较弱的物质;亦可用于比较物质间氧化性或还原性的强弱。
3.价态律:元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质;物质若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质氧化性或还原性的有无。
注意:元素处于最高价,具有氧化性,但不一定氧化性最强,如氧化性HClO>HClO4。4.转化律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。如浓H2SO4与SO2不会发生反应;KClO3+6HCl===KCl+3Cl2?+3H2O反应中,中+5价氯不会转化为KCl中-1价氯;反应H2SO4(浓)+H2S===S?+SO2?+2H2O中,浓H2SO4对应的还原产物是SO2,H2S对应的氧化产物是S。
5.先后律:一般说来,在浓度相差不大的溶液中,同时含有几种还原剂(或氧化剂)时,若加入氧化剂(或还原剂),则它首先与溶液中最强的还原剂(或氧化剂)反应。
应用:分析判断氧化还原反应发生的先后顺序。
如向含Br-和I-的混合中液通入Cl2,首先被氧化的是I-。
【例7】 今有三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+I2+2KCl
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2?+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
【解析】 根据①可得氧化性FeCl3>I2。根据②可得氧化性:Cl2>FeCl3。根据③可得氧化性:KMnO4>Cl2。则氧化性:KMnO4>Cl2>FeCl3>I2,要氧化I-而不影响Fe2+和Cl-,必须选氧化能力比I2强,而比KMnO4、Cl2弱的氧化剂,只有FeCl3满足要求。
【答案】 C
【点拨】 判断氧化性强弱的方法是氧化剂的氧化性大于氧化产物的氧化性。【例8】 (河南濮阳市华龙区高级中学2009-2010学年度第一次月考,22)从氧化还原的角度分析水的作用
(A.氧化剂 B.还原剂 C.既做氧化剂又是还原剂 D.既不是氧化剂又不是还原剂。填字母)
(1)电解水
________________________________________________________________________。
(2)铁和水蒸气作用生成四氧化三铁和氢气
________________________________________________________________________。(3)氟气和水作用(2F2+2H2O=4HF+O2)
________________________________________________________________________。
(4)氯气和水反应(Cl2+H2O=HCl+HClO)
________________________________________________________________________。
【解析】 依据参加反应中的氢、氧元素的化合价的变化可判断。
【答案】 (1)C (2)A (3)B (4)D【例9】 化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如下图中:
(1)在上述有编号的步骤中,需用还原剂的是____________,需用氧化剂的是____________。(填编号)
(2)完成步骤①的化学方程式,标出电子转移的方向和数目:Na2Cr2O7+6KI+14HCl===2CrCl3+2NaCl+6KCl+3I2+____________。
【答案】 (1)① ④⑥
(2)
【点拨】 ①发生还原反应,④⑥发生氧化反应。
【例10】 氨与灼热的氧化铜反应,生成N2、Cu和化合物A。
(1)写出A的化学式。
(2)写出反应的化学方程式,并标明电子的转移方向和数目。
(3)当有17g还原剂发生反应时,求消耗的氧化剂的质量。【答案】 (1)NH3+CuO―→N2+Cu+A,据质量守恒,推知A为H2O。
(3)2NH3 ~ 3CuO
2×17 3×80
