第三章 水溶液中的离子平衡 第三节 盐类的水解
文档属性
| 名称 | 第三章 水溶液中的离子平衡 第三节 盐类的水解 |  | |
| 格式 | rar | ||
| 文件大小 | 181.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-13 10:59:00 | ||
图片预览







文档简介
课件47张PPT。第三节 盐类的水解(第一课时)广华中学 高二化学组 思考:什么是盐?强酸强酸弱酸弱酸强碱弱碱强碱弱碱强酸弱碱盐强酸强碱盐强碱弱酸盐弱酸弱碱盐根
据
生
成
盐
的
酸
和
碱
的
强
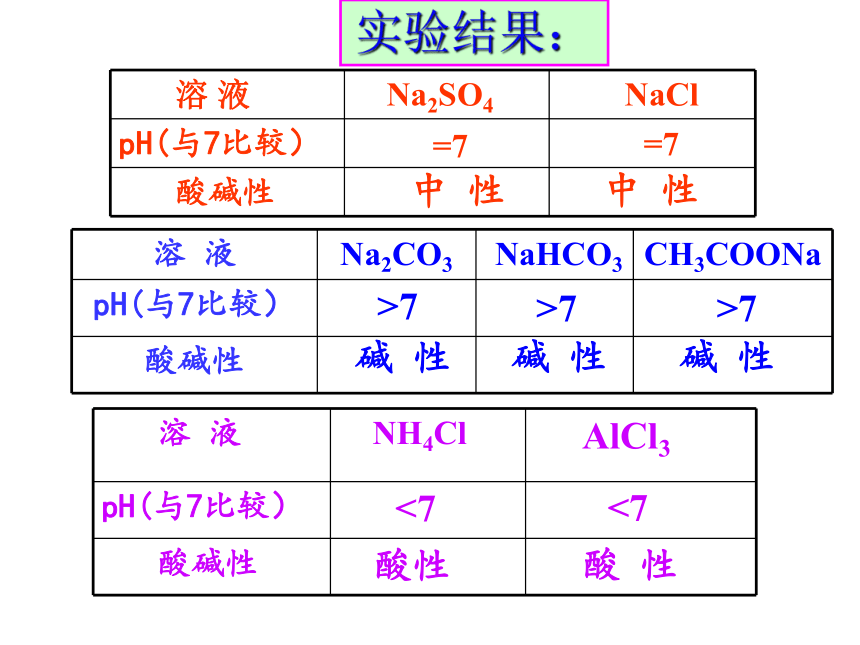
弱(如 NaCl、Na2SO4)(如 NH4Cl、AlCl3)(如 CH3COONa、Na2CO3)[如 CH3COONH4、(NH4)2CO3]问题一:探究盐溶液的酸碱性1、用pH试纸测定下面溶液的酸碱性:
(1)组: Na2SO4溶液、 NaCl溶液
(2)组: Na2CO3溶液、 NaHCO3溶液
CH3COONa溶液
(3)组: NH4Cl溶液、AlCl3溶液
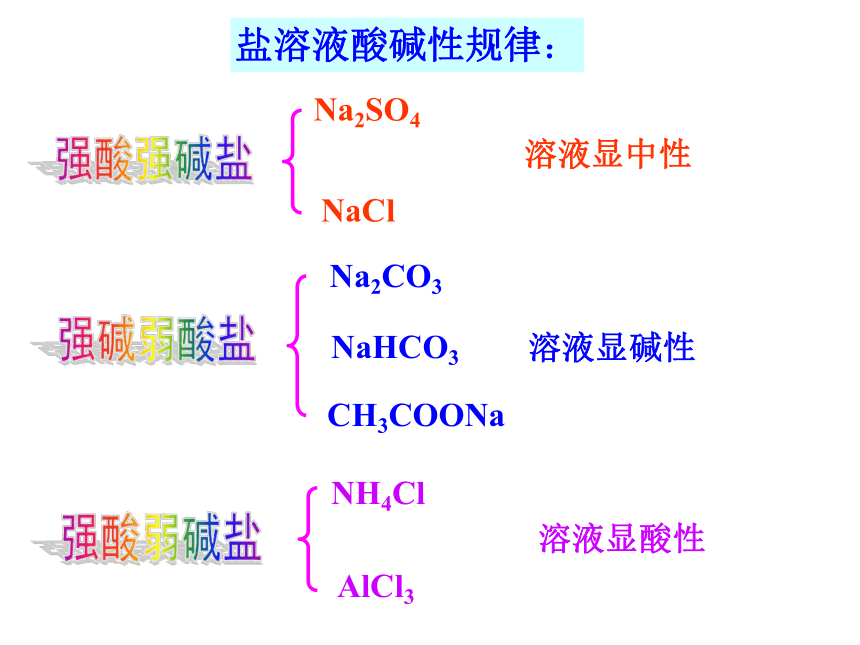
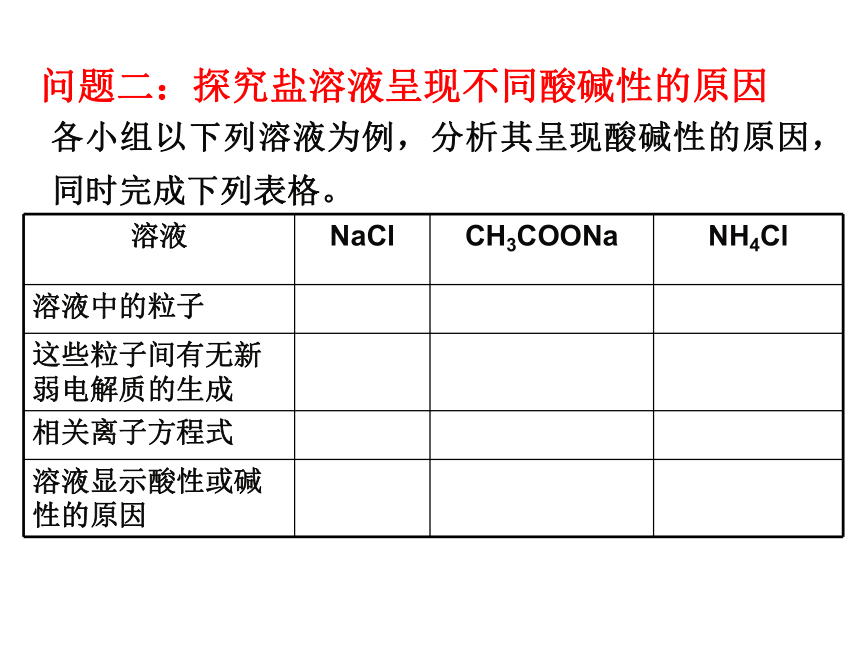
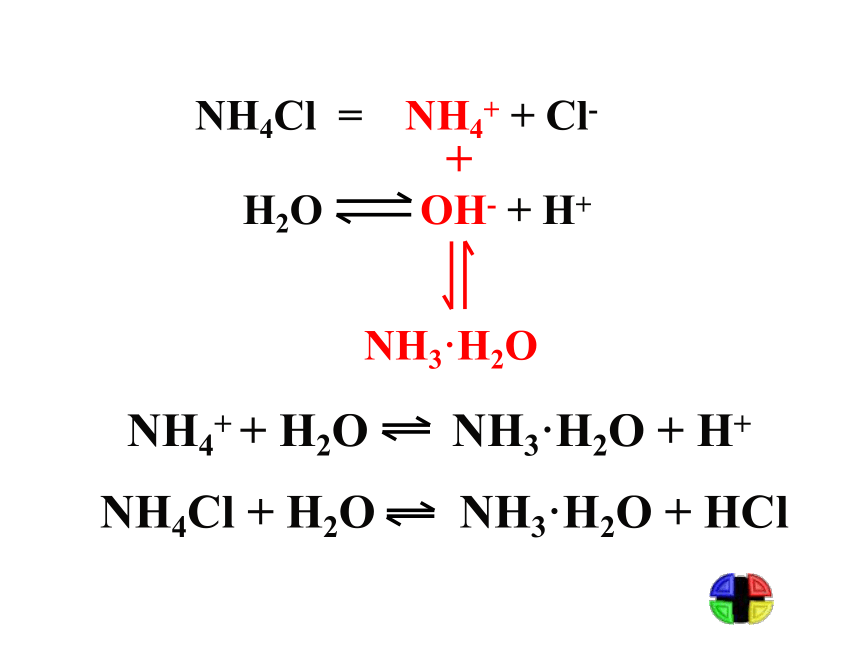
实验结果:强酸强碱盐 NaClNa2SO4强碱弱酸盐强酸弱碱盐Na2CO3NaHCO3CH3COONaNH4Cl AlCl3溶液显中性溶液显碱性溶液显酸性盐溶液酸碱性规律: 盐既不会电离出H+,也不会电离出OH-,溶液之所以显示酸性或碱性,是由于[H+]和[OH-]不相等。最初由水电离出相等浓度的H+ 、OH- ,是什么打破了这一等量关系?它是如何改变[H+]与[OH-]的? 问题讨论 各小组以下列溶液为例,分析其呈现酸碱性的原因,同时完成下列表格。 问题二:探究盐溶液呈现不同酸碱性的原因NH4Cl = NH4+ + Cl-+NH3·H2O二、盐类的水解1、定义:
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。弱酸阴离子或
弱碱阳离子二、盐类的水解2、实质:溶液中盐电离出的弱酸阴离子
或弱碱阳离子与水电离出的H+或OH-结
合生成弱电解质,破坏了水的电离平
衡,增大了水的电离程度,从而使溶液
呈现不同程度的酸性或碱性。3、水解方程式的书写注意点 (1)用可逆符号
(2)不标“↑”,“↓”,也不把生成物
(如NH3·H2O 、H2CO3)写成其分解
产物的形式
(3)多元弱酸盐水解分步进行,以第一
步为主
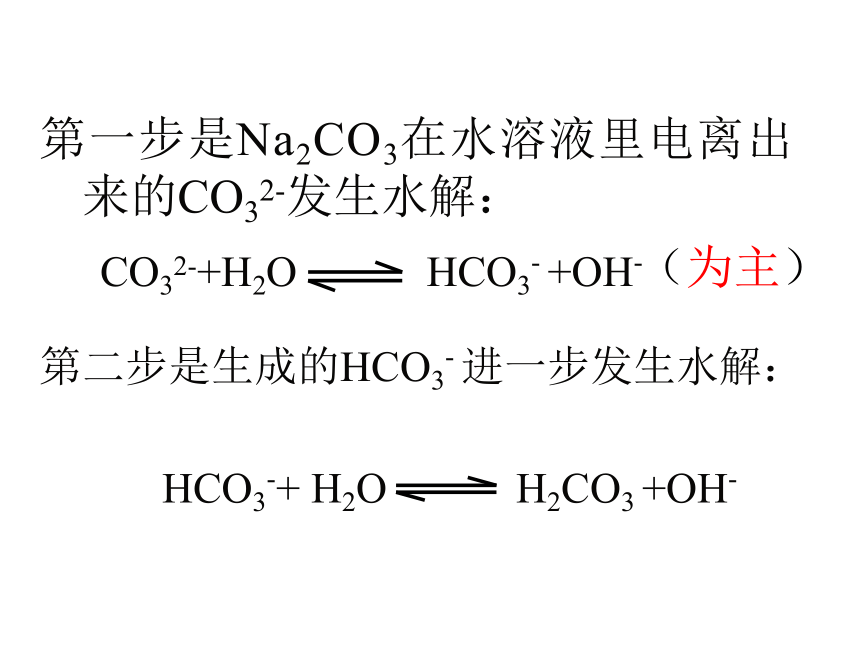
(4)多元弱碱盐的水解视为一步完成第二步是生成的HCO3- 进一步发生水解:
HCO3-+ H2O H2CO3 +OH-第一步是Na2CO3在水溶液里电离出来的CO32-发生水解:(为主)总结:盐类水解的规律能能否
弱碱
阳离子弱酸
阴离子无
促进
促进
无影响
酸性碱性中性
无弱不水解。谁强显谁性,同强显中性。有弱才水解,`越弱越水解,都弱都水解。—条件—结果—程度A、只有③④ B、只有①③ C、只有①③④ D、全部再见! 【质疑】盐既不会电离出H+也不会电离出OH-,为什么会显示出酸碱性呢?CH3COONa = CH3COO- + Na++CH3COOH 【质疑1】同样为盐溶液,CH3COONa、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系?练习:
1.书写 下列盐的水解方程式。
KF,NH4NO3,FeCl3,Na2S,
3、盐类水解的规律:无弱不水解。谁强显谁性,同强显中性。有弱才水解,越弱越水解,都弱都水解。 5.? 氯化铵溶液中离子浓度从大到小排列
正确的是:
A . NH4+ 、H + 、OH-、Cl_
B . Cl _ 、 NH4+ 、H + 、OH _
C . H +、 Cl_ 、 NH4+ 、OH _
D . Cl _ 、 NH4+ 、 OH- 、H +
6.思考:等浓度的NaHCO3 溶液与NaAC的碱性强弱关系?酸性: H2CO3 < CH3COOH水解程度: NaHCO3 > CH3COONa碱性: NaHCO3 > CH3COONa越弱越水解
生成的电解质越弱则对应离子水解程度越大7.思考:等浓度的NaHCO3 溶液与Na2CO3溶液的碱性强弱关系?酸性: H2CO3 HCO3-水解程度: HCO3- CO32-碱性: NaHCO3 Na2CO3越弱越水解
生成的电解质越弱则对应离子水解程度越大><<8.思考:NaHCO3 溶液中存在哪些平衡?猜测一下, NaHCO3 溶液的酸碱性会怎样呢?NaH2PO4 溶液呢?多元弱酸的酸式根离子…
如HCO3- 、 HPO42- 、 HS- 、 HSO3- 、 H2PO4-
若水解程度大于电离程度,溶液呈碱性,如HCO3- 、 HPO42- 、 HS- ,
若电离程度大于水解程度,溶液呈酸性,如HSO3- 、 H2PO4-。影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。水解的离子结合H+或OH-的能力-----越弱越水解例、相同条件,0.1mol/L的下列溶液:Na2CO3、NaAc、Na2SO4、NaHCO3、PH值由大到小的顺序为:Na2CO3>NaHCO3>NaAc>Na2SO4影响盐类水解的因素外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 4、实验室配制FeCl3溶液时,为什么常加入
一些HCl?解释下列各小题1、为什么生活中常用Na2CO3溶液代替NaOH溶液去油污?热溶液去污效果好还是冷溶液去污效果好?2、胃酸过多的人吃少量小苏打可中和胃酸?3、含有较多Al3+、Fe3+的土壤,为什么常显
酸性?6、将AlCl3溶液加热蒸干之后灼烧,最后得到的固体物质是什么?7、泡沫灭火器中盛装的化学试剂是NaHCO3和Al2(SO4)3,你能解释一下其灭火的原理吗?5、有人说对农作物施肥时,K2CO3和(NH4)2SO4不能同时施用,你同意吗?解释下列各小题分析下列各小题例8、浓度相同的NaX、NaY、NaZ三种盐溶液的PH依次为7、8、9,则相应的酸HX、HY、HZ的相对强弱为?HX>HY>HZ例9、下列离子能大量共存的是( )
A、 CH3COO-、OH-、CO32-、K+
B、NH4+、Na+、SO42-、OH-
C、Fe2+、H+、NO3-、SO42-
D、 Al3+、Na+、HCO3-、NO3-A例10:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 A D 1、电荷平衡式溶液中阳离子所带的正电荷总数
=阴离子所带的负电荷总数
存在:Na+、CH3COO- 、H+、OH-
所以:[Na+]×1+[H+]×1=[CH3COO-]×1+[OH-]×1 如:CH3COONa溶液中 四、离子浓度大小比较2、物料平衡式[水解离子]始=[水解离子]平
+水解生成的相应微粒浓度之和因为:CH3COO-+H+=CH3COOH
所以:
[CH3COO-]始=[CH3COO-]平+[CH3COOH]平=[Na+] 如:CH3COONa溶液中 3、质子平衡式[H+]水+结合掉的[H+]水=[OH-]水+结合掉的[OH-]水
因为:CH3COO-+H+=CH3COOH
所以:[H+]+[CH3COOH]=[OH-] 如:CH3COONa题型示例:
1、在0.1mol/L的硫化钠溶液中,下列关系正确的是的
A.[Na+]>[S2-]>[H+]>[HS-]>[OH-]
B.[OH-]=[H+]+[HS-]+2[H2S]
C.[Na+]+[H+]=1/2[S2-]+[HS-]+[OH-]
D.[S2-]+[HS-]+[H2S]=0.1mol/L
。(BD)考点1.判断单一溶液中各粒子浓度2、在Na2S溶液中,各微粒间浓度关系如下:
(1) [Na+]+[H+]=[OH-]+
(2) [OH-]=[H+]+[HS-]+
(3) [Na+]=2[S2-]+
[HS-]+[S2-]×2 2[H2S]
2[HS-]+2[H2S] 3、在NaHCO3溶液中各离子浓度从大到小的顺序是:[Na+]>[HCO3-]>[OH-]> [H+] >[CO32-]4、某二元弱酸的酸式盐NaHA溶液,若pH < 7,则溶液中各离子浓度关系不正确的是( ) A. c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-) B. c(Na+) + c(H+) = c(HA-) +2c(A2-) +c(OH-) C. c(H+) + c(A2-) = c(OH-) + c(H2A) D. c(Na+) = c(HA-) + c(H2A) + c(A2-)C正确答案为: c(H+) + c(H2A) = c(A2-) + c(OH-)C题型示例:考点2.判断两种溶质溶液中各粒子浓度
5、将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是
A.[NH4+]>[Cl-]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-]
D.[Cl-]>[NH4+]>[OH-]>[H+]
(B)6、某弱酸HA与其对应的盐NaA等物质的量混合,如果溶液中 (1)c(OH-) >c(H+) (2) c(OH-) c(Na+) >c(A-) >c(OH-) >c(H+)(2) c(A-) > c(Na+) > c(HA) >c(H+) >c(OH-)题型示例:考点3.判断不同电解质溶液中同一粒子浓度大小
7、相同浓度的下列溶液中,c(CO32-)的大小关系依次为( )
①Na2CO3 ②NaHCO3
③H2CO3 ④(NH4)2CO3① ④ ② ③8、将标准状况下4.48LCO2通入1mol/L 300mL NaOH溶液中,试比较所得溶液中各种离子浓度的大小顺序? c(Na+) >c(HCO3-) >c(CO32-) >c(OH-) >c(H+)9、把0.02mol/LHAc和0.01mol/LNaOH以等体积
混合,则混合溶液中微粒浓度关系正确的是
(AD) C(Ac-)>C(Na+)
B. C(HAc)>C(Ac-)
C. 2C(H+)=C(Ac-)-C(HAc)
D. C(HAc)+C(Ac-)=0.01mol/L 10.相同温度、相同物质的量浓度的下列各组溶液,按pH依次减小的顺序排列正确的是( )
A. NaHSO4 NaCl CH3COONa Na2CO3
B.HCl CH3COOH NH4Cl NaHCO3
C. H2SO4 HCl NaOH Ba(OH)2
D.NH4Cl CH3COOH NaHSO4 H2SO4D11.25℃时1mo/L的(NH4)2SO4 、(NH4)2CO3、(NH4)2Fe(SO4)2 、NH4Cl、NH4HSO4溶液中,NH4+由大到小的顺序为:(NH4)2Fe(SO4)2>(NH4)2SO4> (NH4)2CO3>NH4HSO4> NH4Cl双水解反应(1)直接写出最终产物,用”= ↑ ↓”。
(2)反应物中有H无水,无H有水。
(3)配平时先利用电荷守恒,再配其它。Al3+(CO32-、HCO3-、S2-、AlO2-)
Fe3+( CO32-、HCO3-、 AlO2-)
5、将0.3mol/L的KOH溶液与0.1 mol/L 的H3PO4溶液等体积混合,溶液中各种微粒间关系正确的是 ( ) A.c(K+)+c(H+)=c(OH-)+c(H2PO4-) + c(HPO42-) +c(PO43-) B .c(OH-) = c(H+) + c(HPO42-) + 2c(H2PO4-) + 3c(H3PO4 ) C. c(K+) >c(PO43-) >c(HPO42-) > c(H2PO4-) > c(H3PO4 ) D. c(H3PO4 ) + c(H2PO4-) + c(HPO42-) +c(PO43-)=0.1mol/LB C经验指导:1、离子因电离或水解,浓度减小;但电离与水解均是微弱的。
2、多元弱酸根离子分步水解程度逐步减弱,水解形成的相应微粒浓度也相应减小。
3、酸性盐溶液中[H+]小于水解离子浓度,大于水解形成的相应微粒浓度,而[OH-]一般最小。
4、碱性盐溶液中,[OH-]小于水解离子浓度,大于水解形成的相应微粒浓度,而[H+]一般最小。
据
生
成
盐
的
酸
和
碱
的
强
弱(如 NaCl、Na2SO4)(如 NH4Cl、AlCl3)(如 CH3COONa、Na2CO3)[如 CH3COONH4、(NH4)2CO3]问题一:探究盐溶液的酸碱性1、用pH试纸测定下面溶液的酸碱性:
(1)组: Na2SO4溶液、 NaCl溶液
(2)组: Na2CO3溶液、 NaHCO3溶液
CH3COONa溶液
(3)组: NH4Cl溶液、AlCl3溶液
实验结果:强酸强碱盐 NaClNa2SO4强碱弱酸盐强酸弱碱盐Na2CO3NaHCO3CH3COONaNH4Cl AlCl3溶液显中性溶液显碱性溶液显酸性盐溶液酸碱性规律: 盐既不会电离出H+,也不会电离出OH-,溶液之所以显示酸性或碱性,是由于[H+]和[OH-]不相等。最初由水电离出相等浓度的H+ 、OH- ,是什么打破了这一等量关系?它是如何改变[H+]与[OH-]的? 问题讨论 各小组以下列溶液为例,分析其呈现酸碱性的原因,同时完成下列表格。 问题二:探究盐溶液呈现不同酸碱性的原因NH4Cl = NH4+ + Cl-+NH3·H2O二、盐类的水解1、定义:
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。弱酸阴离子或
弱碱阳离子二、盐类的水解2、实质:溶液中盐电离出的弱酸阴离子
或弱碱阳离子与水电离出的H+或OH-结
合生成弱电解质,破坏了水的电离平
衡,增大了水的电离程度,从而使溶液
呈现不同程度的酸性或碱性。3、水解方程式的书写注意点 (1)用可逆符号
(2)不标“↑”,“↓”,也不把生成物
(如NH3·H2O 、H2CO3)写成其分解
产物的形式
(3)多元弱酸盐水解分步进行,以第一
步为主
(4)多元弱碱盐的水解视为一步完成第二步是生成的HCO3- 进一步发生水解:
HCO3-+ H2O H2CO3 +OH-第一步是Na2CO3在水溶液里电离出来的CO32-发生水解:(为主)总结:盐类水解的规律能能否
弱碱
阳离子弱酸
阴离子无
促进
促进
无影响
酸性碱性中性
无弱不水解。谁强显谁性,同强显中性。有弱才水解,`越弱越水解,都弱都水解。—条件—结果—程度A、只有③④ B、只有①③ C、只有①③④ D、全部再见! 【质疑】盐既不会电离出H+也不会电离出OH-,为什么会显示出酸碱性呢?CH3COONa = CH3COO- + Na++CH3COOH 【质疑1】同样为盐溶液,CH3COONa、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系?练习:
1.书写 下列盐的水解方程式。
KF,NH4NO3,FeCl3,Na2S,
3、盐类水解的规律:无弱不水解。谁强显谁性,同强显中性。有弱才水解,越弱越水解,都弱都水解。 5.? 氯化铵溶液中离子浓度从大到小排列
正确的是:
A . NH4+ 、H + 、OH-、Cl_
B . Cl _ 、 NH4+ 、H + 、OH _
C . H +、 Cl_ 、 NH4+ 、OH _
D . Cl _ 、 NH4+ 、 OH- 、H +
6.思考:等浓度的NaHCO3 溶液与NaAC的碱性强弱关系?酸性: H2CO3 < CH3COOH水解程度: NaHCO3 > CH3COONa碱性: NaHCO3 > CH3COONa越弱越水解
生成的电解质越弱则对应离子水解程度越大7.思考:等浓度的NaHCO3 溶液与Na2CO3溶液的碱性强弱关系?酸性: H2CO3 HCO3-水解程度: HCO3- CO32-碱性: NaHCO3 Na2CO3越弱越水解
生成的电解质越弱则对应离子水解程度越大><<8.思考:NaHCO3 溶液中存在哪些平衡?猜测一下, NaHCO3 溶液的酸碱性会怎样呢?NaH2PO4 溶液呢?多元弱酸的酸式根离子…
如HCO3- 、 HPO42- 、 HS- 、 HSO3- 、 H2PO4-
若水解程度大于电离程度,溶液呈碱性,如HCO3- 、 HPO42- 、 HS- ,
若电离程度大于水解程度,溶液呈酸性,如HSO3- 、 H2PO4-。影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。水解的离子结合H+或OH-的能力-----越弱越水解例、相同条件,0.1mol/L的下列溶液:Na2CO3、NaAc、Na2SO4、NaHCO3、PH值由大到小的顺序为:Na2CO3>NaHCO3>NaAc>Na2SO4影响盐类水解的因素外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 4、实验室配制FeCl3溶液时,为什么常加入
一些HCl?解释下列各小题1、为什么生活中常用Na2CO3溶液代替NaOH溶液去油污?热溶液去污效果好还是冷溶液去污效果好?2、胃酸过多的人吃少量小苏打可中和胃酸?3、含有较多Al3+、Fe3+的土壤,为什么常显
酸性?6、将AlCl3溶液加热蒸干之后灼烧,最后得到的固体物质是什么?7、泡沫灭火器中盛装的化学试剂是NaHCO3和Al2(SO4)3,你能解释一下其灭火的原理吗?5、有人说对农作物施肥时,K2CO3和(NH4)2SO4不能同时施用,你同意吗?解释下列各小题分析下列各小题例8、浓度相同的NaX、NaY、NaZ三种盐溶液的PH依次为7、8、9,则相应的酸HX、HY、HZ的相对强弱为?HX>HY>HZ例9、下列离子能大量共存的是( )
A、 CH3COO-、OH-、CO32-、K+
B、NH4+、Na+、SO42-、OH-
C、Fe2+、H+、NO3-、SO42-
D、 Al3+、Na+、HCO3-、NO3-A例10:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 A D 1、电荷平衡式溶液中阳离子所带的正电荷总数
=阴离子所带的负电荷总数
存在:Na+、CH3COO- 、H+、OH-
所以:[Na+]×1+[H+]×1=[CH3COO-]×1+[OH-]×1 如:CH3COONa溶液中 四、离子浓度大小比较2、物料平衡式[水解离子]始=[水解离子]平
+水解生成的相应微粒浓度之和因为:CH3COO-+H+=CH3COOH
所以:
[CH3COO-]始=[CH3COO-]平+[CH3COOH]平=[Na+] 如:CH3COONa溶液中 3、质子平衡式[H+]水+结合掉的[H+]水=[OH-]水+结合掉的[OH-]水
因为:CH3COO-+H+=CH3COOH
所以:[H+]+[CH3COOH]=[OH-] 如:CH3COONa题型示例:
1、在0.1mol/L的硫化钠溶液中,下列关系正确的是的
A.[Na+]>[S2-]>[H+]>[HS-]>[OH-]
B.[OH-]=[H+]+[HS-]+2[H2S]
C.[Na+]+[H+]=1/2[S2-]+[HS-]+[OH-]
D.[S2-]+[HS-]+[H2S]=0.1mol/L
。(BD)考点1.判断单一溶液中各粒子浓度2、在Na2S溶液中,各微粒间浓度关系如下:
(1) [Na+]+[H+]=[OH-]+
(2) [OH-]=[H+]+[HS-]+
(3) [Na+]=2[S2-]+
[HS-]+[S2-]×2 2[H2S]
2[HS-]+2[H2S] 3、在NaHCO3溶液中各离子浓度从大到小的顺序是:[Na+]>[HCO3-]>[OH-]> [H+] >[CO32-]4、某二元弱酸的酸式盐NaHA溶液,若pH < 7,则溶液中各离子浓度关系不正确的是( ) A. c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH-) B. c(Na+) + c(H+) = c(HA-) +2c(A2-) +c(OH-) C. c(H+) + c(A2-) = c(OH-) + c(H2A) D. c(Na+) = c(HA-) + c(H2A) + c(A2-)C正确答案为: c(H+) + c(H2A) = c(A2-) + c(OH-)C题型示例:考点2.判断两种溶质溶液中各粒子浓度
5、将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是
A.[NH4+]>[Cl-]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-]
D.[Cl-]>[NH4+]>[OH-]>[H+]
(B)6、某弱酸HA与其对应的盐NaA等物质的量混合,如果溶液中 (1)c(OH-) >c(H+) (2) c(OH-)
7、相同浓度的下列溶液中,c(CO32-)的大小关系依次为( )
①Na2CO3 ②NaHCO3
③H2CO3 ④(NH4)2CO3① ④ ② ③8、将标准状况下4.48LCO2通入1mol/L 300mL NaOH溶液中,试比较所得溶液中各种离子浓度的大小顺序? c(Na+) >c(HCO3-) >c(CO32-) >c(OH-) >c(H+)9、把0.02mol/LHAc和0.01mol/LNaOH以等体积
混合,则混合溶液中微粒浓度关系正确的是
(AD) C(Ac-)>C(Na+)
B. C(HAc)>C(Ac-)
C. 2C(H+)=C(Ac-)-C(HAc)
D. C(HAc)+C(Ac-)=0.01mol/L 10.相同温度、相同物质的量浓度的下列各组溶液,按pH依次减小的顺序排列正确的是( )
A. NaHSO4 NaCl CH3COONa Na2CO3
B.HCl CH3COOH NH4Cl NaHCO3
C. H2SO4 HCl NaOH Ba(OH)2
D.NH4Cl CH3COOH NaHSO4 H2SO4D11.25℃时1mo/L的(NH4)2SO4 、(NH4)2CO3、(NH4)2Fe(SO4)2 、NH4Cl、NH4HSO4溶液中,NH4+由大到小的顺序为:(NH4)2Fe(SO4)2>(NH4)2SO4> (NH4)2CO3>NH4HSO4> NH4Cl双水解反应(1)直接写出最终产物,用”= ↑ ↓”。
(2)反应物中有H无水,无H有水。
(3)配平时先利用电荷守恒,再配其它。Al3+(CO32-、HCO3-、S2-、AlO2-)
Fe3+( CO32-、HCO3-、 AlO2-)
5、将0.3mol/L的KOH溶液与0.1 mol/L 的H3PO4溶液等体积混合,溶液中各种微粒间关系正确的是 ( ) A.c(K+)+c(H+)=c(OH-)+c(H2PO4-) + c(HPO42-) +c(PO43-) B .c(OH-) = c(H+) + c(HPO42-) + 2c(H2PO4-) + 3c(H3PO4 ) C. c(K+) >c(PO43-) >c(HPO42-) > c(H2PO4-) > c(H3PO4 ) D. c(H3PO4 ) + c(H2PO4-) + c(HPO42-) +c(PO43-)=0.1mol/LB C经验指导:1、离子因电离或水解,浓度减小;但电离与水解均是微弱的。
2、多元弱酸根离子分步水解程度逐步减弱,水解形成的相应微粒浓度也相应减小。
3、酸性盐溶液中[H+]小于水解离子浓度,大于水解形成的相应微粒浓度,而[OH-]一般最小。
4、碱性盐溶液中,[OH-]小于水解离子浓度,大于水解形成的相应微粒浓度,而[H+]一般最小。
