第四章第四节第1课时 氨 同步辅导与测试
文档属性
| 名称 | 第四章第四节第1课时 氨 同步辅导与测试 |  | |
| 格式 | rar | ||
| 文件大小 | 220.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-14 20:56:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第四章 非金属及其化合物
第四节 氨 硝酸 硫酸
第1课时 氨
一、氨
1.氨的物理性质
(1)色、态、味:无色、刺激性气味气体
(2)密度:比空气小
(3)溶解性:极易溶于水,常温常压下,1体积水溶解700体积NH3
(4)易液化
2.氨的化学性质
(1)与水的反应:
NH3+H2O=]NH3·H2O)]NH+OH-(用湿润的红色石蕊试纸检验NH3),氨水具有弱碱性、不稳定性。
(2)与酸的反应:
①挥发性酸:NH3+HCl=NH4Cl(白烟),可用浓HCl检验NH3;
NH3+HNO3=NH4NO3(白烟);
②难挥发性酸:2NH3+H2SO4=(NH4)2SO4(无白烟);
③不稳定性酸:NH3+H2O+CO2=NH4HCO3或2NH3+H2O+CO2=(NH4)2CO3。
(3)与氧气的反应:
4NH3+5O2=催化剂4NO+6H2O(制HNO3基础)。
3.氨的实验室制法
(1)原理:2NH4Cl+Ca(OH)=△CaCl2+2NH3↑+2H2O。
(2)装置:同制O2,固+固△气。
(3)收集:向下排空气法(试管口塞团棉花)。
(4)干燥:用碱石灰,不用CaCl2、P2O5、浓H2SO4。
(5)检满:用湿润的红色石蕊试纸或浓HCl。
(6)尾气处理:用水或稀H2SO4吸收并防倒吸。
4.铵盐
△
(1)受热易分解:NH4C=]NH3↑+HCl↑,不同于升华。
△
(2)与碱反应:NH4NO3+NaOH=NH3↑+NaNO3+H2O(用于NH检验)。
5.氨的用途:
(1)工业原料:制HNO3、铵盐、纯碱等。
(2)致冷剂。
1.制取氨气并完成喷泉实验(图中夹持装置均已略去)
(1)写出实验室制取氨气的化学方程式__________________________。
(2)收集氨气应使用________法,要得到干燥的氨气可选用________做干燥剂。
(3)用图中Ⅰ装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发喷泉的操作是________________________________。
(4)如果只提供如图中Ⅱ的装置,请说明引发喷泉的方法__________________________________________。
△
答案 (1)2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰 (3)打开止水夹,挤出胶头滴管中的水 (4)打开止水夹,用手(或热毛巾等)将烧瓶焐热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉反应。
解析 (1)实验室制取NH3通常是用NH4Cl和Ca(OH)2加热制取;(2)收集NH3用向下排空气法,干燥氨气不用P2O5、浓H2SO4和CaCl2,而用碱石灰;(3)和(4)产生喷泉原理相同,即NH3因大量溶于水造成烧瓶内外压强差,本题关键是如何使气体与H2O接触造成大量NH3溶于水,产生烧瓶内外压强差。如加热使烧瓶内的气体膨胀赶出导管中的空气,使NH3与水接触。
规律技巧 能够产生喷泉实验的根本原因是由于气体迅速溶于液体中(或反应)使烧瓶内外气体产生压强差,而形成压强差的方法主要有两种情况:一是让烧瓶内气体大量溶于水或溶液,引起烧瓶内气压迅速减小,在大气压作用下,烧杯中液体进入烧瓶形成喷泉;二是烧瓶内压强不变,想法增大密闭容器中液体的压强,从而压入烧瓶内而形成喷泉。
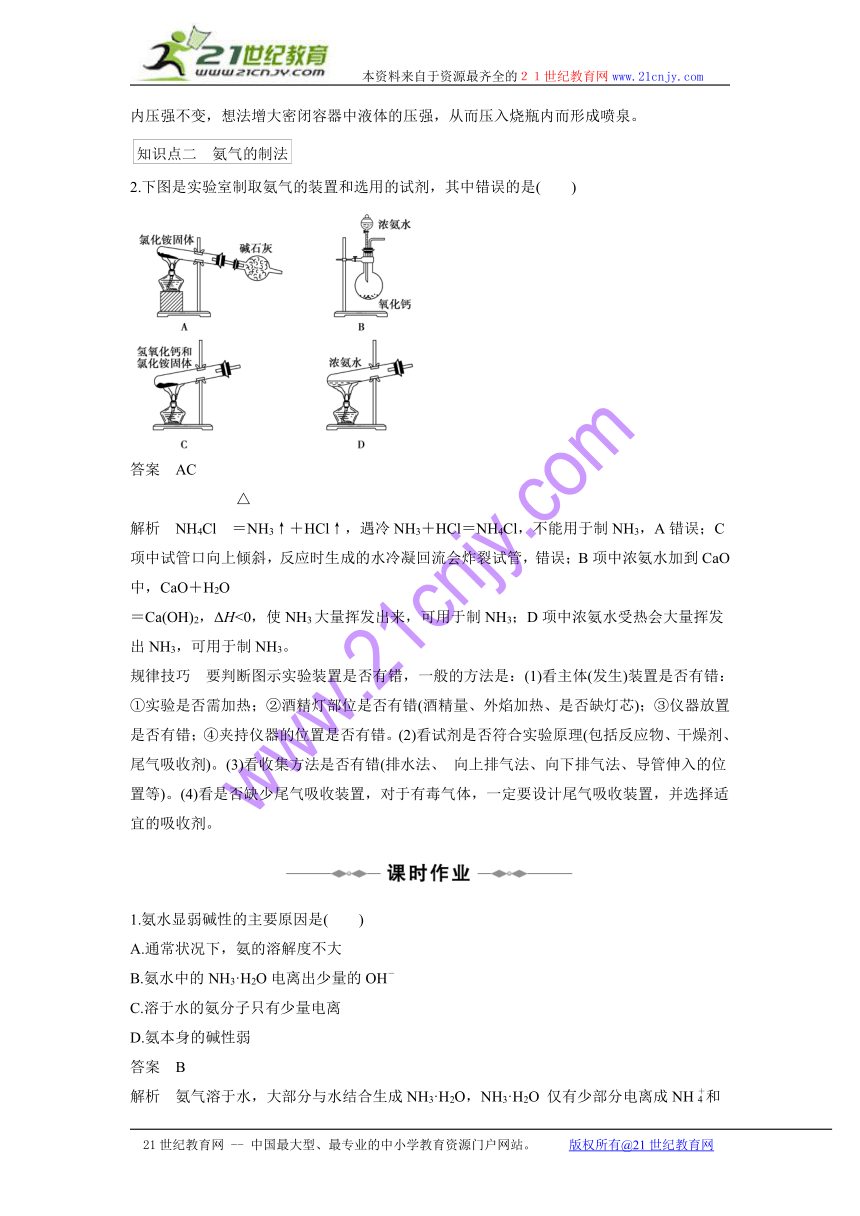
2.下图是实验室制取氨气的装置和选用的试剂,其中错误的是( )
答案 AC
△
解析 NH4Cl =NH3↑+HCl↑,遇冷NH3+HCl=NH4Cl,不能用于制NH3,A错误;C项中试管口向上倾斜,反应时生成的水冷凝回流会炸裂试管,错误;B项中浓氨水加到CaO中,CaO+H2O
=Ca(OH)2,ΔH<0,使NH3大量挥发出来,可用于制NH3;D项中浓氨水受热会大量挥发出NH3,可用于制NH3。
规律技巧 要判断图示实验装置是否有错,一般的方法是:(1)看主体(发生)装置是否有错:①实验是否需加热;②酒精灯部位是否有错(酒精量、外焰加热、是否缺灯芯);③仪器放置是否有错;④夹持仪器的位置是否有错。(2)看试剂是否符合实验原理(包括反应物、干燥剂、尾气吸收剂)。(3)看收集方法是否有错(排水法、 向上排气法、向下排气法、导管伸入的位置等)。(4)看是否缺少尾气吸收装置,对于有毒气体,一定要设计尾气吸收装置,并选择适宜的吸收剂。
1.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量的OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
答案 B
解析 氨气溶于水,大部分与水结合生成NH3·H2O,NH3·H2O 仅有少部分电离成NH和OH-,因此显弱碱性,它既不是因为氨的溶解度不大,也不是因为氨分子电离的少(在水溶液里氨分子是不电离的),更不是因为氨本身碱性弱(氨不与水反应时无碱性)。
2.检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,用湿润的红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞试液
D.加入苛性钠溶液,加热,用湿润的红色石蕊试纸放在试管口检验
答案 D
解析 检验铵盐的方法是利用了铵盐与碱反应生成氨气及氨气的性质,把NaOH溶液加到某物质的固体或溶液里,加热后产生的气体能使湿润的红色石蕊试纸变蓝,就可以判断该物质是铵盐。
3.关于氨的下列叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
答案 C
解析 氨水不稳定,易分解生成NH3和H2O。
4.在实验室里可用如图所示装置来干燥和收集气体R,多余的气体可用水来吸收,则R是( )
A.NO2
B.HCl
C.CH4
D.NH3
答案 D
解析 分析题图所示装置,收集储存气体R时,储气瓶的进气管短、出气管长,说明气体R的密度比空气的小,A、B不正确。因为多余的R气体可用水吸收,该气体应易溶于水,故R为NH3。
备考资源 如图所示的装置中,烧瓶中充满了干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c呈喷泉状喷出,最终几乎充满烧瓶,则a和c分别是( )
a(干燥气体) c(液体)
A NO2 水
B CO2 4 mol/L HCl溶液
C Cl2 饱和NaCl溶液
D NH3 1 mol/L盐酸
答案 D
解析 A项:3NO2+H2O=2HNO3+NO,能形成喷泉,但水不能充满烧瓶;B项CO2不能溶于HCl;C项Cl2不溶于饱和NaCl溶液,不能形成喷泉。
5.只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )
A.NaOH溶液 。
B.AgNO3溶液
C.BaCl2溶液 。
D.Ba(OH)2溶液
答案 D
6.下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨气:
△
NH+OH-=NH3↑+H2O
B.NaOH与NH4Cl溶液混合加热:
△
NH+OH-=NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=NH+H2O
D.氨水中通入少量CO2:CO2+2NH3·H2O=2NH+CO+H2O
答案 CD
解析 实验室制氨气为固体反应不能写离子方程式;B项应为NH+OH-
△
=NH3↑+H2O。
备课资源 把a L含(NH4)2SO4和NH4NO3的混合液分成两等份。一份用b mol烧碱刚好把NH3全部赶出;另一份与BaCl2溶液恰好完全反应,消耗c mol BaCl2,则原溶液中c(NO)为( )
A. mol·L-1 。
B. mol·L-1
C. mol·L-1 。
D. mol·L-1
答案 B
解析 依题意知:每一份混合液中n(NH)=b mol;n(SO)=n(BaCl2)=c mol,原溶液中n(NH)为2b mol,n(SO)=2c mol。
(NH4)2SO4=2NH+SO
4c 2c
则由NH4NO3提供的NH为(2b-4c) mol,c(NO)= mol·L-1。
7.资料显示:“氨气可在纯氧中安静的燃烧生成一种无毒的气体”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气。
①大试管内碳酸盐的化学式是 。
②碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热,氨催化氧化生成的产物为NO,写出该反应的化学方程式:________________;试管内气体变为红棕色,该反应的化学方程式是 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,
其理由是 。
②氨气燃烧的化学方程式是 。
答案 (1)①(NH4)2CO3[或NH4HCO3]
②吸收水和CO2
催化剂
(2)4NH3+5O2=4NO+6H2O
2NO+O2=2NO2
(3) ①应先通入O2,后通入NH3 若先通氨气,氨在空气中不能点燃,逸出污染环境
点燃
②4NH3+3O2=2N2+6H2O
8.
某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是______溶液,加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液,加热时溶液由无色变为红色的原因是 。
答案 (1)稀氨水和酚酞 氨水显碱性,使酚酞变红,加热时氨逸出,颜色变浅
(2)溶有SO2的品红 溶解的SO2表现漂白性,使品红褪色,加热,SO2挥发,品红又恢复了原来的红色
解析 (1)原溶液是红色溶液,受热颜色变浅是此种物质以气态挥发所引起的。常见的具有碱性的气体是氨气,氨气在水中呈碱性,可使酚酞变红,氨气减少,颜色变浅,故原溶液是稀氨水和酚酞。
(2)原溶液是无色溶液,受热溶液显红色,同上题分析,这里原溶液是亚硫酸和品红溶液。
9.下图甲和乙是某学校王老师制备NH3并进行性质实验时的改进装置:
(Ⅰ)按图甲把仪器安装好,称取2 g固体氯化铵装入试管底部,再快速称取2 g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2 mL浓氨水);烧杯内盛滴有酚酞试液的水;把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡。
(Ⅱ)将(Ⅰ)中收集满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2 mL H2O,此时小气球系在玻璃棒上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:
(1)中学化学教材中是用氯化铵与氢氧化钙加热制取NH3,该反应的化学方程式为______________________________。
(2)图甲中的NH4Cl与NaOH固体混合能否用CaO固体代替?________(填“能”或“不能)
(3)如何判断图甲中烧瓶已收集满NH3? 。
(4)乙中胶头滴管中的水挤入烧瓶后,观察到的现象是____________________,它说明了NH3______________________________。
△
答案 (1)Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O (2)能 (3)烧杯内的溶液变红 (4)气球逐渐变大
极易溶于水
解析 CaO吸水放热,解释同用NaOH固体。
10.已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
(1)D的化学式(分子式)是 ,
E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是______________。
(3)E和F反应生成D、H和G的化学方程式是 。
答案 (1)NH3 NH4Cl
点燃
(2)H2+Cl2=2HCl
△
(3)2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
命题意图 本题综合考查了H2与Cl2的反应、NH3与HCl的反应以及NH3的实验室制法等知识。
解析 仔细观察分析E、G为此题的突破口。A、B、C、D均为气体,生成E是固体,E与F反应的产物中又出现D;G为CaCl2,可知CaCl2中的氯元素来自反应物E中,根据元素化合物知识可确定E为盐类,由非金属元素组成的盐即为NH4Cl,则D为NH3。根据氨的实验室制法可知F为Ca(OH)2,H为H2O,C为HCl。
备课资源 利用如图所示装置和其他必要的仪器用品,完成下列实验。
△
证明氨气具有还原性。已知:2NH3+3CuO=N2+3Cu+3H2O。
(1)碱石灰的作用是__________________,稀硫酸的作用是____________________。
(2)烧瓶中固体NaOH可以用________代替。(填写代号)
A.碱石灰 B.氯化钠 C.生石灰
(3)证明NH3具有还原性的实验现象是______________。
(4)上述装置有一不当之处,请在下面虚线框中画出改进部分的装置图。
答案 (1)吸收水蒸气(或吸水、作为干燥剂) 吸收氨气,防止污染 (2)AC (3)黑色粉末变为红色,有无色液滴产生
(4)如图
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第四章 非金属及其化合物
第四节 氨 硝酸 硫酸
第1课时 氨
一、氨
1.氨的物理性质
(1)色、态、味:无色、刺激性气味气体
(2)密度:比空气小
(3)溶解性:极易溶于水,常温常压下,1体积水溶解700体积NH3
(4)易液化
2.氨的化学性质
(1)与水的反应:
NH3+H2O=]NH3·H2O)]NH+OH-(用湿润的红色石蕊试纸检验NH3),氨水具有弱碱性、不稳定性。
(2)与酸的反应:
①挥发性酸:NH3+HCl=NH4Cl(白烟),可用浓HCl检验NH3;
NH3+HNO3=NH4NO3(白烟);
②难挥发性酸:2NH3+H2SO4=(NH4)2SO4(无白烟);
③不稳定性酸:NH3+H2O+CO2=NH4HCO3或2NH3+H2O+CO2=(NH4)2CO3。
(3)与氧气的反应:
4NH3+5O2=催化剂4NO+6H2O(制HNO3基础)。
3.氨的实验室制法
(1)原理:2NH4Cl+Ca(OH)=△CaCl2+2NH3↑+2H2O。
(2)装置:同制O2,固+固△气。
(3)收集:向下排空气法(试管口塞团棉花)。
(4)干燥:用碱石灰,不用CaCl2、P2O5、浓H2SO4。
(5)检满:用湿润的红色石蕊试纸或浓HCl。
(6)尾气处理:用水或稀H2SO4吸收并防倒吸。
4.铵盐
△
(1)受热易分解:NH4C=]NH3↑+HCl↑,不同于升华。
△
(2)与碱反应:NH4NO3+NaOH=NH3↑+NaNO3+H2O(用于NH检验)。
5.氨的用途:
(1)工业原料:制HNO3、铵盐、纯碱等。
(2)致冷剂。
1.制取氨气并完成喷泉实验(图中夹持装置均已略去)
(1)写出实验室制取氨气的化学方程式__________________________。
(2)收集氨气应使用________法,要得到干燥的氨气可选用________做干燥剂。
(3)用图中Ⅰ装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发喷泉的操作是________________________________。
(4)如果只提供如图中Ⅱ的装置,请说明引发喷泉的方法__________________________________________。
△
答案 (1)2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰 (3)打开止水夹,挤出胶头滴管中的水 (4)打开止水夹,用手(或热毛巾等)将烧瓶焐热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉反应。
解析 (1)实验室制取NH3通常是用NH4Cl和Ca(OH)2加热制取;(2)收集NH3用向下排空气法,干燥氨气不用P2O5、浓H2SO4和CaCl2,而用碱石灰;(3)和(4)产生喷泉原理相同,即NH3因大量溶于水造成烧瓶内外压强差,本题关键是如何使气体与H2O接触造成大量NH3溶于水,产生烧瓶内外压强差。如加热使烧瓶内的气体膨胀赶出导管中的空气,使NH3与水接触。
规律技巧 能够产生喷泉实验的根本原因是由于气体迅速溶于液体中(或反应)使烧瓶内外气体产生压强差,而形成压强差的方法主要有两种情况:一是让烧瓶内气体大量溶于水或溶液,引起烧瓶内气压迅速减小,在大气压作用下,烧杯中液体进入烧瓶形成喷泉;二是烧瓶内压强不变,想法增大密闭容器中液体的压强,从而压入烧瓶内而形成喷泉。
2.下图是实验室制取氨气的装置和选用的试剂,其中错误的是( )
答案 AC
△
解析 NH4Cl =NH3↑+HCl↑,遇冷NH3+HCl=NH4Cl,不能用于制NH3,A错误;C项中试管口向上倾斜,反应时生成的水冷凝回流会炸裂试管,错误;B项中浓氨水加到CaO中,CaO+H2O
=Ca(OH)2,ΔH<0,使NH3大量挥发出来,可用于制NH3;D项中浓氨水受热会大量挥发出NH3,可用于制NH3。
规律技巧 要判断图示实验装置是否有错,一般的方法是:(1)看主体(发生)装置是否有错:①实验是否需加热;②酒精灯部位是否有错(酒精量、外焰加热、是否缺灯芯);③仪器放置是否有错;④夹持仪器的位置是否有错。(2)看试剂是否符合实验原理(包括反应物、干燥剂、尾气吸收剂)。(3)看收集方法是否有错(排水法、 向上排气法、向下排气法、导管伸入的位置等)。(4)看是否缺少尾气吸收装置,对于有毒气体,一定要设计尾气吸收装置,并选择适宜的吸收剂。
1.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量的OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
答案 B
解析 氨气溶于水,大部分与水结合生成NH3·H2O,NH3·H2O 仅有少部分电离成NH和OH-,因此显弱碱性,它既不是因为氨的溶解度不大,也不是因为氨分子电离的少(在水溶液里氨分子是不电离的),更不是因为氨本身碱性弱(氨不与水反应时无碱性)。
2.检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,用湿润的红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞试液
D.加入苛性钠溶液,加热,用湿润的红色石蕊试纸放在试管口检验
答案 D
解析 检验铵盐的方法是利用了铵盐与碱反应生成氨气及氨气的性质,把NaOH溶液加到某物质的固体或溶液里,加热后产生的气体能使湿润的红色石蕊试纸变蓝,就可以判断该物质是铵盐。
3.关于氨的下列叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
答案 C
解析 氨水不稳定,易分解生成NH3和H2O。
4.在实验室里可用如图所示装置来干燥和收集气体R,多余的气体可用水来吸收,则R是( )
A.NO2
B.HCl
C.CH4
D.NH3
答案 D
解析 分析题图所示装置,收集储存气体R时,储气瓶的进气管短、出气管长,说明气体R的密度比空气的小,A、B不正确。因为多余的R气体可用水吸收,该气体应易溶于水,故R为NH3。
备考资源 如图所示的装置中,烧瓶中充满了干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c呈喷泉状喷出,最终几乎充满烧瓶,则a和c分别是( )
a(干燥气体) c(液体)
A NO2 水
B CO2 4 mol/L HCl溶液
C Cl2 饱和NaCl溶液
D NH3 1 mol/L盐酸
答案 D
解析 A项:3NO2+H2O=2HNO3+NO,能形成喷泉,但水不能充满烧瓶;B项CO2不能溶于HCl;C项Cl2不溶于饱和NaCl溶液,不能形成喷泉。
5.只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )
A.NaOH溶液 。
B.AgNO3溶液
C.BaCl2溶液 。
D.Ba(OH)2溶液
答案 D
6.下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨气:
△
NH+OH-=NH3↑+H2O
B.NaOH与NH4Cl溶液混合加热:
△
NH+OH-=NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=NH+H2O
D.氨水中通入少量CO2:CO2+2NH3·H2O=2NH+CO+H2O
答案 CD
解析 实验室制氨气为固体反应不能写离子方程式;B项应为NH+OH-
△
=NH3↑+H2O。
备课资源 把a L含(NH4)2SO4和NH4NO3的混合液分成两等份。一份用b mol烧碱刚好把NH3全部赶出;另一份与BaCl2溶液恰好完全反应,消耗c mol BaCl2,则原溶液中c(NO)为( )
A. mol·L-1 。
B. mol·L-1
C. mol·L-1 。
D. mol·L-1
答案 B
解析 依题意知:每一份混合液中n(NH)=b mol;n(SO)=n(BaCl2)=c mol,原溶液中n(NH)为2b mol,n(SO)=2c mol。
(NH4)2SO4=2NH+SO
4c 2c
则由NH4NO3提供的NH为(2b-4c) mol,c(NO)= mol·L-1。
7.资料显示:“氨气可在纯氧中安静的燃烧生成一种无毒的气体”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气。
①大试管内碳酸盐的化学式是 。
②碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热,氨催化氧化生成的产物为NO,写出该反应的化学方程式:________________;试管内气体变为红棕色,该反应的化学方程式是 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,
其理由是 。
②氨气燃烧的化学方程式是 。
答案 (1)①(NH4)2CO3[或NH4HCO3]
②吸收水和CO2
催化剂
(2)4NH3+5O2=4NO+6H2O
2NO+O2=2NO2
(3) ①应先通入O2,后通入NH3 若先通氨气,氨在空气中不能点燃,逸出污染环境
点燃
②4NH3+3O2=2N2+6H2O
8.
某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是______溶液,加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液,加热时溶液由无色变为红色的原因是 。
答案 (1)稀氨水和酚酞 氨水显碱性,使酚酞变红,加热时氨逸出,颜色变浅
(2)溶有SO2的品红 溶解的SO2表现漂白性,使品红褪色,加热,SO2挥发,品红又恢复了原来的红色
解析 (1)原溶液是红色溶液,受热颜色变浅是此种物质以气态挥发所引起的。常见的具有碱性的气体是氨气,氨气在水中呈碱性,可使酚酞变红,氨气减少,颜色变浅,故原溶液是稀氨水和酚酞。
(2)原溶液是无色溶液,受热溶液显红色,同上题分析,这里原溶液是亚硫酸和品红溶液。
9.下图甲和乙是某学校王老师制备NH3并进行性质实验时的改进装置:
(Ⅰ)按图甲把仪器安装好,称取2 g固体氯化铵装入试管底部,再快速称取2 g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2 mL浓氨水);烧杯内盛滴有酚酞试液的水;把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡。
(Ⅱ)将(Ⅰ)中收集满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2 mL H2O,此时小气球系在玻璃棒上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:
(1)中学化学教材中是用氯化铵与氢氧化钙加热制取NH3,该反应的化学方程式为______________________________。
(2)图甲中的NH4Cl与NaOH固体混合能否用CaO固体代替?________(填“能”或“不能)
(3)如何判断图甲中烧瓶已收集满NH3? 。
(4)乙中胶头滴管中的水挤入烧瓶后,观察到的现象是____________________,它说明了NH3______________________________。
△
答案 (1)Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O (2)能 (3)烧杯内的溶液变红 (4)气球逐渐变大
极易溶于水
解析 CaO吸水放热,解释同用NaOH固体。
10.已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
(1)D的化学式(分子式)是 ,
E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是______________。
(3)E和F反应生成D、H和G的化学方程式是 。
答案 (1)NH3 NH4Cl
点燃
(2)H2+Cl2=2HCl
△
(3)2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
命题意图 本题综合考查了H2与Cl2的反应、NH3与HCl的反应以及NH3的实验室制法等知识。
解析 仔细观察分析E、G为此题的突破口。A、B、C、D均为气体,生成E是固体,E与F反应的产物中又出现D;G为CaCl2,可知CaCl2中的氯元素来自反应物E中,根据元素化合物知识可确定E为盐类,由非金属元素组成的盐即为NH4Cl,则D为NH3。根据氨的实验室制法可知F为Ca(OH)2,H为H2O,C为HCl。
备课资源 利用如图所示装置和其他必要的仪器用品,完成下列实验。
△
证明氨气具有还原性。已知:2NH3+3CuO=N2+3Cu+3H2O。
(1)碱石灰的作用是__________________,稀硫酸的作用是____________________。
(2)烧瓶中固体NaOH可以用________代替。(填写代号)
A.碱石灰 B.氯化钠 C.生石灰
(3)证明NH3具有还原性的实验现象是______________。
(4)上述装置有一不当之处,请在下面虚线框中画出改进部分的装置图。
答案 (1)吸收水蒸气(或吸水、作为干燥剂) 吸收氨气,防止污染 (2)AC (3)黑色粉末变为红色,有无色液滴产生
(4)如图
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
