第一章第一节第3课时 混合物的分离与提纯-蒸馏与萃取 同步辅导与测试
文档属性
| 名称 | 第一章第一节第3课时 混合物的分离与提纯-蒸馏与萃取 同步辅导与测试 |  | |
| 格式 | rar | ||
| 文件大小 | 178.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-14 20:56:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一章 从实验学化学
第一节 化学实验基本方法
第3课时 混合物的分离与提纯——蒸馏与萃取
三、蒸馏与萃取
1.蒸馏
(1)适用范围:分离或提纯不同沸点液体互溶混合物的方法
(2)主要仪器:蒸馏烧瓶、冷凝管、牛角管、锥形瓶、酒精灯、石棉网、铁架台、温度计
(3)Cl-的检验:AgNO3溶液和稀HNO3
2.萃取
(1)萃取原理:利用溶质在互不相溶的溶剂里溶解性的不同,将溶质从溶解度小的溶剂转移到溶解度较大的溶剂中的操作。
(2)萃取剂选择
①与另一溶剂互不相溶
②溶解溶质的能力比另一溶剂大得多
③不与被萃取物质反应
(3)用CCl4萃取碘水中的碘
①加萃取剂
②混合振荡
③静置
④分液
3.分液
(1)适用范围:分离两种互不相溶液体
(2)主要仪器:分液漏斗
1.将所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,可以得到汽油和煤油。
(1)图中A、B、C三种仪器的名称是: 、 、 。
(2)A仪器中c是 ,d是 。
(3)蒸馏时,温度计水银球应在 位置。
(4)在B中注入原油后,加几片碎瓷片的目的是 。
答案 (1)冷凝管 蒸馏烧瓶 锥形瓶 (2)进水口 出水口 (3)蒸馏烧瓶支管口处
(4)防止暴沸
解析 本题考查的是蒸馏装置的相关问题,冷凝管冷凝时为了达到好的冷凝效果应下口进水上口出水;因测的是石油蒸气的温度,所以水银球应在支管口处;加入几片碎瓷片可防止暴沸。
2.在使用分液漏斗进行分液时,正确的操作是( )
A.上层液体经漏斗下方活塞放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,分液漏斗上的小孔与大气相通时打开活塞
D.分液漏斗中盛装的是液体,振荡后不必扭开旋塞把气体放出
答案 C
解析 为确保分离效果,下层液体由漏斗下口放出,上层液体要经漏斗上口倒出;振荡分液漏斗要拿在手里,分离液体时,分液漏斗要固定在铁架台的铁圈上;分液时,磨口塞上的凹槽与漏斗口颈上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体才能够顺利流出;振荡分液漏斗时可能有气体产生,应及时扭开活塞放出,以释放漏斗内的压力。应选C。
归纳提醒 ①放气是确保萃取实验安全的重要一步。放气的时候,颈部向上翘,左手轻轻旋动活塞,切记,不要对着自己或其他人放气,以免气流带出来的液体伤到自己或他人。在一些使用特殊萃取剂(如乙醚)的萃取实验中,因忽视放气而酿成爆炸事故也时有发生。
②分液时注意内外压强一致,保证分液漏斗中的液体能够顺利流出。
③分液时等下层液体恰好流出时及时关闭活塞,上层液体应从上口转移到另一烧杯中。
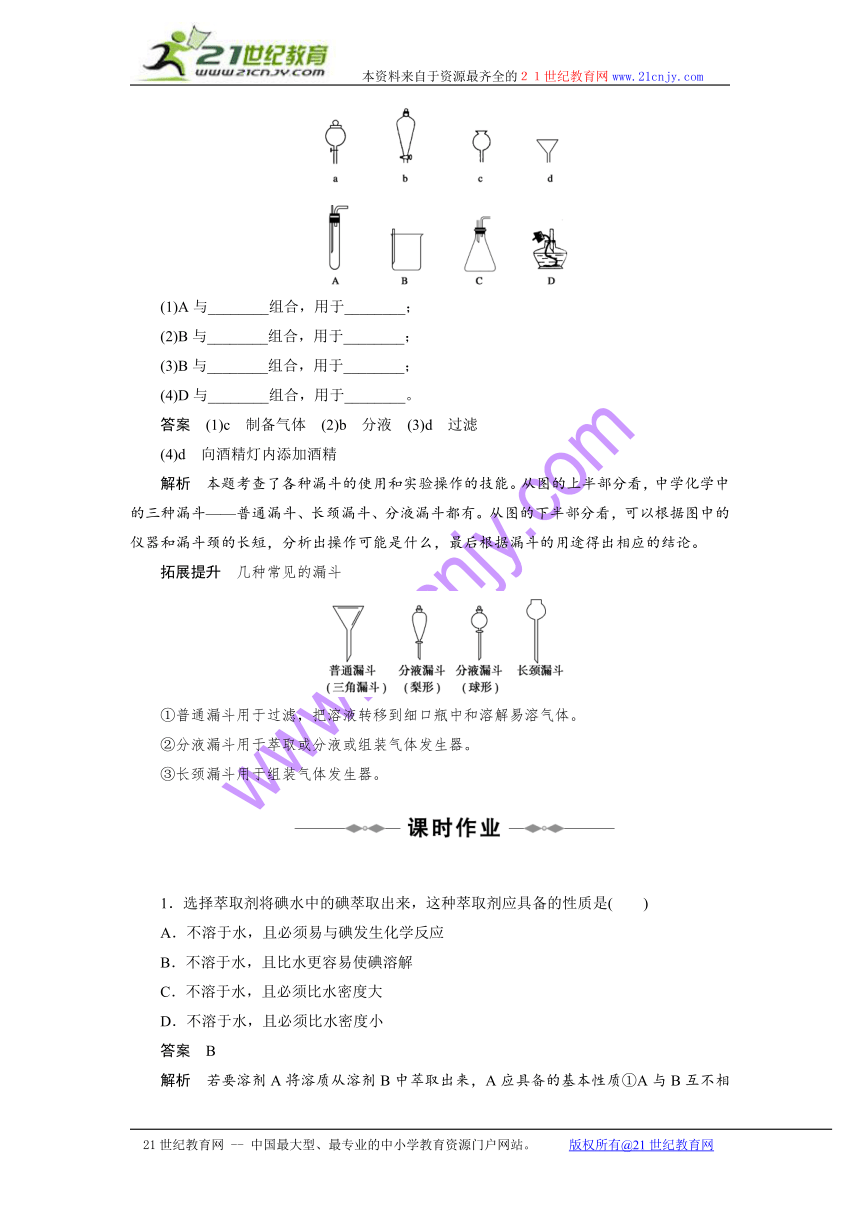
3.如下图所示,a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。
(1)A与________组合,用于________;
(2)B与________组合,用于________;
(3)B与________组合,用于________;
(4)D与________组合,用于________。
答案 (1)c 制备气体 (2)b 分液 (3)d 过滤
(4)d 向酒精灯内添加酒精
解析 本题考查了各种漏斗的使用和实验操作的技能。从图的上半部分看,中学化学中的三种漏斗——普通漏斗、长颈漏斗、分液漏斗都有。从图的下半部分看,可以根据图中的仪器和漏斗颈的长短,分析出操作可能是什么,最后根据漏斗的用途得出相应的结论。
拓展提升 几种常见的漏斗
①普通漏斗用于过滤,把溶液转移到细口瓶中和溶解易溶气体。
②分液漏斗用于萃取或分液或组装气体发生器。
③长颈漏斗用于组装气体发生器。
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
答案 B
解析 若要溶剂A将溶质从溶剂B中萃取出来,A应具备的基本性质①A与B互不相溶;②溶质在A中的溶解度大于在B中的溶解度;③溶质在A中不发生化学反应。
2.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表所示:
物质 分子式 熔点(℃) 沸点(℃) 密度(g·cm-3) 水中的溶解性
甲 C3H6O2 -98 57.5 0.93 可溶
乙 C4H8O2 -84 77 0.90 可溶
据此,将甲和乙分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
答案 C
解析 由表可知,甲、乙常温下是液体,分离两种互溶液态混合物(沸点相差20℃)可用蒸馏法,故采用蒸馏方法分离甲和乙。
3.下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
答案 D
解析 下层液体从下口流出,等下层液体恰好流完后,上层液体应从上口倒入另一容器中。
4.已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是( )
A.蒸馏 B.分液
C.过滤 D.蒸发
答案 B
解析 乙酸乙酯与水不互溶,用分液的方法分离最简便。
5.欲从溴水中提取溴单质,应进行的操作是( )
A.萃取 B.蒸馏
C.先萃取分液,后进行蒸馏 D.萃取分液
答案 C
解析 从溴水中提取溴时,因溴易挥发,不可用蒸馏法;因Br2易溶于有机溶剂(如CCl4、汽油等)而微溶于水,故可采用萃取分液的方法,用CCl4先将Br2从水中分离出来,然后蒸馏即可。
6.化学工作者从有机反应RH+Cl2(气)RCl(液)+HCl(气)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是( )
A.蒸馏法 B.水洗分液法
C.升华法 D.有机溶剂萃取法
答案 B
解析 利用HCl易溶于水,而有机物一般难溶于水的特征,采用水洗分液法是最简便易行的方法,应选B项。
方法指导 分离某种混合物所采用的具体方法取决于混合物中各组分的不同性质。
7.要分离下列四组混合物
①饱和食盐水与沙子
②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物
④CCl4液体与甲苯液体的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃)
(1)分离①、②的操作分别为________、________。
(2)分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是________。
(3)上述四组分离时需使用酒精灯的有________和________(填序号)。
答案 (1)过滤 结晶 (2)分液漏斗 (3)② ④
解析 ①中食盐水易溶于水,沙子难溶于水,可用过滤法分离。②中KNO3的溶解度随温度变化很大而NaCl的溶解度随温度变化很小,可用结晶法分离。③中水和汽油互不相溶,采用分液法。④中两种物质互溶,但沸点差异较大,超过20℃,可采用蒸馏法。其中操作②④需用酒精灯。
8.工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下化学反应:CaO+H2O===Ca(OH)2,且生成物不溶于乙醇。
要在实验室中将工业酒精转化为无水乙醇,请回答下列问题:
(1)下列做法中不可取的是(填写代号)( )
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(2)在你选择的需要加热的实验方法中,需用的玻璃仪器,除酒精灯以外,还有________________________________________________________________________
________;在该方法的实验步骤里,紧挨加热之前的操作是______________________________,并且对此要注意的问题是__________________
_________________________。
(3)用酒精灯作热源,在加热过程中要适时调整酒精灯的上下或左右位置,目的是________________________________________________________________________。
答案 (1)B
(2)蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶 向冷凝管内通冷却水 使水从冷凝管的下口进,上口出
(3)使蒸馏烧瓶内的支管口处保持某一恒温
解析 (1)CaO是不溶于酒精、难挥发的固体,酒精是易挥发的液体。因此,可用过滤或蒸馏分离,不用分液。
(2)蒸馏操作中的玻璃仪器,不能答铁架台。在蒸馏操作中,为了确保蒸馏出的蒸气及时得到冷却,要先向冷凝管内通冷却水,然后才能进行加热。为了提高冷却效果,一般采取逆流操作。
(3)进行蒸馏操作时,要根据组分沸点,使蒸馏烧瓶内的支管口处保持恒温。温度的测量靠温度计,温度的调节可通过控制热源的强弱来实现。
9.(1)阅读、分析下列两个材料:
材料一:
材料二:
物质 熔点/℃ 沸点/℃ 密度/g·cm-3 溶解性
乙二醇(C2H6O2) -11.5 198 1.11 易溶于水和乙醇
丙三醇(C3H8O3) 17.9 290 1.26 能跟水、酒精以任意以互溶
回答下列问题(填序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________;
②将乙二醇和丙三醇相互分离的最佳方法是________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是________,化学试剂是________,
最主要的仪器是__________。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是________________________________________________________________________。
答案 (1)①C ②A (2)①萃取 四氯化碳 分液漏斗
②再进行萃取,直到水呈无色,将各项分离出来的含溴的四氯化碳溶液合并
解析 材料一中,根据曲线图知,纯碱和氯化钠在水中的溶解度随温度的变化相差很大。提纯纯碱时,可以先将混合物在较高温度下溶于水形成浓溶液,然后冷却到一定温度,由于纯碱的溶解度随温度降低急剧下降,因此大量纯碱晶体析出,而氯化钠不会析出,再过滤可得纯净的纯碱晶体。材料二中,乙二醇和丙三醇沸点相差很大,可以用蒸馏法分离。材料三中,Br2和I2在溶解性方面很相似,因此可以用CCl4从溴水中萃取Br2。如果提出Br2后,水还有颜色,说明没有萃取完全,可再进行萃取直至水呈无色。
备考资源 利用海洋资源可以获得很多物质,如从海水得到的粗食盐水中可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等。
Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO。提纯的操作步骤和加入试剂的情况如图:
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是 ;
(2)试剂d是 ;判断试剂d已经足量的方法是__________________________;
(3)加入b、c后溶液中发生的化学反应的离子方程式为________________________________________________________________________
________________________________________________________________________;
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到 (填序号),仪器③的名称是 。
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是 (填序号)。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填序号),该仪器名称为 ,向该碘水中加入四氯化碳以提取碘单质的实验操作为 。
答案 Ⅰ.(1)硫酸钡
(2)盐酸 溶液中不再产生气体
(3)Ca2++CO===CaCO3↓,Ba2++CO===BaCO3↓,Mg2++2OH-===Mg(OH)2↓
(4)④ 圆底烧瓶
Ⅱ.②⑤⑥
Ⅲ.① 分液漏斗 萃取
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一章 从实验学化学
第一节 化学实验基本方法
第3课时 混合物的分离与提纯——蒸馏与萃取
三、蒸馏与萃取
1.蒸馏
(1)适用范围:分离或提纯不同沸点液体互溶混合物的方法
(2)主要仪器:蒸馏烧瓶、冷凝管、牛角管、锥形瓶、酒精灯、石棉网、铁架台、温度计
(3)Cl-的检验:AgNO3溶液和稀HNO3
2.萃取
(1)萃取原理:利用溶质在互不相溶的溶剂里溶解性的不同,将溶质从溶解度小的溶剂转移到溶解度较大的溶剂中的操作。
(2)萃取剂选择
①与另一溶剂互不相溶
②溶解溶质的能力比另一溶剂大得多
③不与被萃取物质反应
(3)用CCl4萃取碘水中的碘
①加萃取剂
②混合振荡
③静置
④分液
3.分液
(1)适用范围:分离两种互不相溶液体
(2)主要仪器:分液漏斗
1.将所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,可以得到汽油和煤油。
(1)图中A、B、C三种仪器的名称是: 、 、 。
(2)A仪器中c是 ,d是 。
(3)蒸馏时,温度计水银球应在 位置。
(4)在B中注入原油后,加几片碎瓷片的目的是 。
答案 (1)冷凝管 蒸馏烧瓶 锥形瓶 (2)进水口 出水口 (3)蒸馏烧瓶支管口处
(4)防止暴沸
解析 本题考查的是蒸馏装置的相关问题,冷凝管冷凝时为了达到好的冷凝效果应下口进水上口出水;因测的是石油蒸气的温度,所以水银球应在支管口处;加入几片碎瓷片可防止暴沸。
2.在使用分液漏斗进行分液时,正确的操作是( )
A.上层液体经漏斗下方活塞放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,分液漏斗上的小孔与大气相通时打开活塞
D.分液漏斗中盛装的是液体,振荡后不必扭开旋塞把气体放出
答案 C
解析 为确保分离效果,下层液体由漏斗下口放出,上层液体要经漏斗上口倒出;振荡分液漏斗要拿在手里,分离液体时,分液漏斗要固定在铁架台的铁圈上;分液时,磨口塞上的凹槽与漏斗口颈上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体才能够顺利流出;振荡分液漏斗时可能有气体产生,应及时扭开活塞放出,以释放漏斗内的压力。应选C。
归纳提醒 ①放气是确保萃取实验安全的重要一步。放气的时候,颈部向上翘,左手轻轻旋动活塞,切记,不要对着自己或其他人放气,以免气流带出来的液体伤到自己或他人。在一些使用特殊萃取剂(如乙醚)的萃取实验中,因忽视放气而酿成爆炸事故也时有发生。
②分液时注意内外压强一致,保证分液漏斗中的液体能够顺利流出。
③分液时等下层液体恰好流出时及时关闭活塞,上层液体应从上口转移到另一烧杯中。
3.如下图所示,a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。
(1)A与________组合,用于________;
(2)B与________组合,用于________;
(3)B与________组合,用于________;
(4)D与________组合,用于________。
答案 (1)c 制备气体 (2)b 分液 (3)d 过滤
(4)d 向酒精灯内添加酒精
解析 本题考查了各种漏斗的使用和实验操作的技能。从图的上半部分看,中学化学中的三种漏斗——普通漏斗、长颈漏斗、分液漏斗都有。从图的下半部分看,可以根据图中的仪器和漏斗颈的长短,分析出操作可能是什么,最后根据漏斗的用途得出相应的结论。
拓展提升 几种常见的漏斗
①普通漏斗用于过滤,把溶液转移到细口瓶中和溶解易溶气体。
②分液漏斗用于萃取或分液或组装气体发生器。
③长颈漏斗用于组装气体发生器。
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
答案 B
解析 若要溶剂A将溶质从溶剂B中萃取出来,A应具备的基本性质①A与B互不相溶;②溶质在A中的溶解度大于在B中的溶解度;③溶质在A中不发生化学反应。
2.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表所示:
物质 分子式 熔点(℃) 沸点(℃) 密度(g·cm-3) 水中的溶解性
甲 C3H6O2 -98 57.5 0.93 可溶
乙 C4H8O2 -84 77 0.90 可溶
据此,将甲和乙分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
答案 C
解析 由表可知,甲、乙常温下是液体,分离两种互溶液态混合物(沸点相差20℃)可用蒸馏法,故采用蒸馏方法分离甲和乙。
3.下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
答案 D
解析 下层液体从下口流出,等下层液体恰好流完后,上层液体应从上口倒入另一容器中。
4.已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是( )
A.蒸馏 B.分液
C.过滤 D.蒸发
答案 B
解析 乙酸乙酯与水不互溶,用分液的方法分离最简便。
5.欲从溴水中提取溴单质,应进行的操作是( )
A.萃取 B.蒸馏
C.先萃取分液,后进行蒸馏 D.萃取分液
答案 C
解析 从溴水中提取溴时,因溴易挥发,不可用蒸馏法;因Br2易溶于有机溶剂(如CCl4、汽油等)而微溶于水,故可采用萃取分液的方法,用CCl4先将Br2从水中分离出来,然后蒸馏即可。
6.化学工作者从有机反应RH+Cl2(气)RCl(液)+HCl(气)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是( )
A.蒸馏法 B.水洗分液法
C.升华法 D.有机溶剂萃取法
答案 B
解析 利用HCl易溶于水,而有机物一般难溶于水的特征,采用水洗分液法是最简便易行的方法,应选B项。
方法指导 分离某种混合物所采用的具体方法取决于混合物中各组分的不同性质。
7.要分离下列四组混合物
①饱和食盐水与沙子
②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物
④CCl4液体与甲苯液体的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃)
(1)分离①、②的操作分别为________、________。
(2)分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是________。
(3)上述四组分离时需使用酒精灯的有________和________(填序号)。
答案 (1)过滤 结晶 (2)分液漏斗 (3)② ④
解析 ①中食盐水易溶于水,沙子难溶于水,可用过滤法分离。②中KNO3的溶解度随温度变化很大而NaCl的溶解度随温度变化很小,可用结晶法分离。③中水和汽油互不相溶,采用分液法。④中两种物质互溶,但沸点差异较大,超过20℃,可采用蒸馏法。其中操作②④需用酒精灯。
8.工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下化学反应:CaO+H2O===Ca(OH)2,且生成物不溶于乙醇。
要在实验室中将工业酒精转化为无水乙醇,请回答下列问题:
(1)下列做法中不可取的是(填写代号)( )
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(2)在你选择的需要加热的实验方法中,需用的玻璃仪器,除酒精灯以外,还有________________________________________________________________________
________;在该方法的实验步骤里,紧挨加热之前的操作是______________________________,并且对此要注意的问题是__________________
_________________________。
(3)用酒精灯作热源,在加热过程中要适时调整酒精灯的上下或左右位置,目的是________________________________________________________________________。
答案 (1)B
(2)蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶 向冷凝管内通冷却水 使水从冷凝管的下口进,上口出
(3)使蒸馏烧瓶内的支管口处保持某一恒温
解析 (1)CaO是不溶于酒精、难挥发的固体,酒精是易挥发的液体。因此,可用过滤或蒸馏分离,不用分液。
(2)蒸馏操作中的玻璃仪器,不能答铁架台。在蒸馏操作中,为了确保蒸馏出的蒸气及时得到冷却,要先向冷凝管内通冷却水,然后才能进行加热。为了提高冷却效果,一般采取逆流操作。
(3)进行蒸馏操作时,要根据组分沸点,使蒸馏烧瓶内的支管口处保持恒温。温度的测量靠温度计,温度的调节可通过控制热源的强弱来实现。
9.(1)阅读、分析下列两个材料:
材料一:
材料二:
物质 熔点/℃ 沸点/℃ 密度/g·cm-3 溶解性
乙二醇(C2H6O2) -11.5 198 1.11 易溶于水和乙醇
丙三醇(C3H8O3) 17.9 290 1.26 能跟水、酒精以任意以互溶
回答下列问题(填序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________;
②将乙二醇和丙三醇相互分离的最佳方法是________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是________,化学试剂是________,
最主要的仪器是__________。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是________________________________________________________________________。
答案 (1)①C ②A (2)①萃取 四氯化碳 分液漏斗
②再进行萃取,直到水呈无色,将各项分离出来的含溴的四氯化碳溶液合并
解析 材料一中,根据曲线图知,纯碱和氯化钠在水中的溶解度随温度的变化相差很大。提纯纯碱时,可以先将混合物在较高温度下溶于水形成浓溶液,然后冷却到一定温度,由于纯碱的溶解度随温度降低急剧下降,因此大量纯碱晶体析出,而氯化钠不会析出,再过滤可得纯净的纯碱晶体。材料二中,乙二醇和丙三醇沸点相差很大,可以用蒸馏法分离。材料三中,Br2和I2在溶解性方面很相似,因此可以用CCl4从溴水中萃取Br2。如果提出Br2后,水还有颜色,说明没有萃取完全,可再进行萃取直至水呈无色。
备考资源 利用海洋资源可以获得很多物质,如从海水得到的粗食盐水中可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等。
Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO。提纯的操作步骤和加入试剂的情况如图:
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是 ;
(2)试剂d是 ;判断试剂d已经足量的方法是__________________________;
(3)加入b、c后溶液中发生的化学反应的离子方程式为________________________________________________________________________
________________________________________________________________________;
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到 (填序号),仪器③的名称是 。
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是 (填序号)。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填序号),该仪器名称为 ,向该碘水中加入四氯化碳以提取碘单质的实验操作为 。
答案 Ⅰ.(1)硫酸钡
(2)盐酸 溶液中不再产生气体
(3)Ca2++CO===CaCO3↓,Ba2++CO===BaCO3↓,Mg2++2OH-===Mg(OH)2↓
(4)④ 圆底烧瓶
Ⅱ.②⑤⑥
Ⅲ.① 分液漏斗 萃取
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
