物质的量及其单位-摩尔
图片预览








文档简介
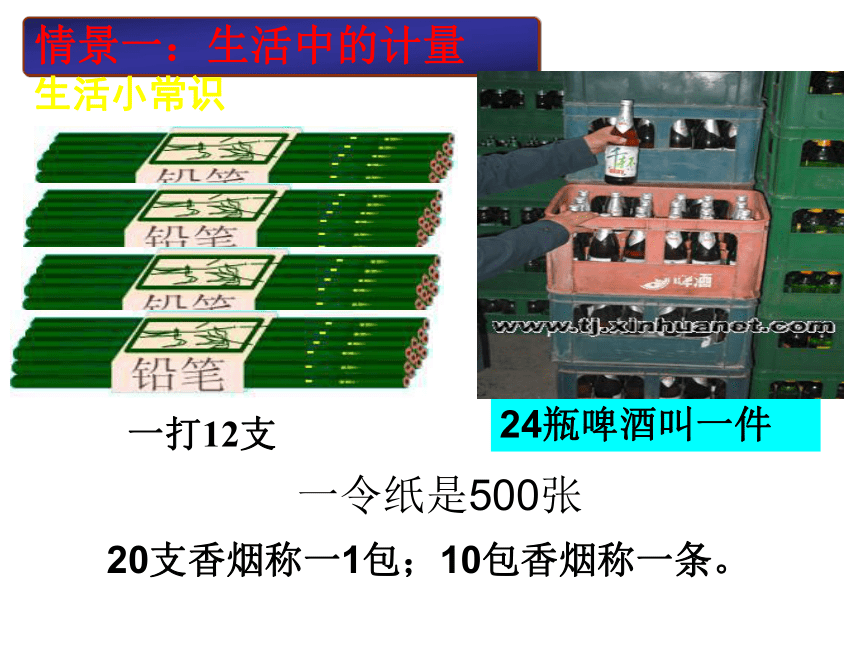
课件33张PPT。欢迎各位老师指导 孝感市实验高中 王锋涛请两位同学分别拿出200个曲别针,比一比看谁能更快的拿出来?
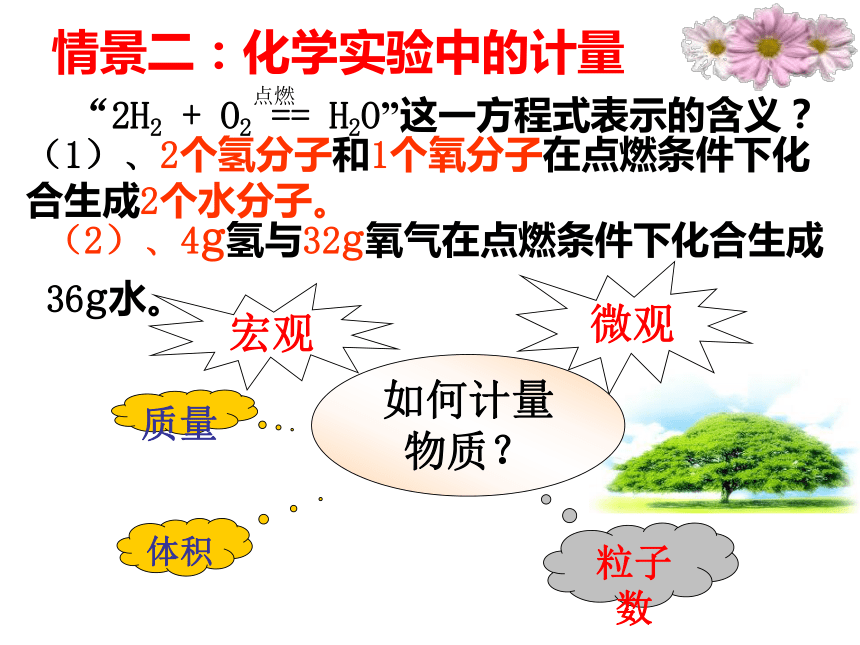
通过“化零为整”,可以达到“化繁为简”积小成大,聚微为宏(1)、2个氢分子和1个氧分子在点燃条件下化合生成2个水分子。(2)、4g氢与32g氧气在点燃条件下化合生成36g水。
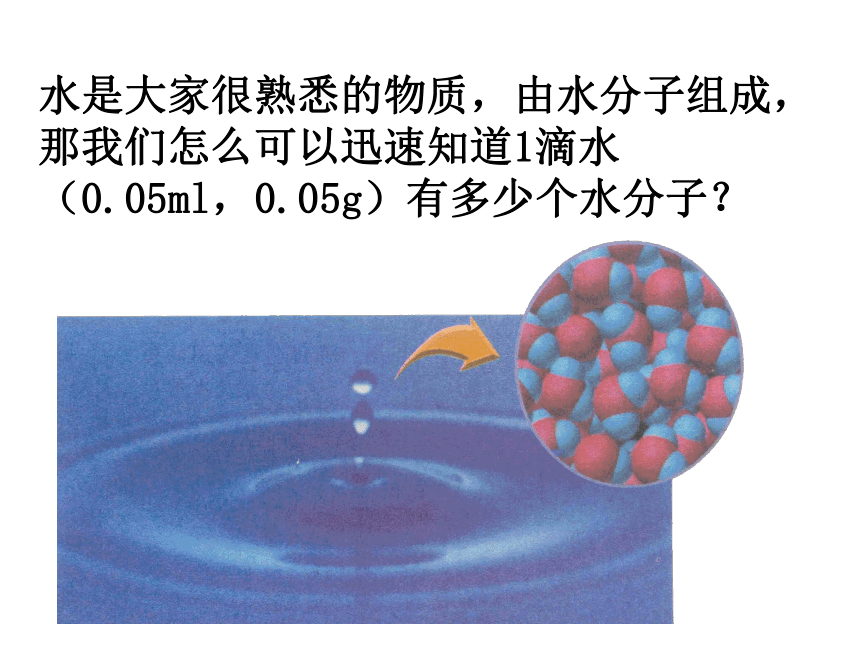
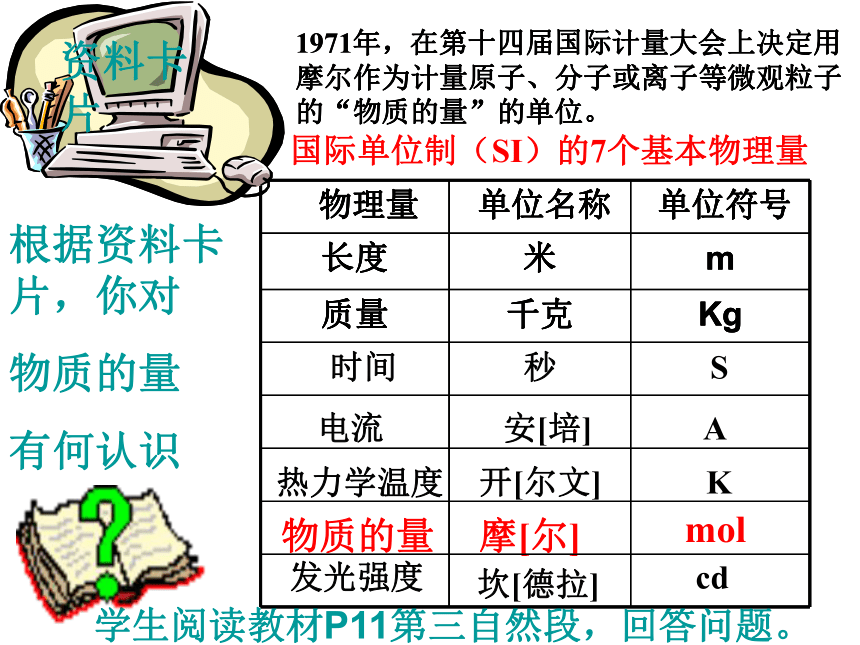
情景二:化学实验中的计量 科学上要建立起一个微观粒子和宏观物质的桥梁。启示:想办法在水分子数和水的质量之间找到一个桥梁 ——-- 集体单位。结论:宏观可称量的物质和微观可数的粒子之间的确存在某种联系。 经科学家反复研究,联系“可称量的物质”和“可数粒子”之间的桥梁是一个物理量,这个物理量就是“物质的量”。第二节 化学计量在实验中的应用物质的量资料物质的量 摩[尔] mol1971年,在第十四届国际计量大会上决定用摩尔作为计量原子、分子或离子等微观粒子的“物质的量”的单位。1971年,在第十四届国际计量大会上决定用摩尔作为计量原子、分子或离子等微观粒子的“物质的量”的单位。1.物质的量 ②是表示含有一定数目微观粒子的集体。④描述的对象是粒子集体。{分子、原子、离子、电子、质子以及它们的特定组合等 ①是国际单位制中的七个基本物理量之一,符号为n 。③物质的量是一个专用名词,四个字是一个整体,不能拆 开理解。不可增添字,也不可减少字。一、物质的量的单位——摩尔 ①是物质的量的单位,符号为mol ,简称摩。②摩尔作为物质的量的单位,这一单位只适用于微观粒子,不适用于宏观物质。③使用摩尔作为单位表示物质的量时,必须指明微粒的种类,如原子、分子、离子等;或者用化学式来表示。如:2 mol H、1 mol H2、1.5 mol NaOH、1 mol OH-、1 mol e-若写成1.5 mol 氢氧化钠溶液 、1 mol氢 等形式就是错误的。 2 .摩 尔概念辨析判断下列说法是否正确,并加以说明理由
⑵使用摩尔表示粒子多少时的时候,一定要用化学式指 明粒子种类。如:1 mol H2、2 molFe、3 molSO42- 1molNa+或n(Na+)=1mol等。⑴物质的量只能用于描述微观粒子的多少,不能用于表示宏观物质。如:I mol人、1 mol大米、1 mol西瓜等表述是不对的。使用物质的量的注意事项3.阿伏加德罗常数⑴定义:NA≈6.02× 1023mol-11mol任何粒子的粒子数叫做阿伏加德罗数。⑵单位:mol-1 (每摩尔)⑶符号:NA 阿伏加德罗常数:12克12c中含有的碳原子数,符号为NA 。1mol物质含有阿伏加德罗常数个微粒。含阿伏加德罗常数个微粒
任何粒子集体计量为1mol感受阿伏加德罗常数 NA----一个惊人的数字约1.7 × 108 年问题:请同学总结物质的量(n)、微粒数(N)、阿伏加德罗常数(NA)之间的换算关系?实践检验4、物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)之间的关系N= n×NA微粒数
(N) ×NA ÷ NA物质的量(n) n与粒子数(N)成正比。注意:一定要指明粒子种类课堂练习:
1、1molO2约含有____________个O2,
_____mol O,约含有__________个O
2、3molH2SO4中约含有________ 个H2SO4,可电离出_______mol H+ ,约为 ________ 个H+
3、2mol NH4+中含有_________mol H,约含有
__________个N。
4、2mol H2O 含有 ________ 个H,含有________个O。(数据比较) 实物图
质量(相对 分子质量)
粒子数
物质的量 1mol H2O 1mol Al图1-12 微观粒子与可称量物质之间存在着一定的联系在数值上相等。5.摩尔质量⑴定义:单位物质的量的物质所具有的质量叫做摩尔质量。⑵单位: g/mol ⑶符号: M⑷数值上等于相对原子(分子)质量.注:摩尔质量(g/mol)与1mol物质的质量(g)在单位上不同。阅读教材第12页,得出结论 《学与问》教材第13页 24.5 g的硫酸的物质的量是多少?1.50 mol碳酸钠的 质量是多少?1.50 mol碳酸钠的 质量是多少? 先公式、后数字;标明每一个量的所属;带单位计算。作业:第17页1、2题 第9页《状元之路》知识小结:摩尔质量单位物质的量的物质所具有的质量。
计算:数值上等于其相对分子质量(式量)
单位:g· mol-1 或 kg· mol-1谢谢指导!
通过“化零为整”,可以达到“化繁为简”积小成大,聚微为宏(1)、2个氢分子和1个氧分子在点燃条件下化合生成2个水分子。(2)、4g氢与32g氧气在点燃条件下化合生成36g水。
情景二:化学实验中的计量 科学上要建立起一个微观粒子和宏观物质的桥梁。启示:想办法在水分子数和水的质量之间找到一个桥梁 ——-- 集体单位。结论:宏观可称量的物质和微观可数的粒子之间的确存在某种联系。 经科学家反复研究,联系“可称量的物质”和“可数粒子”之间的桥梁是一个物理量,这个物理量就是“物质的量”。第二节 化学计量在实验中的应用物质的量资料物质的量 摩[尔] mol1971年,在第十四届国际计量大会上决定用摩尔作为计量原子、分子或离子等微观粒子的“物质的量”的单位。1971年,在第十四届国际计量大会上决定用摩尔作为计量原子、分子或离子等微观粒子的“物质的量”的单位。1.物质的量 ②是表示含有一定数目微观粒子的集体。④描述的对象是粒子集体。{分子、原子、离子、电子、质子以及它们的特定组合等 ①是国际单位制中的七个基本物理量之一,符号为n 。③物质的量是一个专用名词,四个字是一个整体,不能拆 开理解。不可增添字,也不可减少字。一、物质的量的单位——摩尔 ①是物质的量的单位,符号为mol ,简称摩。②摩尔作为物质的量的单位,这一单位只适用于微观粒子,不适用于宏观物质。③使用摩尔作为单位表示物质的量时,必须指明微粒的种类,如原子、分子、离子等;或者用化学式来表示。如:2 mol H、1 mol H2、1.5 mol NaOH、1 mol OH-、1 mol e-若写成1.5 mol 氢氧化钠溶液 、1 mol氢 等形式就是错误的。 2 .摩 尔概念辨析判断下列说法是否正确,并加以说明理由
⑵使用摩尔表示粒子多少时的时候,一定要用化学式指 明粒子种类。如:1 mol H2、2 molFe、3 molSO42- 1molNa+或n(Na+)=1mol等。⑴物质的量只能用于描述微观粒子的多少,不能用于表示宏观物质。如:I mol人、1 mol大米、1 mol西瓜等表述是不对的。使用物质的量的注意事项3.阿伏加德罗常数⑴定义:NA≈6.02× 1023mol-11mol任何粒子的粒子数叫做阿伏加德罗数。⑵单位:mol-1 (每摩尔)⑶符号:NA 阿伏加德罗常数:12克12c中含有的碳原子数,符号为NA 。1mol物质含有阿伏加德罗常数个微粒。含阿伏加德罗常数个微粒
任何粒子集体计量为1mol感受阿伏加德罗常数 NA----一个惊人的数字约1.7 × 108 年问题:请同学总结物质的量(n)、微粒数(N)、阿伏加德罗常数(NA)之间的换算关系?实践检验4、物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)之间的关系N= n×NA微粒数
(N) ×NA ÷ NA物质的量(n) n与粒子数(N)成正比。注意:一定要指明粒子种类课堂练习:
1、1molO2约含有____________个O2,
_____mol O,约含有__________个O
2、3molH2SO4中约含有________ 个H2SO4,可电离出_______mol H+ ,约为 ________ 个H+
3、2mol NH4+中含有_________mol H,约含有
__________个N。
4、2mol H2O 含有 ________ 个H,含有________个O。(数据比较) 实物图
质量(相对 分子质量)
粒子数
物质的量 1mol H2O 1mol Al图1-12 微观粒子与可称量物质之间存在着一定的联系在数值上相等。5.摩尔质量⑴定义:单位物质的量的物质所具有的质量叫做摩尔质量。⑵单位: g/mol ⑶符号: M⑷数值上等于相对原子(分子)质量.注:摩尔质量(g/mol)与1mol物质的质量(g)在单位上不同。阅读教材第12页,得出结论 《学与问》教材第13页 24.5 g的硫酸的物质的量是多少?1.50 mol碳酸钠的 质量是多少?1.50 mol碳酸钠的 质量是多少? 先公式、后数字;标明每一个量的所属;带单位计算。作业:第17页1、2题 第9页《状元之路》知识小结:摩尔质量单位物质的量的物质所具有的质量。
计算:数值上等于其相对分子质量(式量)
单位:g· mol-1 或 kg· mol-1谢谢指导!
