第三节氧化还原反应
图片预览











文档简介
课件47张PPT。2008年9月25日21时10分,长征二号F型运载火箭点火,神舟七号飞船在酒泉卫星发射中心升空。 精彩回放火箭的升空,需要燃料的燃烧。燃料燃烧过程中伴随着很多化学变化和物理变化,伴随着许多能量的转化。今天我们来学习一类重要的化学反应—氧化还原反应第三节
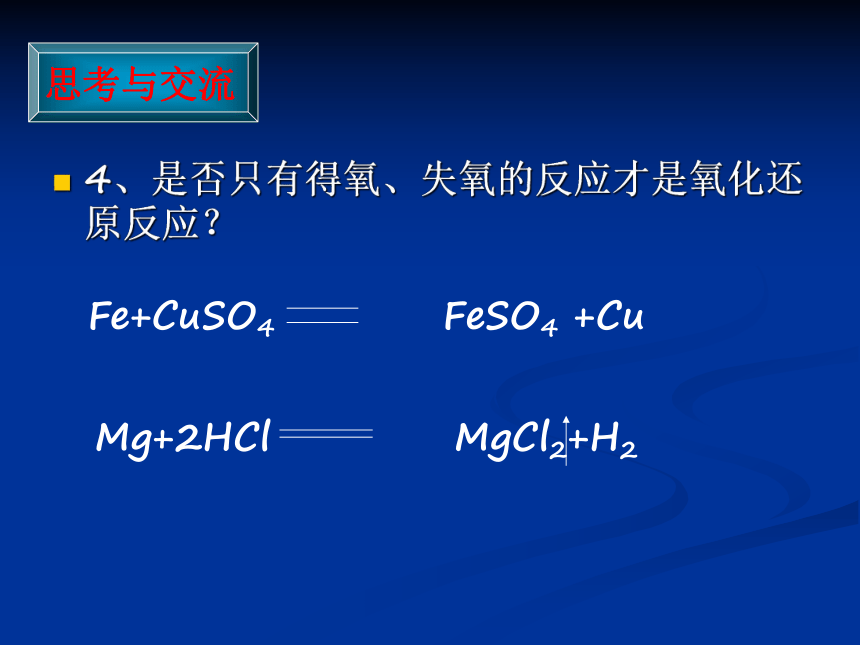
氧化还原反应1.请列举几个氧化反应和还原反应的实例,讨论并交流这类化学反应的分类标准。2.氧化反应和还原反应是分别独立进行的吗?H2得氧,发生氧化反应;CuO失氧,发生还原反应。C得氧,发生氧化反应,CuO失氧发生还原反应。分类标准:得氧失氧氧化还原反应同时存在,同时发生。两者既对立又统一,不能截然分开。3.请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。+200+1化合价降低,被还原(氧化反应)化合价升高,被氧化(还原反应)+200+4化合价降低,被还原化合价升高,被氧化(氧化反应)(还原反应)分析高温结论:得氧失氧—化合价升高—氧化反应—化合价降低—还原反应4、是否只有得氧、失氧的反应才是氧化还原反应?Fe+CuSO4 FeSO4 +CuMg+2HCl MgCl2+H2 ③氧化还原反应:凡有元素化合价升降的化学反应都是氧化还原反应。 ①氧化反应: 物质所含元素化合价升高的反应是氧化反应。 ②还原反应:物质所含元素化合价降低的反应是还原反应。小结1、概念2、判断依据:反应前后是否有元素化合价的改变。
3、特征:反应前后有元素化合价发生改变常见元素化合价H:+1、-1 Li:+1 Be:+2 B:+3 C:-4、+2、+4 N:-3、+1、+2、+3、+4、+5
O:-2 (在过氧根中为-1) F:-1 Na:+1 Mg:+2 Al:+3 Si:+2、+4
P:-3、+3、+5 S:-2、+2、+4、+6 Cl:-1、+1、+3、+5、+7
K:+1 Ca:+2 Fe:+2、+3 Cu:+1、+2 Zn:+2 Mn: +2、+4、+6、+7
Br:=Cl=I Pb:+2、+4 Ag:+1 Au:+3、+5 [练习]表示下列物质中加点元素的化合价
H2SO4 Na2SO3 KMnO4 Fe2O3 O2 K2Cr2O7
N2O5 NH3 HNO3 NH4NO3 KClO3 KClO[小结] 化合价的相关规定:
1、原子失去电子带正电,化合价为正价;原子得到电子带负电,化合价为负价;
2、单质中,元素的化合价为0;
3、金属元素除0价外,只显正价;
4、非金属元素(氟除外)既可显正价,也可显负价;
5、化合物中,正负化合价的代数和为0(化合物中某元素化合价的计算依据)。 练习:下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl =CaCl2 + CO2↑ + H2O
B. Na2O + H2O =2NaOH
C. 2KMnO4 =K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 =Fe3O4
CuSO4·5H2O =CuSO4 + 5H2O
CDE 有人说:有单质参加的化合反应和有单质参加的分解反应全部是氧化还原反应,你认为这些结论合理吗?简述理由?四种基本反应类型与氧化还原反应的关系,试画出交叉分类法示意图?学与问4、分析四种基本类型反应与氧化还原反应之间的关系,并画出它们之间的交叉分类示意图。 √×√×√√×× 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应属于氧化还原反应。结论氧化还原反应与四种基本类型反应的关系:交叉分类图[思考]下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
H2+Cl2 =2HCl[结论]因有化合价升降,所以是氧化还原反应。 可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。[问题]化合价的升降是什么原因引起的? 氧化反应的实质是原子失去电子的过程。 还原反应的实质是原子得到电子的过程。2Na + Cl2 = 2NaCl00+1化合价升高,被氧化化合价降低,被还原-1失电子,得电子,化合价升降的原因:
电子的得失H Clδ+ δ- HCl 在生成的氯化氢分子中,一对共用电子对偏向于Cl原子而偏离于H原子,使H从0→+1价,被氧化,发生氧化反应;同时使Cl从0→-1价被还原,发生还原反应。化学反应的本质是原子之间的重新组合化合价升降原因:电子的偏移H2 + Cl2 = 2HCl00+1化合价升高,被氧化化合价降低,被还原 凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。-1电子对偏离,电子对偏向,一、氧化还原反应◆从得氧失氧角度分析一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。(仅局限于得氧失氧的反应)◆从化合价升降角度分析凡有元素化合价升降的化学反应都是氧化还原反应◆从电子转移角度分析有电子转移(得失或偏移)化学反应是氧化还原反应。(特征, 判断依据)(本质)1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的得失或偏移B D练习二、氧化剂和还原剂 1.氧化剂:得到电子(或电子对偏向)的物质[所含元素化合价降低的物质]2.还原剂:失去电子(或电子对偏离)的物质[所含元素化合价升高的物质]H2 + Cl2 = 2HCl氧化剂还原剂氧化剂还原剂 常见的氧化剂有:
①活泼的非金属单质如:Cl2、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸性KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Zn、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S、亚硫酸盐等。 3.氧化产物和还原产物 氧化产物:还原剂失去电子被氧化后的生成物还原产物:氧化剂得电子被还原后的生成物例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物:
MnO2+ 4HCl=MnCl2 + Cl2 +2H2O4.氧化性和还原性氧化性:氧化剂得电子的性质(或称氧化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性1、下列变化需要加入还原剂的是( )
A.Fe2O3 → Fe B.C → CO2
C.Na2CO3 → CO2 D.Al → Al2O3AC练习几个概念间的关系:小结氧化还原反应中各概念之间的关系可以表示如下:氧化剂 + 还原剂 还原产物 + 氧化产物失去电子,化合价升高,发生氧化反应得到电子,化合价降低,发生还原反应升失氧氧还, 降得还还氧Zn + 2HCl = ZnCl2 + H2↑ 0 +1 +2 0失2e-,化合价升高,被氧化得2×e-,化合价降低,被还原氧化剂:HCl 还原产物:H2
还原剂:Zn 氧化产物:ZnCl2[思考与探究] 标出下列反应中化合价发生改变的元素的化合价,并指出:还原剂、氧化剂在反应中电子转移的数目、化合价升降情况以及在反应中被氧化还是被还原[思考与交流] 综合以上练习,请总结归纳“双线桥”法描述氧化还原反应的具体步骤。(一) “双线桥”法:1、标价:标化合价发生改变的元素2、连桥: 连同一元素不同价态,且由反应物指向生成物。3、在桥上标明得失电子总数、化合价升降、被氧化、被还原等三、氧化—还原反应的表示方法(二)“单线桥”法表明不同元素原子的电子转移情况1、标箭头(从还原剂指向氧化剂),且要对准化合价发生变化的元素。2、标明电子转移的数目(不要标明“得、失”电子)。⑵SO2 + 2H2S = 3S + 2H2O4e-⑴2KMnO4 = K2MnO4+MnO2+O24e-⑷CH4 + 2O2 = CO2 + 2H2O⑴Fe2O3 + 3CO = 2Fe + 3CO2用双线桥描述下列氧化还原反应:⑵CuO + H2 = Cu + H2O⑶2NaBr + Cl2 = Br2 + 2NaCl 在以上氧化还原反应中,还原剂失电子数与氧化剂得电子数有没有什么联系? [思考与练习][思考与交流]四、氧化还原的计算:电子守恒:在任何氧化还原反应中,电子得失总数相等(化合价升降总数相等)已知3个SO32-恰好将2个XO4- 还原,而SO32-被氧化为SO42-,则X元素在还原产物中的化合价是 ( )
A.+1 B.+2
C.+3 D.+4[思考与练习]D1、强弱规律(或性质递推规律)五、氧化—还原反应的规律及应用判断方法:氧化剂(强氧)>氧化产物(弱氧)
还原剂(强还)>还原产物(弱还)【思考与探究】 已知反应:Fe+CuSO4=Cu+FeSO4,请找出该反应的氧化剂、还原剂、氧化产物、还原产物 ,并比较氧化剂与氧化产物的氧化性强弱,还原剂与还原产物的还原性强弱。 还原性:还原剂还原产物氧化性:Fe > CuCu2+ > Fe2+氧化剂氧化产物根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 == 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3 H2SO3 > I- > Fe2+ > NO
I- > Fe2+ > H2SO3 > NO
Fe2+ > I- > H2SO3 > NO
NO > Fe2+ > H2SO3 > I-A【思考与练习】已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2
B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2
D.2NaZ+X2=2NaX+Z2B、C应用2:判断反应进行的方向【思考与探究】2、价态律:元素处于最低价:只有还原性,无氧化性元素处于最高价:只有氧化性,无还原性元素处于中间价态:具有双重性试从化合价角度分析下列粒子的性质。在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性的是___________,只有还原性的是___________,兼有氧化性和还原性的是_______________。 1、C + CO2 2、Fe + FeCl3
3、SO2 + H2SO4 (浓) 4、H2S + H2SO4(浓) 想一想,下列反应能否发生?能发生的,请预测有关产物?3、归中规律 同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉”。【思考与练习】指出下列反应中的氧化产物和还原产物:
⑴KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O
⑵H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O4、电子守恒律还原剂失电子总数 = 氧化剂得电子总数即:化合价升高总数 = 化合价降低总数【思考与练习】一种氧化剂(或还原剂)与多种还原剂(或氧化剂)相遇时,总是按还原剂(或氧化剂)强弱顺序先后反应,先强后弱。举例:把Mg和Fe同时通入盐酸中,先: Mg+ 2H+ = Mg2+ + H2↑
后: Fe+ 2H+ = Fe2+ + H2↑ 5、难易律六、氧化还原反应方程式的配平
一标:正确标出反应前后价态变化元素的
化合价。
二等:通过最小公倍数法,使化合价升降
总数相等。
三定:确定氧化剂与还原剂、氧化产物与
还原产物的化学计量数。
四平:根据原子守恒用观察法配平其他物
质的化学计量数。
五查:检查是否符合原子守恒和得失电子
守恒。
若为离子反应,还要符合电荷守恒。
1、单质X2和Y2起反应生成化合物的分子式是
XY,已知X是正价,下列叙述正确的是 ( )
A、X2被还原,X2是还原剂
B、Y2被氧化,Y2是氧化剂
C、X2被氧化,X2是还原剂
D、Y2被氧化,Y2是还原剂C2、已知反应:3Cl2+8NH3=N2+6NH4Cl参加反应的NH3和作为还原剂的NH3的个数比为_________4∶1【巩固练习】化学反应化合反应 分解反应
置换反应 复分解反应氧化还原反应
非氧化还原反应离子反应
非离子反应小结再见!
氧化还原反应1.请列举几个氧化反应和还原反应的实例,讨论并交流这类化学反应的分类标准。2.氧化反应和还原反应是分别独立进行的吗?H2得氧,发生氧化反应;CuO失氧,发生还原反应。C得氧,发生氧化反应,CuO失氧发生还原反应。分类标准:得氧失氧氧化还原反应同时存在,同时发生。两者既对立又统一,不能截然分开。3.请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。+200+1化合价降低,被还原(氧化反应)化合价升高,被氧化(还原反应)+200+4化合价降低,被还原化合价升高,被氧化(氧化反应)(还原反应)分析高温结论:得氧失氧—化合价升高—氧化反应—化合价降低—还原反应4、是否只有得氧、失氧的反应才是氧化还原反应?Fe+CuSO4 FeSO4 +CuMg+2HCl MgCl2+H2 ③氧化还原反应:凡有元素化合价升降的化学反应都是氧化还原反应。 ①氧化反应: 物质所含元素化合价升高的反应是氧化反应。 ②还原反应:物质所含元素化合价降低的反应是还原反应。小结1、概念2、判断依据:反应前后是否有元素化合价的改变。
3、特征:反应前后有元素化合价发生改变常见元素化合价H:+1、-1 Li:+1 Be:+2 B:+3 C:-4、+2、+4 N:-3、+1、+2、+3、+4、+5
O:-2 (在过氧根中为-1) F:-1 Na:+1 Mg:+2 Al:+3 Si:+2、+4
P:-3、+3、+5 S:-2、+2、+4、+6 Cl:-1、+1、+3、+5、+7
K:+1 Ca:+2 Fe:+2、+3 Cu:+1、+2 Zn:+2 Mn: +2、+4、+6、+7
Br:=Cl=I Pb:+2、+4 Ag:+1 Au:+3、+5 [练习]表示下列物质中加点元素的化合价
H2SO4 Na2SO3 KMnO4 Fe2O3 O2 K2Cr2O7
N2O5 NH3 HNO3 NH4NO3 KClO3 KClO[小结] 化合价的相关规定:
1、原子失去电子带正电,化合价为正价;原子得到电子带负电,化合价为负价;
2、单质中,元素的化合价为0;
3、金属元素除0价外,只显正价;
4、非金属元素(氟除外)既可显正价,也可显负价;
5、化合物中,正负化合价的代数和为0(化合物中某元素化合价的计算依据)。 练习:下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl =CaCl2 + CO2↑ + H2O
B. Na2O + H2O =2NaOH
C. 2KMnO4 =K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 =Fe3O4
CuSO4·5H2O =CuSO4 + 5H2O
CDE 有人说:有单质参加的化合反应和有单质参加的分解反应全部是氧化还原反应,你认为这些结论合理吗?简述理由?四种基本反应类型与氧化还原反应的关系,试画出交叉分类法示意图?学与问4、分析四种基本类型反应与氧化还原反应之间的关系,并画出它们之间的交叉分类示意图。 √×√×√√×× 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应属于氧化还原反应。结论氧化还原反应与四种基本类型反应的关系:交叉分类图[思考]下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
H2+Cl2 =2HCl[结论]因有化合价升降,所以是氧化还原反应。 可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。[问题]化合价的升降是什么原因引起的? 氧化反应的实质是原子失去电子的过程。 还原反应的实质是原子得到电子的过程。2Na + Cl2 = 2NaCl00+1化合价升高,被氧化化合价降低,被还原-1失电子,得电子,化合价升降的原因:
电子的得失H Clδ+ δ- HCl 在生成的氯化氢分子中,一对共用电子对偏向于Cl原子而偏离于H原子,使H从0→+1价,被氧化,发生氧化反应;同时使Cl从0→-1价被还原,发生还原反应。化学反应的本质是原子之间的重新组合化合价升降原因:电子的偏移H2 + Cl2 = 2HCl00+1化合价升高,被氧化化合价降低,被还原 凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。-1电子对偏离,电子对偏向,一、氧化还原反应◆从得氧失氧角度分析一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。(仅局限于得氧失氧的反应)◆从化合价升降角度分析凡有元素化合价升降的化学反应都是氧化还原反应◆从电子转移角度分析有电子转移(得失或偏移)化学反应是氧化还原反应。(特征, 判断依据)(本质)1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的得失或偏移B D练习二、氧化剂和还原剂 1.氧化剂:得到电子(或电子对偏向)的物质[所含元素化合价降低的物质]2.还原剂:失去电子(或电子对偏离)的物质[所含元素化合价升高的物质]H2 + Cl2 = 2HCl氧化剂还原剂氧化剂还原剂 常见的氧化剂有:
①活泼的非金属单质如:Cl2、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸性KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Zn、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S、亚硫酸盐等。 3.氧化产物和还原产物 氧化产物:还原剂失去电子被氧化后的生成物还原产物:氧化剂得电子被还原后的生成物例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物:
MnO2+ 4HCl=MnCl2 + Cl2 +2H2O4.氧化性和还原性氧化性:氧化剂得电子的性质(或称氧化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性1、下列变化需要加入还原剂的是( )
A.Fe2O3 → Fe B.C → CO2
C.Na2CO3 → CO2 D.Al → Al2O3AC练习几个概念间的关系:小结氧化还原反应中各概念之间的关系可以表示如下:氧化剂 + 还原剂 还原产物 + 氧化产物失去电子,化合价升高,发生氧化反应得到电子,化合价降低,发生还原反应升失氧氧还, 降得还还氧Zn + 2HCl = ZnCl2 + H2↑ 0 +1 +2 0失2e-,化合价升高,被氧化得2×e-,化合价降低,被还原氧化剂:HCl 还原产物:H2
还原剂:Zn 氧化产物:ZnCl2[思考与探究] 标出下列反应中化合价发生改变的元素的化合价,并指出:还原剂、氧化剂在反应中电子转移的数目、化合价升降情况以及在反应中被氧化还是被还原[思考与交流] 综合以上练习,请总结归纳“双线桥”法描述氧化还原反应的具体步骤。(一) “双线桥”法:1、标价:标化合价发生改变的元素2、连桥: 连同一元素不同价态,且由反应物指向生成物。3、在桥上标明得失电子总数、化合价升降、被氧化、被还原等三、氧化—还原反应的表示方法(二)“单线桥”法表明不同元素原子的电子转移情况1、标箭头(从还原剂指向氧化剂),且要对准化合价发生变化的元素。2、标明电子转移的数目(不要标明“得、失”电子)。⑵SO2 + 2H2S = 3S + 2H2O4e-⑴2KMnO4 = K2MnO4+MnO2+O24e-⑷CH4 + 2O2 = CO2 + 2H2O⑴Fe2O3 + 3CO = 2Fe + 3CO2用双线桥描述下列氧化还原反应:⑵CuO + H2 = Cu + H2O⑶2NaBr + Cl2 = Br2 + 2NaCl 在以上氧化还原反应中,还原剂失电子数与氧化剂得电子数有没有什么联系? [思考与练习][思考与交流]四、氧化还原的计算:电子守恒:在任何氧化还原反应中,电子得失总数相等(化合价升降总数相等)已知3个SO32-恰好将2个XO4- 还原,而SO32-被氧化为SO42-,则X元素在还原产物中的化合价是 ( )
A.+1 B.+2
C.+3 D.+4[思考与练习]D1、强弱规律(或性质递推规律)五、氧化—还原反应的规律及应用判断方法:氧化剂(强氧)>氧化产物(弱氧)
还原剂(强还)>还原产物(弱还)【思考与探究】 已知反应:Fe+CuSO4=Cu+FeSO4,请找出该反应的氧化剂、还原剂、氧化产物、还原产物 ,并比较氧化剂与氧化产物的氧化性强弱,还原剂与还原产物的还原性强弱。 还原性:还原剂还原产物氧化性:Fe > CuCu2+ > Fe2+氧化剂氧化产物根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 == 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3 H2SO3 > I- > Fe2+ > NO
I- > Fe2+ > H2SO3 > NO
Fe2+ > I- > H2SO3 > NO
NO > Fe2+ > H2SO3 > I-A【思考与练习】已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2
B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2
D.2NaZ+X2=2NaX+Z2B、C应用2:判断反应进行的方向【思考与探究】2、价态律:元素处于最低价:只有还原性,无氧化性元素处于最高价:只有氧化性,无还原性元素处于中间价态:具有双重性试从化合价角度分析下列粒子的性质。在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性的是___________,只有还原性的是___________,兼有氧化性和还原性的是_______________。 1、C + CO2 2、Fe + FeCl3
3、SO2 + H2SO4 (浓) 4、H2S + H2SO4(浓) 想一想,下列反应能否发生?能发生的,请预测有关产物?3、归中规律 同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉”。【思考与练习】指出下列反应中的氧化产物和还原产物:
⑴KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O
⑵H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O4、电子守恒律还原剂失电子总数 = 氧化剂得电子总数即:化合价升高总数 = 化合价降低总数【思考与练习】一种氧化剂(或还原剂)与多种还原剂(或氧化剂)相遇时,总是按还原剂(或氧化剂)强弱顺序先后反应,先强后弱。举例:把Mg和Fe同时通入盐酸中,先: Mg+ 2H+ = Mg2+ + H2↑
后: Fe+ 2H+ = Fe2+ + H2↑ 5、难易律六、氧化还原反应方程式的配平
一标:正确标出反应前后价态变化元素的
化合价。
二等:通过最小公倍数法,使化合价升降
总数相等。
三定:确定氧化剂与还原剂、氧化产物与
还原产物的化学计量数。
四平:根据原子守恒用观察法配平其他物
质的化学计量数。
五查:检查是否符合原子守恒和得失电子
守恒。
若为离子反应,还要符合电荷守恒。
1、单质X2和Y2起反应生成化合物的分子式是
XY,已知X是正价,下列叙述正确的是 ( )
A、X2被还原,X2是还原剂
B、Y2被氧化,Y2是氧化剂
C、X2被氧化,X2是还原剂
D、Y2被氧化,Y2是还原剂C2、已知反应:3Cl2+8NH3=N2+6NH4Cl参加反应的NH3和作为还原剂的NH3的个数比为_________4∶1【巩固练习】化学反应化合反应 分解反应
置换反应 复分解反应氧化还原反应
非氧化还原反应离子反应
非离子反应小结再见!
