氧化还原反应
图片预览










文档简介
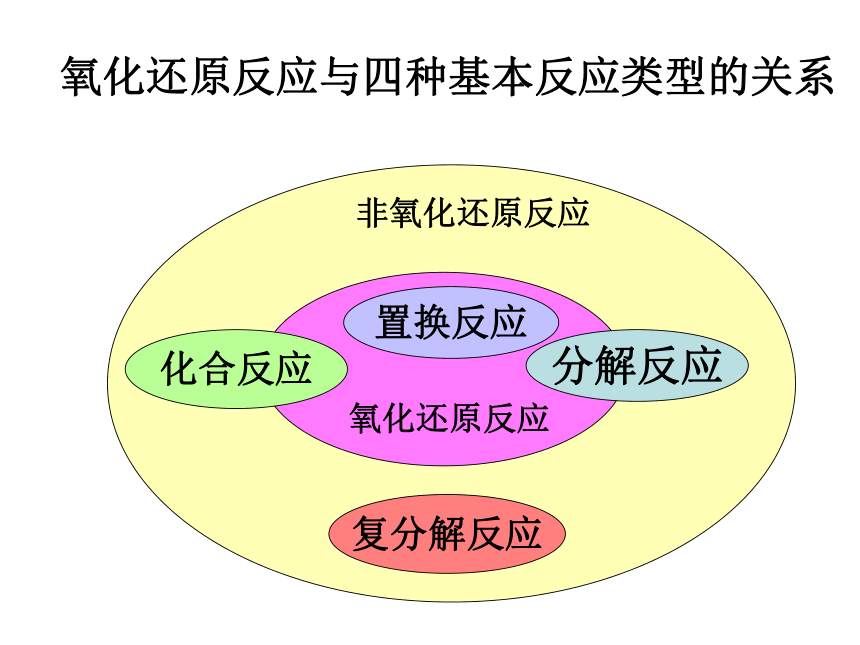
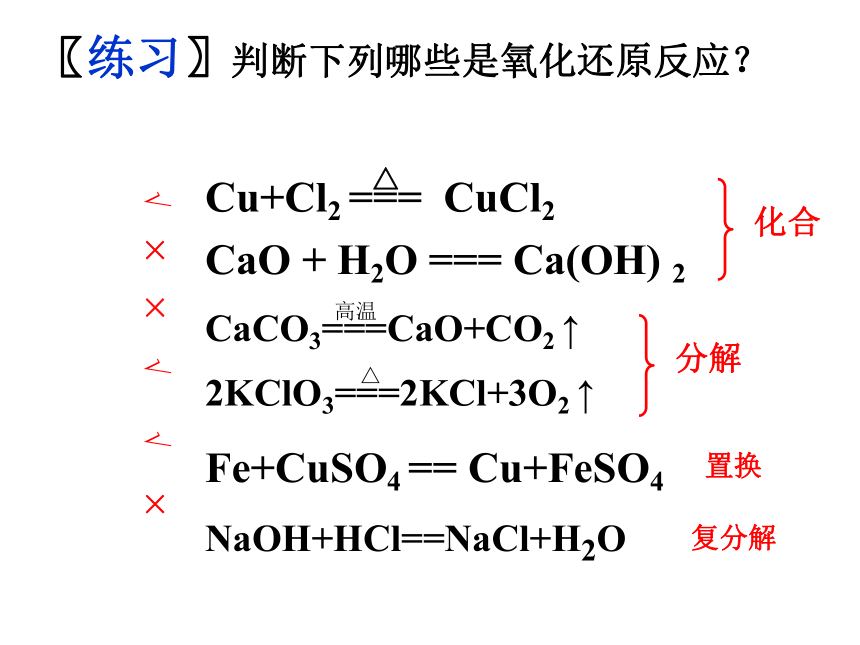
课件42张PPT。氧化还原反应感受氧化还原反应的存在 刚削好的苹果放置30分钟以后的苹果刚泡好的绿茶放置2小时后的绿茶感受氧化还原反应的存在 感受氧化还原反应的存在 好吃的月饼幕后的英雄感受氧化还原反应的存在 金属生锈【思考】(2) 2H2 + O2 == 2H2O(3) CaCO3 == CaO + CO2(5) Zn + 2HCl = ZnCl2 + H2(7) NaOH + HCl = NaCl + H2O点燃高温(1) CO2 + H2O == H2CO3 (6) Fe + CuSO4 == FeSO4 + Cu(4) 2H2O2 == 2H2O + O2MnO2化合反应分解反应置换反应复分解反应氧化还原反应氧化还原反应氧化还原反应从反应类型对以下方程式分类(8) Fe2O3+3CO = 2Fe+3CO2 氧化还原反应化学反应的分类根据反应物和生成物的类别 化合反应分解反应置换反应复分解反应根据反应过程中元素化合价是否发生变化 氧化还原反应非氧化还原反应【知识回顾】化学反应氧化还原反应与四种基本反应类型的关系复分解反应分解反应化合反应置换反应一、氧化还原反应的判断1、定义有元素化合价变化的反应称为氧化还原反应。2、判断方法观察反应前后元素的化合价是否发生改变。常见元素及原子团的化合价:+1:H 、Li 、Na 、K 、Ag 、NH4++2:Ca 、Mg 、Zn 、Ba+3:Al-1:F 、Cl 、Br 、I 、 NO3- 、 OH--2:O 、 SO42- 、 CO32- 、 SO32- -3:PO43-Fe: +2 +3 Cu: +2 +1 C: +2 +4
S: -2 +4 +6
N: -3 +1 +2 +3 +4 +5 +4:Si+5:PCaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × [问题]下列反应是否属于氧化还原反应?
2Na+Cl2 == 2NaCl
H2+Cl2 == 2HCl[结论]因为有化合价升降,所以是氧化还原反应。元素的化合价为什么会发生变化?氧化还原反应的本质?【思考与探究】阅读教材P44-45,思考:
1、在NaCl的形成过程中,电子如何转移?与化合价的升降又有何关系?2、那电子转移的方向和数目该如何表示呢?离子化合物NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+从电子得失角度分析:氧化还原反应的实质三、氧化还原反应的相关概念1、氧化剂在氧化还原反应中,化合价降低的反应物。2、还原剂在氧化还原反应中,化合价升高的反应物。 化合价升高的反应是氧化反应。化合价降低的反应是还原反应。三、氧化还原反应的相关概念3、氧化产物在氧化还原反应中,还原剂对应的生成物。4、还原产物在氧化还原反应中,氧化剂对应的生成物。氧化还原反应分析2Na + Cl2 = 2NaCl反应物类别化合价升降电子转移反应类型反应物性质【交流与讨论】0+2+40氧化剂还原剂氧化产物还原产物反应物类别化合价升降电子转移反应类型反应物性质得到4e-失去4e-还原反应氧化反应氧化性还原性+100+2氧化剂还原剂氧化产物还原产物反应物类别化合价升降电子转移反应类型反应物性质得到2e-失去2e-还原反应氧化反应氧化性还原性Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O0+5+2+4还原剂氧化剂氧化产物还原产物② CuSO4 + Fe == FeSO4 + Cu ① 2Na + Cl2 = 2NaCl 氧化剂氧化剂H2O既是氧化剂又是还原剂氧化剂还原剂还原剂还原剂练习1:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。既是氧化产物又是还原产物氧化产物还原产物氧化产物还原产物〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
⑶失e- → 化合价升高 → 发生氧化反应
得e- → 化合价降低 → 发生 还原反应小结:从微观角度(电子转移)认识氧化还原反应:0 0 +1 -1化合价升高,发生氧化反应化合价降低,发生还原反应0 0 +1 -1化合价升高,发生氧化反应化合价降低,发生还原反应失电子失电子得电子得电子表观上: 化合价升降
本质上:氧化反应:被氧化元素化合价升高,失去电子还原反应:被还原反应化合价降低,得到电子(或电子对偏离)(或电子对偏向)电子转移(电子得失或偏移)升、失、氧; 降、得、还〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应2CuO + C == 2Cu + CO2 化合价降低,得4 e、被还原+200+4高温化合价升高,失4 e、被氧化用于表示反应中元素化合价变化情况的双箭头——双线桥步骤:1.标出变化了的元素化合价;2.箭头总是从反应物指向生成物;3.箭头上标出:箭头指向同种元素;二、氧化还原反应的表示方法:得失电子数目 = 化合价变化的原子个数×(高价-低价)① 化合价升降
②得失电子数目
③被氧化或被还原双线桥 +4 -1 +2 0 价升高 失2×e- 被氧化 价降低 得2e- 被还原分析:3S + 4HNO3 = 3SO2 +4NO +2H2O0 +5 +4 +2价降低 得4×3e- 被还原价升高 失3×4e- 被氧化分析说明参加反应的4分子HCl中,只有2分子HCl被氧化.注 意课堂练习1用双线桥表示同种元素的电子得失失去2×3e-双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2 Fe + 3 Cl2 = 2 FeCl3得到3×2e-0+30-1课堂练习2用双线桥表示同种元素的电子得失得到2×6e-失去2×3×2e-常见的氧化剂④酸类:HNO3、H2SO4(浓)、HClO等。②金属阳离子:Hg2+、Ag+、Fe3+、Cu2+等
③高价金属氧化物:MnO2、PbO2等。①非金属单质:F2、Cl2、Br2、I2、O2等。⑤盐类:KMnO4、KClO3、K2Cr2O7等。常见的还原剂? ④含有较低化合价元素的化合物:①金属单质:Na、Mg、Al、Fe、Ca等。②某些非金属:H2、C、Si、P等。③非金属阴离子:S2-、I-H2S、Na2S、HI、NH3、CO、SO2、Na2SO3 、FeCl2等。(3)还原剂还原性的比较
①根据根据活动顺序表判断
②根据非金属活动顺序判断:
还原性:F- 还原性:还原剂 > 还原产物 > 氧化剂根据反应条件判断(4)氧化剂氧化性的比较
①根据金属活动顺序表判断 ④根据反应条件判断:
②根据非金属活动顺序判断:
氧化性:F2>O2>Cl2>Br2>I2>S③根据反应方程式判断:
氧化性:氧化剂 > 氧化产物 > 还原剂归纳小结1、氧化还原反应的判断特征:
化合价是否有改变
2、氧化还原反应的实质:
反应中有电子转移
3、氧化剂、还原剂的关系
氧化剂→得电子→化合价降低→还原反应
→还原产物
还原剂→失电子→化合价升高→氧化反应
→氧化产物
4、表示方法:双线桥法月饼常采用真空包装或往包装袋中装入一小包铁粉,这样做的目的是什么? 感受氧化还原反应的价值 金属生锈水管的表面刷上油漆,这样做的目的是什么?2007年10月11日新华社电瑞典皇家科学院诺贝尔奖评委会10日宣布,德国科学家格哈德·埃特尔因为在表面化学研究领域作出开拓性贡献而获得2007年诺贝尔化学奖。汽车排放出的尾气中含有大量CO和NO,如果不加净化则会对人类生活造成危害。埃特尔有关CO和NO在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失DC<学以致用>C3.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是<学以致用>4、实现下列变化,一定要加入其它物质作氧化剂的是( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.H2O→ O2C<学以致用><学以致用>4、金属加工后的废切削液中含2—5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步: NaNO2+NH4Cl=NaCl+NH4NO2
第二步: NH4NO2 N2↑+2H2O
下列对第二步反应的叙述中正确的是 ( )
① NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2发生了分解反应 ④ 只有氮元素的化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A? ①③ B? ①④ C? ②③④ D? ③④⑤D练习:分析下列变化过程是否氧化还原反应 ①Fe→FeCl2 需加 剂,如 。
②CuO → Cu 需加 剂,如 。
③HCl → Cl2 需加 剂,如 。
④HCl → H2 需加 剂,如 。
⑤Fe3+ → Fe 需加 剂, Fe3+具有 性。氧化剂氧化剂还原剂HClH2MnO2还原剂Zn氧化性Fe+2HCl====FeCl2+ H2↑00+2+1│↑↓│失去2e-,化合价升高,被氧化得到2Xe-,化合价降低,被还原还原剂〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系[演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂
S: -2 +4 +6
N: -3 +1 +2 +3 +4 +5 +4:Si+5:PCaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × [问题]下列反应是否属于氧化还原反应?
2Na+Cl2 == 2NaCl
H2+Cl2 == 2HCl[结论]因为有化合价升降,所以是氧化还原反应。元素的化合价为什么会发生变化?氧化还原反应的本质?【思考与探究】阅读教材P44-45,思考:
1、在NaCl的形成过程中,电子如何转移?与化合价的升降又有何关系?2、那电子转移的方向和数目该如何表示呢?离子化合物NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+从电子得失角度分析:氧化还原反应的实质三、氧化还原反应的相关概念1、氧化剂在氧化还原反应中,化合价降低的反应物。2、还原剂在氧化还原反应中,化合价升高的反应物。 化合价升高的反应是氧化反应。化合价降低的反应是还原反应。三、氧化还原反应的相关概念3、氧化产物在氧化还原反应中,还原剂对应的生成物。4、还原产物在氧化还原反应中,氧化剂对应的生成物。氧化还原反应分析2Na + Cl2 = 2NaCl反应物类别化合价升降电子转移反应类型反应物性质【交流与讨论】0+2+40氧化剂还原剂氧化产物还原产物反应物类别化合价升降电子转移反应类型反应物性质得到4e-失去4e-还原反应氧化反应氧化性还原性+100+2氧化剂还原剂氧化产物还原产物反应物类别化合价升降电子转移反应类型反应物性质得到2e-失去2e-还原反应氧化反应氧化性还原性Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O0+5+2+4还原剂氧化剂氧化产物还原产物② CuSO4 + Fe == FeSO4 + Cu ① 2Na + Cl2 = 2NaCl 氧化剂氧化剂H2O既是氧化剂又是还原剂氧化剂还原剂还原剂还原剂练习1:判断下列反应是否属于氧化还原反应,如果是,请指出氧化剂、还原剂、氧化产物和还原产物。既是氧化产物又是还原产物氧化产物还原产物氧化产物还原产物〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
⑶失e- → 化合价升高 → 发生氧化反应
得e- → 化合价降低 → 发生 还原反应小结:从微观角度(电子转移)认识氧化还原反应:0 0 +1 -1化合价升高,发生氧化反应化合价降低,发生还原反应0 0 +1 -1化合价升高,发生氧化反应化合价降低,发生还原反应失电子失电子得电子得电子表观上: 化合价升降
本质上:氧化反应:被氧化元素化合价升高,失去电子还原反应:被还原反应化合价降低,得到电子(或电子对偏离)(或电子对偏向)电子转移(电子得失或偏移)升、失、氧; 降、得、还〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应2CuO + C == 2Cu + CO2 化合价降低,得4 e、被还原+200+4高温化合价升高,失4 e、被氧化用于表示反应中元素化合价变化情况的双箭头——双线桥步骤:1.标出变化了的元素化合价;2.箭头总是从反应物指向生成物;3.箭头上标出:箭头指向同种元素;二、氧化还原反应的表示方法:得失电子数目 = 化合价变化的原子个数×(高价-低价)① 化合价升降
②得失电子数目
③被氧化或被还原双线桥 +4 -1 +2 0 价升高 失2×e- 被氧化 价降低 得2e- 被还原分析:3S + 4HNO3 = 3SO2 +4NO +2H2O0 +5 +4 +2价降低 得4×3e- 被还原价升高 失3×4e- 被氧化分析说明参加反应的4分子HCl中,只有2分子HCl被氧化.注 意课堂练习1用双线桥表示同种元素的电子得失失去2×3e-双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2 Fe + 3 Cl2 = 2 FeCl3得到3×2e-0+30-1课堂练习2用双线桥表示同种元素的电子得失得到2×6e-失去2×3×2e-常见的氧化剂④酸类:HNO3、H2SO4(浓)、HClO等。②金属阳离子:Hg2+、Ag+、Fe3+、Cu2+等
③高价金属氧化物:MnO2、PbO2等。①非金属单质:F2、Cl2、Br2、I2、O2等。⑤盐类:KMnO4、KClO3、K2Cr2O7等。常见的还原剂? ④含有较低化合价元素的化合物:①金属单质:Na、Mg、Al、Fe、Ca等。②某些非金属:H2、C、Si、P等。③非金属阴离子:S2-、I-H2S、Na2S、HI、NH3、CO、SO2、Na2SO3 、FeCl2等。(3)还原剂还原性的比较
①根据根据活动顺序表判断
②根据非金属活动顺序判断:
还原性:F-
①根据金属活动顺序表判断 ④根据反应条件判断:
②根据非金属活动顺序判断:
氧化性:F2>O2>Cl2>Br2>I2>S③根据反应方程式判断:
氧化性:氧化剂 > 氧化产物 > 还原剂归纳小结1、氧化还原反应的判断特征:
化合价是否有改变
2、氧化还原反应的实质:
反应中有电子转移
3、氧化剂、还原剂的关系
氧化剂→得电子→化合价降低→还原反应
→还原产物
还原剂→失电子→化合价升高→氧化反应
→氧化产物
4、表示方法:双线桥法月饼常采用真空包装或往包装袋中装入一小包铁粉,这样做的目的是什么? 感受氧化还原反应的价值 金属生锈水管的表面刷上油漆,这样做的目的是什么?2007年10月11日新华社电瑞典皇家科学院诺贝尔奖评委会10日宣布,德国科学家格哈德·埃特尔因为在表面化学研究领域作出开拓性贡献而获得2007年诺贝尔化学奖。汽车排放出的尾气中含有大量CO和NO,如果不加净化则会对人类生活造成危害。埃特尔有关CO和NO在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失DC<学以致用>C3.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是<学以致用>4、实现下列变化,一定要加入其它物质作氧化剂的是( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.H2O→ O2C<学以致用><学以致用>4、金属加工后的废切削液中含2—5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步: NaNO2+NH4Cl=NaCl+NH4NO2
第二步: NH4NO2 N2↑+2H2O
下列对第二步反应的叙述中正确的是 ( )
① NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2发生了分解反应 ④ 只有氮元素的化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A? ①③ B? ①④ C? ②③④ D? ③④⑤D练习:分析下列变化过程是否氧化还原反应 ①Fe→FeCl2 需加 剂,如 。
②CuO → Cu 需加 剂,如 。
③HCl → Cl2 需加 剂,如 。
④HCl → H2 需加 剂,如 。
⑤Fe3+ → Fe 需加 剂, Fe3+具有 性。氧化剂氧化剂还原剂HClH2MnO2还原剂Zn氧化性Fe+2HCl====FeCl2+ H2↑00+2+1│↑↓│失去2e-,化合价升高,被氧化得到2Xe-,化合价降低,被还原还原剂〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系[演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂
