六年级语文上册教案 一诺千金 2(语文a版)
文档属性
| 名称 | 六年级语文上册教案 一诺千金 2(语文a版) |

|
|
| 格式 | rar | ||
| 文件大小 | 12.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 语文A版 | ||
| 科目 | 语文 | ||
| 更新时间 | 2009-10-05 00:00:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
湖北省黄冈中学2010届高三八月月考化学测试卷
命题人:傅全安 审稿人:苏小军 干丽
本试卷分第Ⅰ卷和第Ⅱ卷两部分,满分108分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 K:39 Mn:55 Cu:64 Br:80 Ba:137
第Ⅰ卷(选择题,共48分)
一.选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列说法不正确的是
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
2.警犬常从案发现场的人体气味来获取有用线索。人体气味的成分中含有以下化合物: ①辛酸;②壬酸;③环十二醇;④5,9—十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛。下列说法正确的是
A.①②⑥分子中碳原子数小于10,③④⑤分子中碳原子数大于10
B.①②是无机物,③⑤⑦是有机物
C.①②⑥⑦都是酸性化合物
D.②③④含氧元素,⑤⑥⑦不含氧元素
3.已知NaCl的摩尔质量为58.5 g·mol-1,其晶体密度为d g·cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示
A.117a3d B.58.5/(2a3d)
C.234/(a3d) D.58.5/(4a3d)
4.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2OHClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2OAl(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)32FeO42-+3Cl-+H2O+4H+
5.下列推断合理的是
A.明矾[KAl(SO4)2 12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
6.在相同状况下,下列两个反应放出的热量分别用Q1、Q2表示:
H2(g)+1/2O2(g)═H2O(g),2H2(g)+O2(g)═2H2O(l),则Q1和Q2的关系正确的是
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.Q1=1/2Q2
7.下列有关实验操作的说法正确的是
A.可用25 mL碱式滴定管量取20.00 mL KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
8.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示, X、Y、Z分别处于立方体的顶点、棱边的中点、立方体的体心。则下面表示该化合物的化学式正确的
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
9.下列说法正确的是
A.仅用AgNO3溶液便可鉴别纯碱和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用盐酸标准溶液滴定待测氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
10.已知:2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g);ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);
ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
11.下列有关物质检验的实验结论正确的是
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有SO42-
B 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 该溶液中一定含有Fe2+
C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2
D 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 该物质一定属于醛类
12.在通常条件下,下列各组物质的性质排列正确的是
A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3
13.在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
14.下列离子方程式书写正确的是
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:
C2H5Br+OH-CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:
3Fe2++4H++NO3-3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:
2MnO4-+6H++5H2O22Mn2++5O2↑+8H2O
15.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面结构见右图,则x值为
A.8 B.12 C.24 D.60
16.将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比
A.1︰1 B.1︰2 C.1︰3 D.无法确定
第Ⅱ卷(非选择题,共60分)
二.(本题包括2小题,共16分)
17.(8分)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol·L–1的溶液,进行如下实验:
1 测得溶液A、C、E呈碱性,且碱性为A>E>C;
2 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
3 向D溶液中滴加Ba(NO3)2溶液,无明显现象;
4 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是______________________________________________
________________________________________________________________。
(2)E溶液是__________,判断依据是___________________________________________
__________________________________________________________________。
(3)写出下列四种化合物的化学式:A___________________、C____________________、
D_____________________、F_____________________。
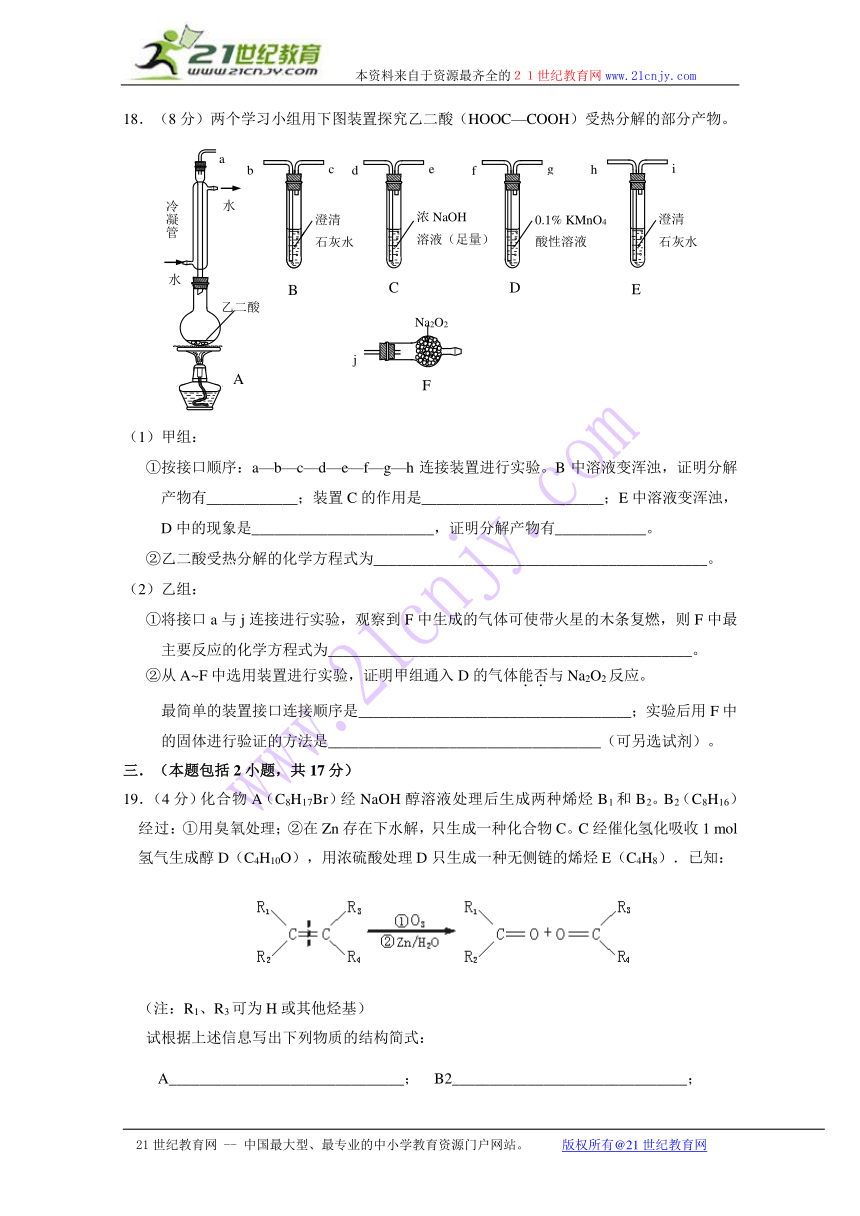
18.(8分)两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。
(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有____________;装置C的作用是________________________;E中溶液变浑浊,D中的现象是________________________,证明分解产物有____________。
②乙二酸受热分解的化学方程式为____________________________________________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________________。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是____________________________________;实验后用F中的固体进行验证的方法是____________________________________(可另选试剂)。
三.(本题包括2小题,共17分)
19.(4分)化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过:①用臭氧处理;②在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收1 mol氢气生成醇D(C4H10O),用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8).已知:
(注:R1、R3可为H或其他烃基)
试根据上述信息写出下列物质的结构简式:
A_______________________________; B2_______________________________;
C_______________________________; E_______________________________。
20.(13分)请仔细阅读以下转化关系:
A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B称作冰片,可用于医药和制香精,樟脑等;
C的核磁共振氢谱显示其分子中含有4种氢原子;
D中只含一个氧原子,与Na反应放出H2 ;
F为烃。
请回答:
(1)B的分子式为___________________。
(2)B不能发生的反应是(填序号)____________。
a.氧化反应 b.聚合反应 c.消去反应 d取代反应 e.与Br2加成反应.
(3)写出D→E、E→F的反应类型:
D→E_______________________、E→F______________________。
(4)F的分子式为___________。 化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构(共四种):______________________,______________________,
______________________,______________________。
(5)C的结构简式为:______________________;
F用系统命名法命名为:______________________________。
(6)写出E→D的化学方程式_________________________________________。
四.(本题包括2小题,共13分)
21.(4分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________。
(2)已知0.2 mol KBrO3在反应中得到lmol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>ASH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
22.(9分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入)________________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________
____________________________________,直到______________________________。用KMnO4标准溶液滴定时应选用________________滴定管(填“酸式”或“碱式”)。
五.(本题包括2小题,共14分)
23.(6分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为_____________。
24.(8分)以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整:
4_________+11O22Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高SO2的转化率
c. 使用催化剂能提高SO2的反应速率和转化率
d. 沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
________________________________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是______________________________________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是____________%;
若铵盐质量为15.00g,浓硫酸增加的质量为________。(计算结果保留两位小数)
湖北省黄冈中学2010届高三八月月考化学答题卷
第Ⅰ卷(选择题,共48分)
题号 1 2 3 4 5 6 7 8
答案
题号 9 10 11 12 13 14 15 16
答案
第Ⅱ卷(非选择题,共60分)
17.(8分)_____________________________________________________________________
_____________________________________________________________。
(2)______________________, _______________________________________________
__________________________________________________________________。
(3)A_______________、C_______________、D_______________、F_______________。
18.(8分)(1)①_____________; ____________________________________;
___________________________________________, ______________。
②______________________________________________________________。
(2)①________________________________________________。
② _________________________;___________________________________________
__________________________________________________________________。
19.(4分)A____________________________________________________________;
B2____________________________________________________________;
C______________________________; E______________________________。
20.(13分)(1)____________________________。 (2)____________________。
(3)D→E_______________________、E→F______________________。
(4)__________________。
_______________________________,_______________________________,
_______________________________,_______________________________。
(5)_________________________________; ___________________________________。
(6)_______________________________________________________________________。
21.(4分)(1)_________________。(2)_________________。(3)_________________。
(4)
22.(9分)(1)_____________,______________。
(2)___________________________,____________________。
(3)_____________________。_____________。
(4)_______________________________________, ______________________________。
____________________。
23.(6分)(1)_________________。(2)_________________。(3)_________________。
24.(8分)(1)_____________________。
(2)______________________________________________________________。
(3)__________________________。
(4)____________________________________________________________。
(5)①__________________________________________________________ 。
②________________________;_____________________。
湖北省黄冈中学2010届高三八月月考化学参考答案
题号 1 2 3 4 5 6 7 8
答案 D A B C A C C A
题号 9 10 11 12 13 14 15 16
答案 B C B D D D A A
17.(1)AgNO3+NH3·H2O=AgOH↓+NH4NO3 AgOH+2NH3·H2O= Ag(NH3)2OH+2 H2O
(2)碳酸钾 由①中碱性强弱的顺序可知:E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性碳酸盐的只有钾离子,所以E是碳酸盐
(3)Ba(OH)2 Ca(CH3COO)2 AlCl3 FeSO4
18.(1)①CO2;充分除去CO2;溶液褪色或变浅;CO
②H2C2O4CO2↑+CO↑ + H2O
(2)①2Na2O2+2CO2 = 2Na2CO3+O2
②a—d—e—j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清的石灰水,若变浑浊,则发生了反应;若不变浑浊,则未发生反应。
19. CH3CH2CH2CHBrCH2CH2CH2CH3 CH3CH2CH2CH=CHCH2CH2CH3
CH3CH2CH2CHO CH3CH2CH=CH2
20.(1)C10H18O (2)b e (3)取代反应 消去反应
(4)C5H10 CH2=CHCH2CH3 CH2=C(CH3) 2 ,
CH3CH=CHCH3 (顺反, )
(5)(CH3)2CHCH2COOH 3-甲基-1-丁烯
(6)
21.(1)AsH3 (2)Br2 (3)a c
(4)
22.(1)c d (2)冷却、结晶 ; 引流 (3)NH3·H2O b
(4)注视凹液面的最低处与刻度线,凹液面的最低处与刻度线相平 酸式
23.(1)35.6 (2)3 (3)0.5
24.(1)FeS2 (2) (3)a b d
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH= -130.3kJ/mol
(5)①SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
②14.56 2.31g
a
B
b
c
澄清
石灰水
e
d
浓NaOH
溶液(足量)
C
j
Na2O2
F
冷凝管
乙二酸
水
水
A
a
E
h
i
澄清
石灰水
f
g
0.1% KMnO4
酸性溶液
D
B
b
c
澄清
石灰水
a
b
c
多孔球泡
d
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
湖北省黄冈中学2010届高三八月月考化学测试卷
命题人:傅全安 审稿人:苏小军 干丽
本试卷分第Ⅰ卷和第Ⅱ卷两部分,满分108分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 K:39 Mn:55 Cu:64 Br:80 Ba:137
第Ⅰ卷(选择题,共48分)
一.选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列说法不正确的是
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
2.警犬常从案发现场的人体气味来获取有用线索。人体气味的成分中含有以下化合物: ①辛酸;②壬酸;③环十二醇;④5,9—十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛。下列说法正确的是
A.①②⑥分子中碳原子数小于10,③④⑤分子中碳原子数大于10
B.①②是无机物,③⑤⑦是有机物
C.①②⑥⑦都是酸性化合物
D.②③④含氧元素,⑤⑥⑦不含氧元素
3.已知NaCl的摩尔质量为58.5 g·mol-1,其晶体密度为d g·cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示
A.117a3d B.58.5/(2a3d)
C.234/(a3d) D.58.5/(4a3d)
4.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2OHClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2OAl(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)32FeO42-+3Cl-+H2O+4H+
5.下列推断合理的是
A.明矾[KAl(SO4)2 12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
6.在相同状况下,下列两个反应放出的热量分别用Q1、Q2表示:
H2(g)+1/2O2(g)═H2O(g),2H2(g)+O2(g)═2H2O(l),则Q1和Q2的关系正确的是
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.Q1=1/2Q2
7.下列有关实验操作的说法正确的是
A.可用25 mL碱式滴定管量取20.00 mL KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
8.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示, X、Y、Z分别处于立方体的顶点、棱边的中点、立方体的体心。则下面表示该化合物的化学式正确的
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
9.下列说法正确的是
A.仅用AgNO3溶液便可鉴别纯碱和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用盐酸标准溶液滴定待测氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
10.已知:2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g);ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);
ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
11.下列有关物质检验的实验结论正确的是
选项 实验操作及现象 实验结论
A 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有SO42-
B 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 该溶液中一定含有Fe2+
C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2
D 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 该物质一定属于醛类
12.在通常条件下,下列各组物质的性质排列正确的是
A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3
13.在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
14.下列离子方程式书写正确的是
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:
C2H5Br+OH-CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:
3Fe2++4H++NO3-3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:
2MnO4-+6H++5H2O22Mn2++5O2↑+8H2O
15.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面结构见右图,则x值为
A.8 B.12 C.24 D.60
16.将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比
A.1︰1 B.1︰2 C.1︰3 D.无法确定
第Ⅱ卷(非选择题,共60分)
二.(本题包括2小题,共16分)
17.(8分)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol·L–1的溶液,进行如下实验:
1 测得溶液A、C、E呈碱性,且碱性为A>E>C;
2 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
3 向D溶液中滴加Ba(NO3)2溶液,无明显现象;
4 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是______________________________________________
________________________________________________________________。
(2)E溶液是__________,判断依据是___________________________________________
__________________________________________________________________。
(3)写出下列四种化合物的化学式:A___________________、C____________________、
D_____________________、F_____________________。
18.(8分)两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。
(1)甲组:
①按接口顺序:a—b—c—d—e—f—g—h连接装置进行实验。B中溶液变浑浊,证明分解产物有____________;装置C的作用是________________________;E中溶液变浑浊,D中的现象是________________________,证明分解产物有____________。
②乙二酸受热分解的化学方程式为____________________________________________。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为________________________________________________。
②从A~F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是____________________________________;实验后用F中的固体进行验证的方法是____________________________________(可另选试剂)。
三.(本题包括2小题,共17分)
19.(4分)化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过:①用臭氧处理;②在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收1 mol氢气生成醇D(C4H10O),用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8).已知:
(注:R1、R3可为H或其他烃基)
试根据上述信息写出下列物质的结构简式:
A_______________________________; B2_______________________________;
C_______________________________; E_______________________________。
20.(13分)请仔细阅读以下转化关系:
A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B称作冰片,可用于医药和制香精,樟脑等;
C的核磁共振氢谱显示其分子中含有4种氢原子;
D中只含一个氧原子,与Na反应放出H2 ;
F为烃。
请回答:
(1)B的分子式为___________________。
(2)B不能发生的反应是(填序号)____________。
a.氧化反应 b.聚合反应 c.消去反应 d取代反应 e.与Br2加成反应.
(3)写出D→E、E→F的反应类型:
D→E_______________________、E→F______________________。
(4)F的分子式为___________。 化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构(共四种):______________________,______________________,
______________________,______________________。
(5)C的结构简式为:______________________;
F用系统命名法命名为:______________________________。
(6)写出E→D的化学方程式_________________________________________。
四.(本题包括2小题,共13分)
21.(4分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________。
(2)已知0.2 mol KBrO3在反应中得到lmol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>ASH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
22.(9分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入)________________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________
____________________________________,直到______________________________。用KMnO4标准溶液滴定时应选用________________滴定管(填“酸式”或“碱式”)。
五.(本题包括2小题,共14分)
23.(6分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为_____________。
24.(8分)以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整:
4_________+11O22Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高SO2的转化率
c. 使用催化剂能提高SO2的反应速率和转化率
d. 沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
________________________________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是______________________________________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是____________%;
若铵盐质量为15.00g,浓硫酸增加的质量为________。(计算结果保留两位小数)
湖北省黄冈中学2010届高三八月月考化学答题卷
第Ⅰ卷(选择题,共48分)
题号 1 2 3 4 5 6 7 8
答案
题号 9 10 11 12 13 14 15 16
答案
第Ⅱ卷(非选择题,共60分)
17.(8分)_____________________________________________________________________
_____________________________________________________________。
(2)______________________, _______________________________________________
__________________________________________________________________。
(3)A_______________、C_______________、D_______________、F_______________。
18.(8分)(1)①_____________; ____________________________________;
___________________________________________, ______________。
②______________________________________________________________。
(2)①________________________________________________。
② _________________________;___________________________________________
__________________________________________________________________。
19.(4分)A____________________________________________________________;
B2____________________________________________________________;
C______________________________; E______________________________。
20.(13分)(1)____________________________。 (2)____________________。
(3)D→E_______________________、E→F______________________。
(4)__________________。
_______________________________,_______________________________,
_______________________________,_______________________________。
(5)_________________________________; ___________________________________。
(6)_______________________________________________________________________。
21.(4分)(1)_________________。(2)_________________。(3)_________________。
(4)
22.(9分)(1)_____________,______________。
(2)___________________________,____________________。
(3)_____________________。_____________。
(4)_______________________________________, ______________________________。
____________________。
23.(6分)(1)_________________。(2)_________________。(3)_________________。
24.(8分)(1)_____________________。
(2)______________________________________________________________。
(3)__________________________。
(4)____________________________________________________________。
(5)①__________________________________________________________ 。
②________________________;_____________________。
湖北省黄冈中学2010届高三八月月考化学参考答案
题号 1 2 3 4 5 6 7 8
答案 D A B C A C C A
题号 9 10 11 12 13 14 15 16
答案 B C B D D D A A
17.(1)AgNO3+NH3·H2O=AgOH↓+NH4NO3 AgOH+2NH3·H2O= Ag(NH3)2OH+2 H2O
(2)碳酸钾 由①中碱性强弱的顺序可知:E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性碳酸盐的只有钾离子,所以E是碳酸盐
(3)Ba(OH)2 Ca(CH3COO)2 AlCl3 FeSO4
18.(1)①CO2;充分除去CO2;溶液褪色或变浅;CO
②H2C2O4CO2↑+CO↑ + H2O
(2)①2Na2O2+2CO2 = 2Na2CO3+O2
②a—d—e—j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清的石灰水,若变浑浊,则发生了反应;若不变浑浊,则未发生反应。
19. CH3CH2CH2CHBrCH2CH2CH2CH3 CH3CH2CH2CH=CHCH2CH2CH3
CH3CH2CH2CHO CH3CH2CH=CH2
20.(1)C10H18O (2)b e (3)取代反应 消去反应
(4)C5H10 CH2=CHCH2CH3 CH2=C(CH3) 2 ,
CH3CH=CHCH3 (顺反, )
(5)(CH3)2CHCH2COOH 3-甲基-1-丁烯
(6)
21.(1)AsH3 (2)Br2 (3)a c
(4)
22.(1)c d (2)冷却、结晶 ; 引流 (3)NH3·H2O b
(4)注视凹液面的最低处与刻度线,凹液面的最低处与刻度线相平 酸式
23.(1)35.6 (2)3 (3)0.5
24.(1)FeS2 (2) (3)a b d
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH= -130.3kJ/mol
(5)①SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
②14.56 2.31g
a
B
b
c
澄清
石灰水
e
d
浓NaOH
溶液(足量)
C
j
Na2O2
F
冷凝管
乙二酸
水
水
A
a
E
h
i
澄清
石灰水
f
g
0.1% KMnO4
酸性溶液
D
B
b
c
澄清
石灰水
a
b
c
多孔球泡
d
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
- 第一单元
- 1 开国大典
- 2 七子之歌(节选)
- 3*詹天佑
- 选读一 “神舟”五号飞船着陆记
- 第二单元
- 4 古诗二首
- 5 骑马上天山
- 6*威尼斯之夜
- 选读二 埃及金字塔见闻
- 第三单元
- 7 校园门口的那片树林
- 8 我的第一首小诗
- 9*怀特森先生的课
- 选读三 大自然的教科书
- 第四单元
- 10 献你一束花
- 11 一诺千金
- 12*小丑的眼泪
- 选读四 海的女儿
- 第五单元
- 13 蜗牛慢条斯理的生活
- 14 昆虫迷
- 选读五 小女孩儿和小海豹(一)
- 选读六 小女孩儿和小海豹(二)
- 第六单元
- 15 冀中的地道战
- 16 小英雄雨来
- 17*夜莺之歌
- 选读七 滹沱河上的儿童团员
- 第七单元
- 18 北京的春节
- 19 古诗二首
- 20 火的节日
- 选读八 说茶
- 第八单元
- 21 蜀鄙之僧
- 22 崂山道士
- 选读九 牛郎织女(一)
- 选读十 牛郎织女(二)
- 单元测试
