粗盐的纯化
图片预览





文档简介
课件15张PPT。烟台第二十三中学单元探究活动—粗盐的纯化鲁教版初中化学九年级(全一册)第二单元《海水中化学》要将粗盐初步提纯(即除去粗盐中的不溶性杂质─泥沙)应采用什么方法?主要有哪些步骤?
粗盐提纯主要步骤
①溶解②过滤③蒸发温故知新NaCl、 MgCl2、 CaCl2、 Na2SO4等温故知新溶液中可溶性杂质的除去原则:(1)不增 提纯过程中不能引入新的杂质
(2)不减 不减少欲被提纯的物质
(3)好分 被提纯的物质与杂质容易分离
(4)复原 被提纯的物质与杂质容易分离你知道吗?溶液中可溶性杂质的除去方式:将杂质转化为沉淀、气体或水三必须:除杂试剂必须过量
过量试剂必须除尽
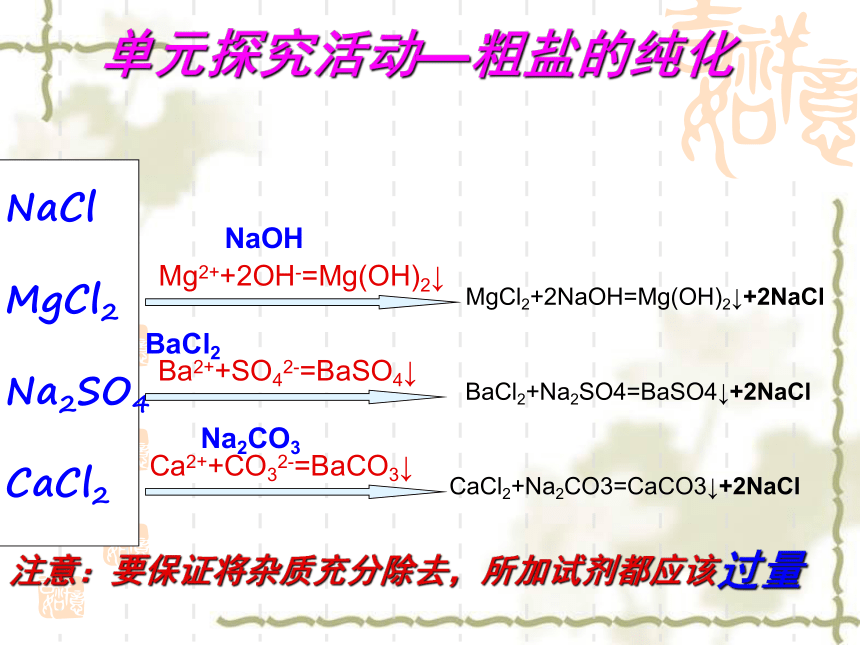
除杂途径选最佳你知道吗?单元探究活动—粗盐的纯化NaCl
MgCl2
Na2SO4
CaCl2Mg2++2OH-=Mg(OH)2↓Ba2++SO42-=BaSO4↓Ca2++CO32-=BaCO3↓NaOHBaCl2Na2CO3MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaCl注意:要保证将杂质充分除去,所加试剂都应该过量NaCl
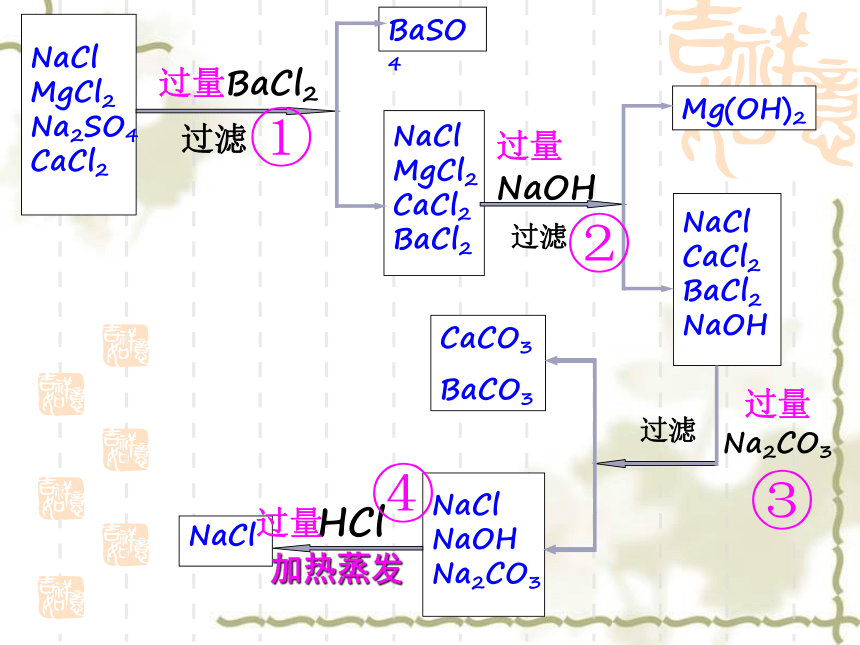
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发①②③④MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+Na2CO3=BaCO3↓+2NaCl2HCl+Na2CO3=2NaCl+H2O+CO2↑HCl+NaOH=NaCl+H2O①
②
③
④Na+ Cl-SO42- Ca2+ Mg2+盐酸Na+ Cl- Ca2+ Mg2+Ba2+③ ②①Na+ Cl- Mg2+CO32-Na+ Cl- CO32-OH- 过量BaCl2Na+ Cl- 过量Na2CO3过滤过量NaOHNaCl
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发总结归纳(1)碳酸钠的双重作用:既可以除去粗盐中的氯化钙又可以除去过量的氯化钡。所以在所加试剂顺序中,碳酸钠必须加在氯化钡之后。
(2)盐酸的双重作用:最后加盐酸除去过量的氢氧化钠和碳酸钠。盐酸有挥发性,过量的盐酸可以通过加热和水一起被除去。
BaCl2 → Na2CO3 → NaOH → HCl
BaCl2 → NaOH → Na2CO3 → HCl
NaOH → BaCl2 → Na2CO3 → HCl除去粗盐中可溶性杂质
——氯化钙、氯化镁、硫酸钠 的试剂加入顺序1、Na2CO3在BaCl2之后加入,用Na2CO3同时除CaCl2和BaCl2;2、最后加盐酸除CO32-、OH-,依据总结归纳从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序:
是 。(用序号填一种合理组合)。学以致用MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+Na2CO3=BaCO3↓+2NaCl2HCl+Na2CO3=2NaCl+H2O+CO2↑HCl+NaOH=NaCl+H2O①
②
③
④NaCl
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发
粗盐提纯主要步骤
①溶解②过滤③蒸发温故知新NaCl、 MgCl2、 CaCl2、 Na2SO4等温故知新溶液中可溶性杂质的除去原则:(1)不增 提纯过程中不能引入新的杂质
(2)不减 不减少欲被提纯的物质
(3)好分 被提纯的物质与杂质容易分离
(4)复原 被提纯的物质与杂质容易分离你知道吗?溶液中可溶性杂质的除去方式:将杂质转化为沉淀、气体或水三必须:除杂试剂必须过量
过量试剂必须除尽
除杂途径选最佳你知道吗?单元探究活动—粗盐的纯化NaCl
MgCl2
Na2SO4
CaCl2Mg2++2OH-=Mg(OH)2↓Ba2++SO42-=BaSO4↓Ca2++CO32-=BaCO3↓NaOHBaCl2Na2CO3MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaCl注意:要保证将杂质充分除去,所加试剂都应该过量NaCl
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发①②③④MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+Na2CO3=BaCO3↓+2NaCl2HCl+Na2CO3=2NaCl+H2O+CO2↑HCl+NaOH=NaCl+H2O①
②
③
④Na+ Cl-SO42- Ca2+ Mg2+盐酸Na+ Cl- Ca2+ Mg2+Ba2+③ ②①Na+ Cl- Mg2+CO32-Na+ Cl- CO32-OH- 过量BaCl2Na+ Cl- 过量Na2CO3过滤过量NaOHNaCl
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发总结归纳(1)碳酸钠的双重作用:既可以除去粗盐中的氯化钙又可以除去过量的氯化钡。所以在所加试剂顺序中,碳酸钠必须加在氯化钡之后。
(2)盐酸的双重作用:最后加盐酸除去过量的氢氧化钠和碳酸钠。盐酸有挥发性,过量的盐酸可以通过加热和水一起被除去。
BaCl2 → Na2CO3 → NaOH → HCl
BaCl2 → NaOH → Na2CO3 → HCl
NaOH → BaCl2 → Na2CO3 → HCl除去粗盐中可溶性杂质
——氯化钙、氯化镁、硫酸钠 的试剂加入顺序1、Na2CO3在BaCl2之后加入,用Na2CO3同时除CaCl2和BaCl2;2、最后加盐酸除CO32-、OH-,依据总结归纳从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序:
是 。(用序号填一种合理组合)。学以致用MgCl2+2NaOH=Mg(OH)2↓+2NaClBaCl2+Na2SO4=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaClBaCl2+Na2CO3=BaCO3↓+2NaCl2HCl+Na2CO3=2NaCl+H2O+CO2↑HCl+NaOH=NaCl+H2O①
②
③
④NaCl
MgCl2
Na2SO4
CaCl2过滤过滤过滤BaSO4NaCl
MgCl2
CaCl2
BaCl2NaCl
CaCl2
BaCl2
NaOH Mg(OH)2NaCl
NaOH
Na2CO3CaCO3
BaCO3NaCl过量加热蒸发
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
