化学(新人教版必修1):第三章《金属及其化合物-几种重要的金属化合物》课件
文档属性
| 名称 | 化学(新人教版必修1):第三章《金属及其化合物-几种重要的金属化合物》课件 |  | |
| 格式 | rar | ||
| 文件大小 | 140.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-25 16:16:00 | ||
图片预览








文档简介
课件23张PPT。第二节 几种重要的金属化合物 思考写出Na与O2 , Fe与H2O蒸汽,Al与NaOH溶液反应的化学方程式.金属易失电子,绝大多数在自然界是以化合态存在.4Na+O2=2Na2O
2Na+O2 Na2O2
3Fe+4H2O(g) Fe3O4+4H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑一 、 氧化物学与问钠表面的氧化物和铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗? Na2O、Al2O3都是白色固体,但附在银白色的金属钠或铝上均显暗灰色。
它们的化学性质不同:Na2O能溶与水生成NaOH,Al2O3不溶与水;Na2O能与酸反应,Al2O3既能与酸反应,又能与强碱反应;Na2O疏松,对内层金属不起保护作用,而在空气中铝表面的Al2O3是致密的薄层,对内层铝有很好的保护作用。一 、 氧化物1.与水反应:可溶或微溶碱与水反应生成相应的碱。 (如 Na2O、K2O、CaO、BaO)实验3-5Al2O3+2NaOH=2NaAlO2+H2O Na2O MgO Fe2O3 CuO 水溶性氧化物色状
白色固体 溶黑色固体 红棕色固 白色固体 不溶 CuO+2HCl=CuCl2+H2O 蓝绿色 Fe2O3+6HCl=2FeCl3+3H2O 黄色 MgO+2HCl=MgCl2+H2O 无色 Na2O +2HCl=2NaCl+H2O 无色 不溶 不溶 与盐酸反应的化学方程式及溶液颜色
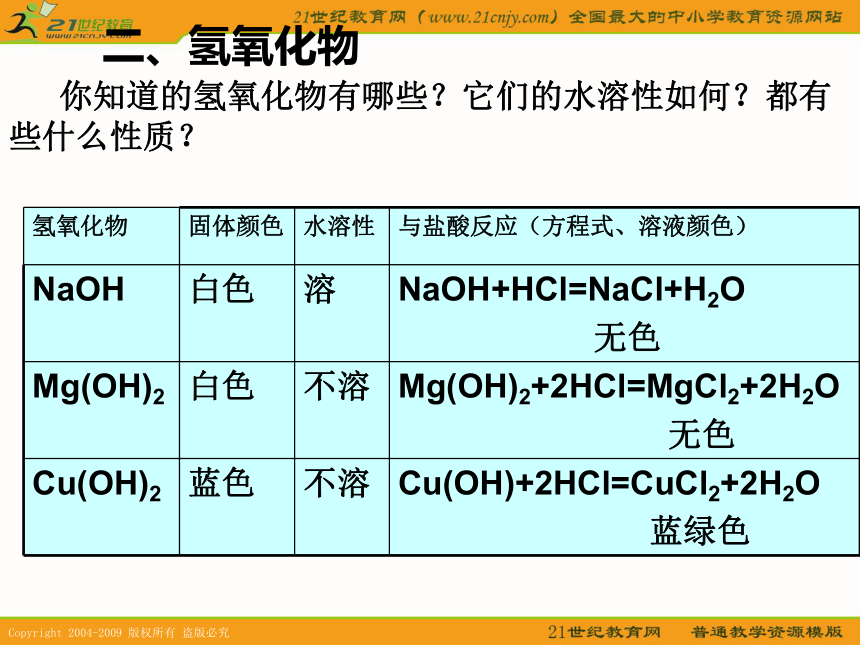
金属氧化物的化学性质2.与酸反应:生成盐和水。 3.Al2O3的特性:与强碱反应生成偏铝酸盐和水金属氧化物1、多数金属氧化物不溶于水,不能跟水直接反应2、少数金属氧化物能与水反应生成碱3、少数金属氧化物能与酸性氧化物反应生成盐4、多数金属氧化物能与酸反应生成盐和水5、Al2O3 —— 两性氧化物Al2O3 + 6H+ === Al3+ + 3H2OAl2O3 + 2OH- === AlO2- + H2O6、一些重要的金属氧化物的性质、生成和用途NaO、Na2O2、CaO、MgO、Al2O3、FeO、Fe2O3、Fe3O4、CuO、Cu2O、7、铝热反应:一些金属氧化物与Al粉在加热的条件下发生置换反应(放出大量的热)二、氢氧化物 你知道的氢氧化物有哪些?它们的水溶性如何?都有些什么性质?Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe(OH)3:FeCl3+3NaOH=Fe(OH)3↓+3NaCl现象:生成红褐色沉淀现象:先生成白色沉淀,然后迅速变为灰绿色,最后变为红褐色.1.铁的氢氧化物(1)制取①你能不能设计一个实验,使我们能较长时间看到白色的Fe(OH)2沉淀吗?难溶氢氧化物一般由盐与碱溶液反应制取(2)性质Fe(OH)2易被氧化4Fe(OH)2+O2+2H2O=4Fe(OH)31.铁的氢氧化物③Fe(OH)3受热分解难溶碱受热分解生成氧化物和水,易溶强碱受热不分解。红棕色粉末规律:②Fe(OH)3+3HCl=FeCl3+3H2OFe(OH)2+2HCl=FeCl2+2H2O白色沉淀溶解得浅绿色溶液红褐色沉淀溶解得黄色溶液(可溶、不可溶氢氧化物都有的性质)与酸反应生成盐和水2.氢氧化铝(1)制取Al2(SO4)3+6NH3·H2O=2Al(OH)3 ↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+现象:有白色胶状沉淀生成。 继续加氨水至过量,沉淀不溶,说明Al(OH)3不溶于氨水。(2)化学性质①两性——既能跟酸反应,又能跟强碱反应。Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O想一想:
制取Al(OH)3时用NaOH溶液好还是用氨水好?为什么?②加热分解2Al(OH)3=Al2O3+3H2O练习1:
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部练习2、3 《实验报告册》P28C金属氢氧化物通性:①少数易溶于水或微溶于水,水溶液呈碱性
②多数难溶于水,受热易分解生成氧化物和水
③少数能直接与酸性氧化物反应生成盐和水
④能与酸反应生成盐和水
⑤少数能跟盐溶液反应三 、盐 1.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热不分解2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3 ①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥加热向溶液中通入过量CO22、铁盐和亚铁盐的性质不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl2(2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入( )
A.加入Cu B.通入Cl2 C.加入Fe D.加入KSCNC阅读思考明矾为什么能够净水? 明矾溶于水与水反应,生成的AlOH3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。3、铝盐和铁盐的净水作用4、铜盐 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。5、焰色反应实验步骤:①将铂丝防在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。注意:①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)几种金属的焰色: Li Na K Ca Sr Ba Cu紫红 黄 紫 砖红 洋红 黄绿 绿溶液颜色无变化变为血红色黄浅绿2FeCl3+Fe=3FeCl2FeCl3Fe 不显血红色血红色Fe2+被氯水氧化Fe3+2FeCl2+Cl2=2FeCl3FeCl2
2Na+O2 Na2O2
3Fe+4H2O(g) Fe3O4+4H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑一 、 氧化物学与问钠表面的氧化物和铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗? Na2O、Al2O3都是白色固体,但附在银白色的金属钠或铝上均显暗灰色。
它们的化学性质不同:Na2O能溶与水生成NaOH,Al2O3不溶与水;Na2O能与酸反应,Al2O3既能与酸反应,又能与强碱反应;Na2O疏松,对内层金属不起保护作用,而在空气中铝表面的Al2O3是致密的薄层,对内层铝有很好的保护作用。一 、 氧化物1.与水反应:可溶或微溶碱与水反应生成相应的碱。 (如 Na2O、K2O、CaO、BaO)实验3-5Al2O3+2NaOH=2NaAlO2+H2O Na2O MgO Fe2O3 CuO 水溶性氧化物色状
白色固体 溶黑色固体 红棕色固 白色固体 不溶 CuO+2HCl=CuCl2+H2O 蓝绿色 Fe2O3+6HCl=2FeCl3+3H2O 黄色 MgO+2HCl=MgCl2+H2O 无色 Na2O +2HCl=2NaCl+H2O 无色 不溶 不溶 与盐酸反应的化学方程式及溶液颜色
金属氧化物的化学性质2.与酸反应:生成盐和水。 3.Al2O3的特性:与强碱反应生成偏铝酸盐和水金属氧化物1、多数金属氧化物不溶于水,不能跟水直接反应2、少数金属氧化物能与水反应生成碱3、少数金属氧化物能与酸性氧化物反应生成盐4、多数金属氧化物能与酸反应生成盐和水5、Al2O3 —— 两性氧化物Al2O3 + 6H+ === Al3+ + 3H2OAl2O3 + 2OH- === AlO2- + H2O6、一些重要的金属氧化物的性质、生成和用途NaO、Na2O2、CaO、MgO、Al2O3、FeO、Fe2O3、Fe3O4、CuO、Cu2O、7、铝热反应:一些金属氧化物与Al粉在加热的条件下发生置换反应(放出大量的热)二、氢氧化物 你知道的氢氧化物有哪些?它们的水溶性如何?都有些什么性质?Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe(OH)3:FeCl3+3NaOH=Fe(OH)3↓+3NaCl现象:生成红褐色沉淀现象:先生成白色沉淀,然后迅速变为灰绿色,最后变为红褐色.1.铁的氢氧化物(1)制取①你能不能设计一个实验,使我们能较长时间看到白色的Fe(OH)2沉淀吗?难溶氢氧化物一般由盐与碱溶液反应制取(2)性质Fe(OH)2易被氧化4Fe(OH)2+O2+2H2O=4Fe(OH)31.铁的氢氧化物③Fe(OH)3受热分解难溶碱受热分解生成氧化物和水,易溶强碱受热不分解。红棕色粉末规律:②Fe(OH)3+3HCl=FeCl3+3H2OFe(OH)2+2HCl=FeCl2+2H2O白色沉淀溶解得浅绿色溶液红褐色沉淀溶解得黄色溶液(可溶、不可溶氢氧化物都有的性质)与酸反应生成盐和水2.氢氧化铝(1)制取Al2(SO4)3+6NH3·H2O=2Al(OH)3 ↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+现象:有白色胶状沉淀生成。 继续加氨水至过量,沉淀不溶,说明Al(OH)3不溶于氨水。(2)化学性质①两性——既能跟酸反应,又能跟强碱反应。Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O想一想:
制取Al(OH)3时用NaOH溶液好还是用氨水好?为什么?②加热分解2Al(OH)3=Al2O3+3H2O练习1:
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部练习2、3 《实验报告册》P28C金属氢氧化物通性:①少数易溶于水或微溶于水,水溶液呈碱性
②多数难溶于水,受热易分解生成氧化物和水
③少数能直接与酸性氧化物反应生成盐和水
④能与酸反应生成盐和水
⑤少数能跟盐溶液反应三 、盐 1.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热不分解2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3
②NaHCO3(Na2CO3)2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥加热向溶液中通入过量CO22、铁盐和亚铁盐的性质不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl2(2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入( )
A.加入Cu B.通入Cl2 C.加入Fe D.加入KSCNC阅读思考明矾为什么能够净水? 明矾溶于水与水反应,生成的AlOH3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。3、铝盐和铁盐的净水作用4、铜盐 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。5、焰色反应实验步骤:①将铂丝防在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。注意:①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)几种金属的焰色: Li Na K Ca Sr Ba Cu紫红 黄 紫 砖红 洋红 黄绿 绿溶液颜色无变化变为血红色黄浅绿2FeCl3+Fe=3FeCl2FeCl3Fe 不显血红色血红色Fe2+被氯水氧化Fe3+2FeCl2+Cl2=2FeCl3FeCl2
