化学(新人教版必修1):第三章《金属及其化合物-金属单质的化学(新人教版必修1)性质》课件
文档属性
| 名称 | 化学(新人教版必修1):第三章《金属及其化合物-金属单质的化学(新人教版必修1)性质》课件 |  | |
| 格式 | rar | ||
| 文件大小 | 310.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-10-25 16:16:00 | ||
图片预览








文档简介
课件24张PPT。第三章 金属及其化合物第一节 金属的化学性质【引言】 你知道焰火晚会上五颜六色的焰火是用什么制成的吗?你见过可以用小刀切割的金属吗?水是用来灭火的,你见过用水能够生火的吗……
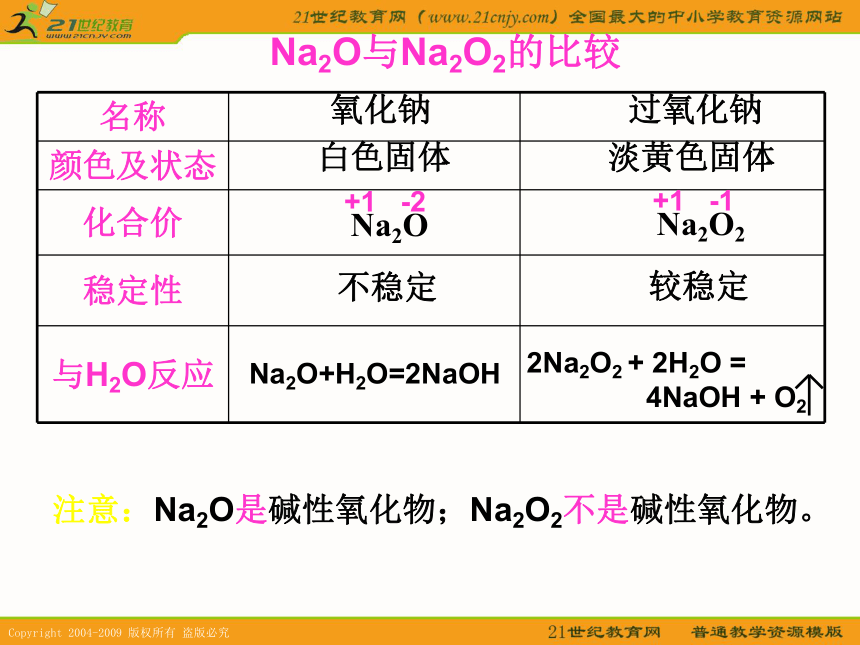
就让我们一起走进神奇的金属世界……1、地壳中含量由多到少的元素是(前三位): ;含量最多的金属元素 是 元素。【复习回忆】氧、硅、铝铝2、分析下面一些化学反应的图片,写出化学方程式(3) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(1) 2Al + 3CuSO4 = 3Cu + Al2(SO4)3铜树镁条燃烧银树镁条和盐酸金属与氧气反应是不是一定要加热呢?【开动脑筋】实验3-1钠的物理性质:质软,可用小刀切割。钠的化学性质:银白色的钠表面很快变暗,说明钠很 容易被氧气氧化银白色;金属光泽的固体;颜色:状态:硬度:实验3-2实验现象:剧烈燃烧,发出黄色火焰,生成一种 淡黄色的固体。过氧化钠的特殊用途:2、可作为呼吸面具和潜水艇供氧剂。实验结论:条件不同,现象不同,产物不同。1、过氧化钠是强氧化剂,可以漂白织物、羽毛等氧化钠过氧化钠白色固体淡黄色固体Na2O与Na2O2的比较Na2O+H2O=2NaOH注意:Na2O是碱性氧化物;Na2O2不是碱性氧化物。不稳定较稳定【科学探究】加热铝箔实验现象:铝箔熔化,失去光泽,熔化的铝并不滴落实验结论:在常温下,铝能够与空气里面的氧气反应,生成一层致密而坚固的氧化物薄膜。铝是一种活泼金属。(打磨后)铝箔熔化,失去光泽,熔化的铝还是不滴落【小结】 金属一般都作为还原剂,容易失去电子,被氧化。【作业】判断下列反应是否属于氧化还原反应,是氧化还原反应的请用“双线桥”表示。(2)Na2O + H2O = 2NaOH实验3-3实验现象:钠浮在水面上熔化成一个小球在水面上游动,发出响声酚酞后溶液变红实验结论:密度比水小熔点低有气体生成有碱生成思考:生成的气体是什么?怎样证明?2Na+2H2O====2NaOH+H2↑想一想:钠能否保存在水里面?钠着火时能否用水灭火?a. 制过氧化物
b. Na—K合金用做原子反应堆的导热剂
c. 制稀有金属如Ti、Ta、Ni等
d. 制高压钠灯钠的用途:思考:铁不和冷水、热水反应,但能否与水蒸气反应?【科学探究】铁与水蒸气反应其它参考装置铁粉产生水蒸气收集氢气安全瓶实验现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声,反应后,试管内的固体仍呈黑色实验结论:【作业】1、设计实验证明钠与水反应生成的气体是氢气2、钠在空气中的变化:
表面变暗(生成Na2O) 变为白色固体(生成NaOH) 表面形成溶液( NaOH 溶解) 结块(生成Na2CO3 10H2O) 最后变成白色粉末(风化生成Na2CO3)写出相应的化学方程式(6条)①产生淡蓝色火焰。
②干冷烧杯内壁有无色液滴生成。
点燃氢气,并在火焰上方罩一干而冷的烧杯: 思考:活泼与较活泼的金属能与酸发生反应生成氢气,那么有没有金属是可以跟碱发生反应的呢?实验3-4实验现象:实验结论:两支试管均有气泡产生,将点燃的木条放在试管口,可观察到蓝色火焰。反应放热。铝既能与盐酸反应,又能与氢氧化钠反应。二者均生成氢气。偏铝酸钠元素包括金属元素和非金属元素。铝既能与盐酸反应,
又能与氢氧化钠反应,我们又称铝为两性元素思考与交流3:比较钠、镁、铝的原子结构特点,分析它们的还原性强弱三种原子的电子层数相同,从Na→Mg→Al, 质子数依次增大,原子半径依次减小,导致原子核对外层电子的引力由小到大,原子失去电子的能力由强到弱,还原性Na>Mg>Al.补充:用带火星的木条插入试管观察现象: 结论:氢氧化钠溶液使酚酞变红;过氧化钠有 强氧化性,漂白作用使红色褪去。带火星的木条复燃。结论:有氧气产生。溶液先变红色,然后红色褪去。滴加酚酞观察现象: 二.钠的化学性质:1、金属与非金属单质的反应:
(如氧气、氯气、硫等)常温:点燃:结论: 类推:根据原子结构推测S、Cl2等非金属单质能否与金属钠反应?2Na + S === Na2 S
2Na + Cl2=== 2NaCl2、金属与酸的反应:
想一想:活泼金属与酸反应一定会产生氢气吗?1、当位于金属活动性顺序中氢以前的金属遇到稀硫酸、稀盐酸、醋酸等非氧化性酸时,生成盐和氢气。如:Mg + 2H+ =Mg2+ +H2↑
Fe + 2H+ =Fe2+ +H2↑
Zn +2CH3COOH=(CH3COO)2Zn + H2↑ 2、当金属遇到浓硫酸、浓硝酸、稀硝酸等强氧化性酸时,不会放出氢气:
Zn + 2H2SO4 (浓) =ZnSO4 + SO2↑+2H2O
3Cu + 8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O浮
熔
游
响
红--密度比水小
--熔点低且反应放热
--产生气体
--反应剧烈
--产生碱观察并总结钠与水反应的实验现象,思考产生这些现象的原因。3、金属与水的反应化学方程式:2Na + 2H2O == 2NaOH + H2↑失2e-得2e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑思考与交流:把钠投入硫酸铜溶液中会有什么现象?试写出其化学方程式或离子反应方程式。五、铝与氢氧化钠溶液的反应铝能与盐酸、稀硫酸反应:
2Al + 6H+ = 2Al3+ +3H2↑铝也能与氢氧化钠溶液反应:
2Al + 2NaOH + 2H2O=2NaAlO2 +3H2↑
你能把此化学方程式改写成离子方程式吗?2Al + 2OH- + 2H2O=2AlO2- +3H2↑练习:
1、由于钠很容易与空气中的______、______等物质反应,通常将钠保存在______里,以使钠与______、______等隔绝。
2、下列叙述中错误的是( )
A 钠燃烧时发出黄色的火焰
B 钠在空气中燃烧生成氧化钠
C 钠与硫化合时可以发生爆炸
D 钠是强还原剂
3、写离子方程式B
就让我们一起走进神奇的金属世界……1、地壳中含量由多到少的元素是(前三位): ;含量最多的金属元素 是 元素。【复习回忆】氧、硅、铝铝2、分析下面一些化学反应的图片,写出化学方程式(3) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(1) 2Al + 3CuSO4 = 3Cu + Al2(SO4)3铜树镁条燃烧银树镁条和盐酸金属与氧气反应是不是一定要加热呢?【开动脑筋】实验3-1钠的物理性质:质软,可用小刀切割。钠的化学性质:银白色的钠表面很快变暗,说明钠很 容易被氧气氧化银白色;金属光泽的固体;颜色:状态:硬度:实验3-2实验现象:剧烈燃烧,发出黄色火焰,生成一种 淡黄色的固体。过氧化钠的特殊用途:2、可作为呼吸面具和潜水艇供氧剂。实验结论:条件不同,现象不同,产物不同。1、过氧化钠是强氧化剂,可以漂白织物、羽毛等氧化钠过氧化钠白色固体淡黄色固体Na2O与Na2O2的比较Na2O+H2O=2NaOH注意:Na2O是碱性氧化物;Na2O2不是碱性氧化物。不稳定较稳定【科学探究】加热铝箔实验现象:铝箔熔化,失去光泽,熔化的铝并不滴落实验结论:在常温下,铝能够与空气里面的氧气反应,生成一层致密而坚固的氧化物薄膜。铝是一种活泼金属。(打磨后)铝箔熔化,失去光泽,熔化的铝还是不滴落【小结】 金属一般都作为还原剂,容易失去电子,被氧化。【作业】判断下列反应是否属于氧化还原反应,是氧化还原反应的请用“双线桥”表示。(2)Na2O + H2O = 2NaOH实验3-3实验现象:钠浮在水面上熔化成一个小球在水面上游动,发出响声酚酞后溶液变红实验结论:密度比水小熔点低有气体生成有碱生成思考:生成的气体是什么?怎样证明?2Na+2H2O====2NaOH+H2↑想一想:钠能否保存在水里面?钠着火时能否用水灭火?a. 制过氧化物
b. Na—K合金用做原子反应堆的导热剂
c. 制稀有金属如Ti、Ta、Ni等
d. 制高压钠灯钠的用途:思考:铁不和冷水、热水反应,但能否与水蒸气反应?【科学探究】铁与水蒸气反应其它参考装置铁粉产生水蒸气收集氢气安全瓶实验现象:加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声,反应后,试管内的固体仍呈黑色实验结论:【作业】1、设计实验证明钠与水反应生成的气体是氢气2、钠在空气中的变化:
表面变暗(生成Na2O) 变为白色固体(生成NaOH) 表面形成溶液( NaOH 溶解) 结块(生成Na2CO3 10H2O) 最后变成白色粉末(风化生成Na2CO3)写出相应的化学方程式(6条)①产生淡蓝色火焰。
②干冷烧杯内壁有无色液滴生成。
点燃氢气,并在火焰上方罩一干而冷的烧杯: 思考:活泼与较活泼的金属能与酸发生反应生成氢气,那么有没有金属是可以跟碱发生反应的呢?实验3-4实验现象:实验结论:两支试管均有气泡产生,将点燃的木条放在试管口,可观察到蓝色火焰。反应放热。铝既能与盐酸反应,又能与氢氧化钠反应。二者均生成氢气。偏铝酸钠元素包括金属元素和非金属元素。铝既能与盐酸反应,
又能与氢氧化钠反应,我们又称铝为两性元素思考与交流3:比较钠、镁、铝的原子结构特点,分析它们的还原性强弱三种原子的电子层数相同,从Na→Mg→Al, 质子数依次增大,原子半径依次减小,导致原子核对外层电子的引力由小到大,原子失去电子的能力由强到弱,还原性Na>Mg>Al.补充:用带火星的木条插入试管观察现象: 结论:氢氧化钠溶液使酚酞变红;过氧化钠有 强氧化性,漂白作用使红色褪去。带火星的木条复燃。结论:有氧气产生。溶液先变红色,然后红色褪去。滴加酚酞观察现象: 二.钠的化学性质:1、金属与非金属单质的反应:
(如氧气、氯气、硫等)常温:点燃:结论: 类推:根据原子结构推测S、Cl2等非金属单质能否与金属钠反应?2Na + S === Na2 S
2Na + Cl2=== 2NaCl2、金属与酸的反应:
想一想:活泼金属与酸反应一定会产生氢气吗?1、当位于金属活动性顺序中氢以前的金属遇到稀硫酸、稀盐酸、醋酸等非氧化性酸时,生成盐和氢气。如:Mg + 2H+ =Mg2+ +H2↑
Fe + 2H+ =Fe2+ +H2↑
Zn +2CH3COOH=(CH3COO)2Zn + H2↑ 2、当金属遇到浓硫酸、浓硝酸、稀硝酸等强氧化性酸时,不会放出氢气:
Zn + 2H2SO4 (浓) =ZnSO4 + SO2↑+2H2O
3Cu + 8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O浮
熔
游
响
红--密度比水小
--熔点低且反应放热
--产生气体
--反应剧烈
--产生碱观察并总结钠与水反应的实验现象,思考产生这些现象的原因。3、金属与水的反应化学方程式:2Na + 2H2O == 2NaOH + H2↑失2e-得2e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑思考与交流:把钠投入硫酸铜溶液中会有什么现象?试写出其化学方程式或离子反应方程式。五、铝与氢氧化钠溶液的反应铝能与盐酸、稀硫酸反应:
2Al + 6H+ = 2Al3+ +3H2↑铝也能与氢氧化钠溶液反应:
2Al + 2NaOH + 2H2O=2NaAlO2 +3H2↑
你能把此化学方程式改写成离子方程式吗?2Al + 2OH- + 2H2O=2AlO2- +3H2↑练习:
1、由于钠很容易与空气中的______、______等物质反应,通常将钠保存在______里,以使钠与______、______等隔绝。
2、下列叙述中错误的是( )
A 钠燃烧时发出黄色的火焰
B 钠在空气中燃烧生成氧化钠
C 钠与硫化合时可以发生爆炸
D 钠是强还原剂
3、写离子方程式B
