物质的量(第一课时)
图片预览





文档简介
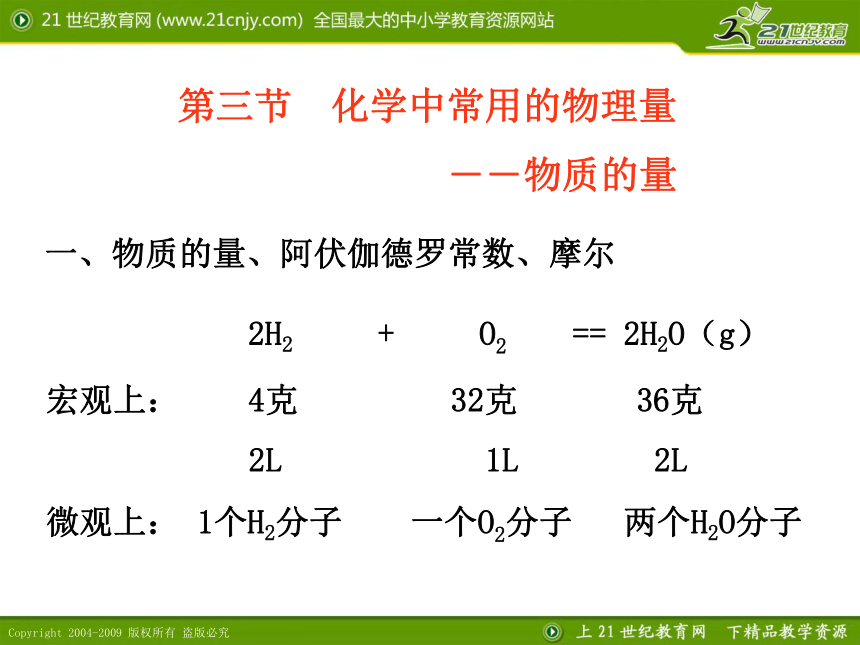
课件28张PPT。 2H2 + O2 == 2H2O(g)
宏观上: 4克 32克 36克
2L 1L 2L
微观上: 1个H2分子 一个O2分子 两个H2O分子 第三节 化学中常用的物理量
――物质的量一、物质的量、阿伏伽德罗常数、摩尔
[联想质疑]
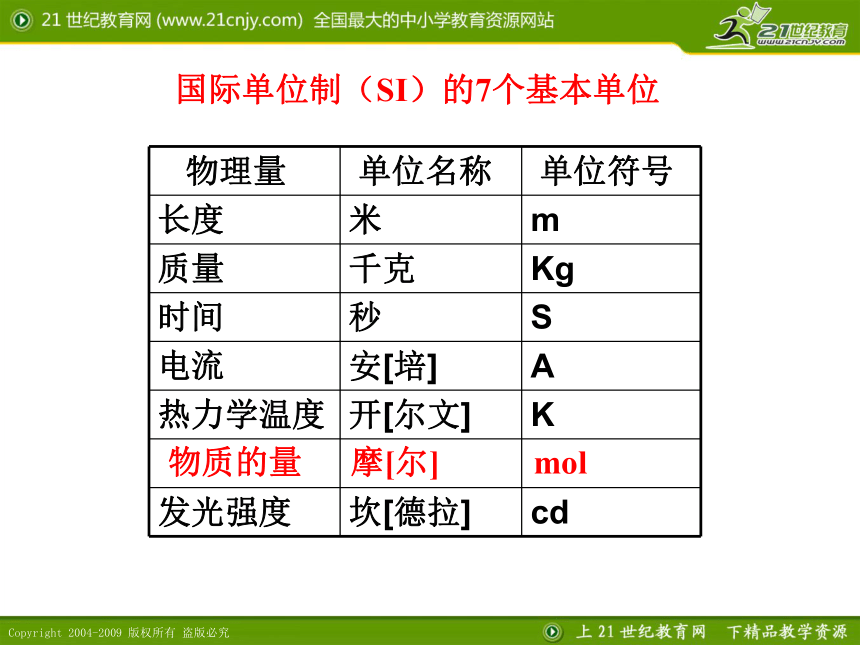
如何建立起宏观物质的质量、体积和其所含微观粒子数之间的联系呢? 国际单位制(SI)的7个基本单位物质的量摩[尔]mol物质的量是一种物理量。用于衡量物质所含微粒数目的多少。 * 是一个专用名词,不可以拆分。符号:n* 是物质的量的单位,符号为mol 。 国际上规定:1mol任何微粒所含的微粒数与0.012kg12C所含的碳原子数相等。
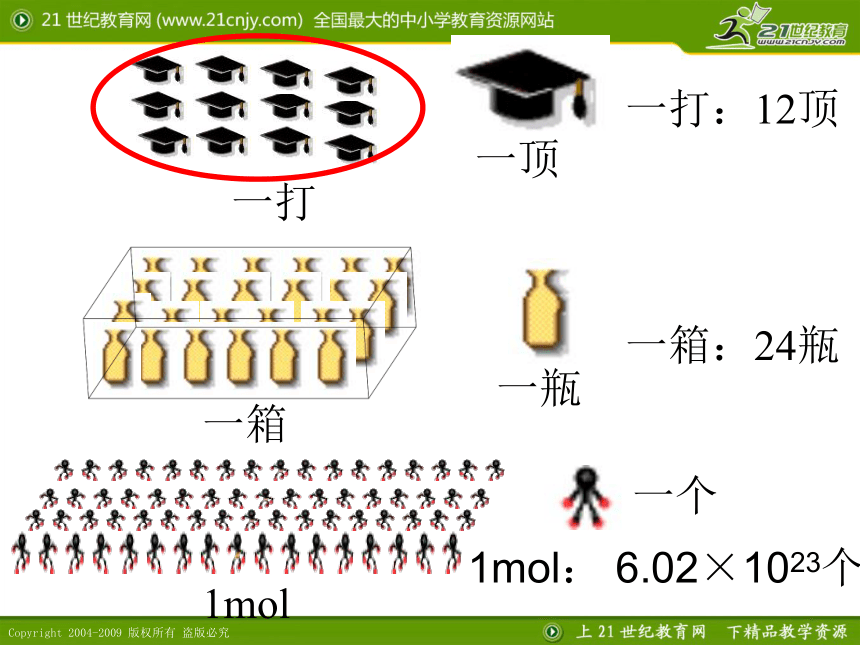
0.012kg 12C微观构成?一顶一打:12顶一瓶一箱:24瓶1mol1mol: 6.02×1023个一个 阿伏加德罗常数
6.02 X1023 /mol。符号为NA每摩尔物质含有阿伏伽德罗常数个微粒。 在12克12C中所含的碳原子的个数为阿佛加德罗常数个,为6.02ㄨ1023个碳原子。 物质的量 * 是国际单位制七个基本物理量之一, 符号为n 。 ** 是一个专用名词,不能拆开理解。
** 描述的对象是粒子集体。摩 尔 * 是物质的量的单位,符号为mol 。 在12克12C中所含的碳原子的物质的量为1摩尔,为阿佛加德罗常数个碳原子,约为6.02ㄨ1023个碳原子。物质的量n(单位mol)微粒数N
(单位:个)阿伏加德罗常数NA
(单位:mol-1)公式推论:n1:n2=N1:N2思考和回答① 1mol12C中约含有_____________个12C
② 1molH2O中约含有_____________个H2O
③ 1molSO42-中约含有_____________个SO42-
④ 1molFe中约含有_____________个Fe
⑤ 2molCO2中约含有____________个CO2
⑥ 9.03×1023个O2的物质的量为______6.02×10236.02×10236.02×10236.02×10231.204×10241.5mol在0.5molO2中含有的O2的分子数目解:N(O2) = n × NA = 0.5 mol × 6.02 ×1023 mol -1 = 3.01 × 1023例题1(1) 1.5molO3中约含有_____________个O3
(2) 3.01×1023个O2的物质的量为______规范的练9.03×10230.5mol判断下列说法是否正确
(A)1 摩尔氧
(B)1 摩尔氧原子
(C)2 摩尔分子氢
(D)3 摩尔 水
(E)0.5 摩 二氧化碳[思考]错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子正确 1mol O错误,2mol H2正确 3mol H2O正确 0.5mol CO2 注意 必须指明微粒的种类,如原子、分子、离子等。迁移应用____________氢原子___________氧原子6.02×1023个水分子______O______H1molH2O物质的量:微粒数:1.204×1024个6.02×1023个2mol1mol0.5molNa2SO4含有 mol Na+,
molSO42-含_________________个O
1 0.52mol×6.02×1023mol-1 Na2SO4 —————Na+————— SO42- ————— O
1 2 1 41mol 2mol 1mol 4 molNA 2NA NA 4NA例题2练习⑴ 3.01×1024个硫酸分子的物质的量为 mol;
⑵2 mol H2O中含 mol H和 mol O,
含有 个H2O。
⑶9.03×1023个甲烷分子含 mol C原子、 mol
H原子, mol质子, mol电子。
⑷ CO2mol中含有的氧原子数跟1.806×1024个
H2O分子中含有的氧原子数相同。5421. 204×10241.5615151.5求0.5molNa和足量水反应生成的NaOH的物质的量和H2分子个数。例题3 小结:nmolmolNAmol-1物质的量的单位是摩尔1mol粒子的数目就是阿伏加德罗常数阿伏加德罗常数的准确值为12g12C含有的碳原子数(实验测定),近似值为 6.02×1023物质的量在使用时的注意事项1、物质的量是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。2、适用范围:只适用于微观粒子。如质子、中子、电子、分子、原子等。4、注意部分和整体的关系。可利用公式的推论和小的关系式。如H2O—2H—O3、使用时必须指明微粒的种类。如说1mol氢,1mol氧都是错误的,为规范起见,可这样表示n(H2)、n(Na+)、n(H2O)练习1:下列说法是否正确?
⑴1molNa+中含有NA个钠离子 ( )
⑵1molH2O中含有6.02×1023个水分子( )
⑶1mol氢中含有NA个氢原子 ( )
⑷ 1molCO2含有NA个氧原子 ( )
⑸ 1molH2O中含有1molH2和 1molO ( )
⑹ 1molH2O中含有10NA个质子 ( )√√×××√1 mol12C原子 (6.02×10 23)1212g1 mol氧原子 (6.02×10 23)1616g1 mol氢原子 (6.02×10 23)11g1mol 结论: 1 mol任何物质的质量,以克为单位时,在数值上都等于它的相对原子(或相对分子)质量。请看数据:1摩尔物质的质量水分子(6.02×1023)1818g由上面的数据,你能得出什么结论?摩尔质量定义:单位:单位物质的量的物质所具有的质量。g/mol 或 kg /mol数值:等于该粒子相对原子(分子)质量;n = m /M(特别注意因为两者单位不同,不能说完全相等,只能是数值上相等)还等于1个微粒的质量与NA的乘积24.5gH2SO4 物质的量是多少?解:H2SO4的相对分子质量为98,则H2SO4的摩尔质量为98g/mol 。n( H2SO4 )==0.25mol答: 24.5gH2SO4 物质的量是0.25mol。例题3例题4 1.5molH2SO4 的质量是多少?解:由m=n×Mm(H2SO4)=n(H2SO4)×M(H2SO4)答:1.5molH2SO4 的质量是147.0g。=1.5mol ×98g/mol=147.0g0.01mol某物质的质量为1.08g,此物质的摩尔质量是多少?解: =108g/mol答:此物质的摩尔质量是108g/mol。例题5 【思考】通过上面的学习,你能体会物质的量是如何联系起了微观量和宏观量? 自我检测⑴3.6gH2O的物质的量是 ,含有
个水分子。
⑵11.7gNaCl的物质的量是 ,
共含离子 个。
⑶ 3.01×1022个OH-的物质的量为 ,
质量为 g0.2 mol1. 204×10230.2 mol2. 408×10230.05 mol0.85
宏观上: 4克 32克 36克
2L 1L 2L
微观上: 1个H2分子 一个O2分子 两个H2O分子 第三节 化学中常用的物理量
――物质的量一、物质的量、阿伏伽德罗常数、摩尔
[联想质疑]
如何建立起宏观物质的质量、体积和其所含微观粒子数之间的联系呢? 国际单位制(SI)的7个基本单位物质的量摩[尔]mol物质的量是一种物理量。用于衡量物质所含微粒数目的多少。 * 是一个专用名词,不可以拆分。符号:n* 是物质的量的单位,符号为mol 。 国际上规定:1mol任何微粒所含的微粒数与0.012kg12C所含的碳原子数相等。
0.012kg 12C微观构成?一顶一打:12顶一瓶一箱:24瓶1mol1mol: 6.02×1023个一个 阿伏加德罗常数
6.02 X1023 /mol。符号为NA每摩尔物质含有阿伏伽德罗常数个微粒。 在12克12C中所含的碳原子的个数为阿佛加德罗常数个,为6.02ㄨ1023个碳原子。 物质的量 * 是国际单位制七个基本物理量之一, 符号为n 。 ** 是一个专用名词,不能拆开理解。
** 描述的对象是粒子集体。摩 尔 * 是物质的量的单位,符号为mol 。 在12克12C中所含的碳原子的物质的量为1摩尔,为阿佛加德罗常数个碳原子,约为6.02ㄨ1023个碳原子。物质的量n(单位mol)微粒数N
(单位:个)阿伏加德罗常数NA
(单位:mol-1)公式推论:n1:n2=N1:N2思考和回答① 1mol12C中约含有_____________个12C
② 1molH2O中约含有_____________个H2O
③ 1molSO42-中约含有_____________个SO42-
④ 1molFe中约含有_____________个Fe
⑤ 2molCO2中约含有____________个CO2
⑥ 9.03×1023个O2的物质的量为______6.02×10236.02×10236.02×10236.02×10231.204×10241.5mol在0.5molO2中含有的O2的分子数目解:N(O2) = n × NA = 0.5 mol × 6.02 ×1023 mol -1 = 3.01 × 1023例题1(1) 1.5molO3中约含有_____________个O3
(2) 3.01×1023个O2的物质的量为______规范的练9.03×10230.5mol判断下列说法是否正确
(A)1 摩尔氧
(B)1 摩尔氧原子
(C)2 摩尔分子氢
(D)3 摩尔 水
(E)0.5 摩 二氧化碳[思考]错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子正确 1mol O错误,2mol H2正确 3mol H2O正确 0.5mol CO2 注意 必须指明微粒的种类,如原子、分子、离子等。迁移应用____________氢原子___________氧原子6.02×1023个水分子______O______H1molH2O物质的量:微粒数:1.204×1024个6.02×1023个2mol1mol0.5molNa2SO4含有 mol Na+,
molSO42-含_________________个O
1 0.52mol×6.02×1023mol-1 Na2SO4 —————Na+————— SO42- ————— O
1 2 1 41mol 2mol 1mol 4 molNA 2NA NA 4NA例题2练习⑴ 3.01×1024个硫酸分子的物质的量为 mol;
⑵2 mol H2O中含 mol H和 mol O,
含有 个H2O。
⑶9.03×1023个甲烷分子含 mol C原子、 mol
H原子, mol质子, mol电子。
⑷ CO2mol中含有的氧原子数跟1.806×1024个
H2O分子中含有的氧原子数相同。5421. 204×10241.5615151.5求0.5molNa和足量水反应生成的NaOH的物质的量和H2分子个数。例题3 小结:nmolmolNAmol-1物质的量的单位是摩尔1mol粒子的数目就是阿伏加德罗常数阿伏加德罗常数的准确值为12g12C含有的碳原子数(实验测定),近似值为 6.02×1023物质的量在使用时的注意事项1、物质的量是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。2、适用范围:只适用于微观粒子。如质子、中子、电子、分子、原子等。4、注意部分和整体的关系。可利用公式的推论和小的关系式。如H2O—2H—O3、使用时必须指明微粒的种类。如说1mol氢,1mol氧都是错误的,为规范起见,可这样表示n(H2)、n(Na+)、n(H2O)练习1:下列说法是否正确?
⑴1molNa+中含有NA个钠离子 ( )
⑵1molH2O中含有6.02×1023个水分子( )
⑶1mol氢中含有NA个氢原子 ( )
⑷ 1molCO2含有NA个氧原子 ( )
⑸ 1molH2O中含有1molH2和 1molO ( )
⑹ 1molH2O中含有10NA个质子 ( )√√×××√1 mol12C原子 (6.02×10 23)1212g1 mol氧原子 (6.02×10 23)1616g1 mol氢原子 (6.02×10 23)11g1mol 结论: 1 mol任何物质的质量,以克为单位时,在数值上都等于它的相对原子(或相对分子)质量。请看数据:1摩尔物质的质量水分子(6.02×1023)1818g由上面的数据,你能得出什么结论?摩尔质量定义:单位:单位物质的量的物质所具有的质量。g/mol 或 kg /mol数值:等于该粒子相对原子(分子)质量;n = m /M(特别注意因为两者单位不同,不能说完全相等,只能是数值上相等)还等于1个微粒的质量与NA的乘积24.5gH2SO4 物质的量是多少?解:H2SO4的相对分子质量为98,则H2SO4的摩尔质量为98g/mol 。n( H2SO4 )==0.25mol答: 24.5gH2SO4 物质的量是0.25mol。例题3例题4 1.5molH2SO4 的质量是多少?解:由m=n×Mm(H2SO4)=n(H2SO4)×M(H2SO4)答:1.5molH2SO4 的质量是147.0g。=1.5mol ×98g/mol=147.0g0.01mol某物质的质量为1.08g,此物质的摩尔质量是多少?解: =108g/mol答:此物质的摩尔质量是108g/mol。例题5 【思考】通过上面的学习,你能体会物质的量是如何联系起了微观量和宏观量? 自我检测⑴3.6gH2O的物质的量是 ,含有
个水分子。
⑵11.7gNaCl的物质的量是 ,
共含离子 个。
⑶ 3.01×1022个OH-的物质的量为 ,
质量为 g0.2 mol1. 204×10230.2 mol2. 408×10230.05 mol0.85
